一種檢測(cè)哺乳動(dòng)物血液中微量循環(huán)腫瘤細(xì)胞的特異性方法與流程
本發(fā)明涉及一種檢測(cè)哺乳動(dòng)物血液中微量循環(huán)腫瘤細(xì)胞(CirculatingTumor Cell,CTC)的特異性方法。
背景技術(shù):
一般人們所說(shuō)的“癌癥”習(xí)慣上泛指所有惡性腫瘤,而腫瘤轉(zhuǎn)移是腫瘤研究工作的困境之一,超過(guò)90%的癌癥患者死于腫瘤轉(zhuǎn)移。轉(zhuǎn)移是惡性腫瘤的基本生物學(xué)特征,也是臨床絕大多數(shù)腫瘤患者治療失敗和死亡的主要原因。腫瘤細(xì)胞入侵到原發(fā)腫瘤細(xì)胞的周?chē)M織中,進(jìn)入血液和淋巴管系統(tǒng),形成循環(huán)腫瘤細(xì)胞CTC,并轉(zhuǎn)運(yùn)到遠(yuǎn)端組織,再滲出,適應(yīng)新的微環(huán)境,最終“播種”、“增殖”、“定植”、形成轉(zhuǎn)移灶。因此早期發(fā)現(xiàn)血液中的CTC,對(duì)于患者預(yù)后判斷、療效評(píng)價(jià)和個(gè)體化治療都有著重要的指導(dǎo)作用。
目前,新興的CTC檢測(cè)技術(shù),已成為研究熱點(diǎn)并進(jìn)入臨床應(yīng)用。已經(jīng)建立的CTC檢測(cè)方法包括:聚合酶鏈反應(yīng)和流式細(xì)胞術(shù)(Cell search系統(tǒng))。但是,儀器的高成本、費(fèi)力且耗時(shí)較長(zhǎng)仍然嚴(yán)重制約著CTC作為腫瘤早期診斷的指標(biāo)在臨床中的應(yīng)用。因此,有必要提供一種低成本、操作簡(jiǎn)單、靈敏度高及特異性強(qiáng)的檢測(cè)微量CTC的方法。
近年來(lái),核酸適配體引起了很大的關(guān)注。?核酸適配體是一小段經(jīng)體外篩選得到的寡核苷酸序列(RNA和ssDNA),具有特殊的三級(jí)結(jié)構(gòu),能與相應(yīng)的配體進(jìn)行強(qiáng)特異性和高親和力的結(jié)合。作為一種新型的功能分子探針,核酸適配體因具有易合成及修飾、強(qiáng)穩(wěn)定性、低成本等特點(diǎn),而被認(rèn)為是抗體的理想替代品。可見(jiàn),適配體技術(shù)及其在生物醫(yī)學(xué)的領(lǐng)域有著廣泛的應(yīng)用,可用于特異性識(shí)別靶細(xì)胞(尤其是癌癥細(xì)胞),用于診斷治療及生物傳感等。
基于適配體可特異性地識(shí)別癌癥細(xì)胞的特點(diǎn),同時(shí)結(jié)合免疫磁珠分離技術(shù)對(duì)血液中的循環(huán)腫瘤細(xì)胞進(jìn)行分離。免疫磁珠分離技術(shù)是一種特異性強(qiáng)、靈敏度高及純化性好的的免疫學(xué)檢測(cè)方法和抗原純化手段。目前,該項(xiàng)技術(shù)在細(xì)胞分離、蛋白、免疫學(xué)及微生物學(xué)檢測(cè)等方面均取得了較大的進(jìn)展,是最有推廣價(jià)值的技術(shù)之一。其中,免疫磁珠分離細(xì)胞是基于細(xì)胞表面抗原能與連接有磁珠的特異性單抗相結(jié)合,在外加磁場(chǎng)中,通過(guò)抗體與磁珠相連的細(xì)胞被吸附而滯留在磁場(chǎng)中,無(wú)該種表面抗原的細(xì)胞由于不能與連接著磁珠的特異性單抗結(jié)合而沒(méi)有磁性,不在磁場(chǎng)中停留,從而使細(xì)胞得以分離。
滾環(huán)擴(kuò)增(Rolling Circle Amplification,RCA)是一種高效的恒溫核酸擴(kuò)增手段,且可在短時(shí)間內(nèi)實(shí)現(xiàn)DNA或RNA的指數(shù)擴(kuò)增,通過(guò)結(jié)合生物標(biāo)記等,有效地放大信號(hào),極大地增強(qiáng)了檢測(cè)靈敏度。近幾年,RCA在功能性核酸的制備、生物傳感及納米材料等領(lǐng)域有著越來(lái)越廣泛的應(yīng)用。同時(shí),RCA技術(shù)的發(fā)展得益于其自身高靈敏度和高特異性的特點(diǎn),并且可以與其它高新技術(shù)(如表面修飾技術(shù)、熒光檢測(cè)技術(shù)及納米技術(shù)等)相結(jié)合,開(kāi)辟更好的應(yīng)用前景。
本發(fā)明方法將適配體特異性識(shí)別結(jié)合相應(yīng)配體的特點(diǎn)、免疫磁珠的捕獲技術(shù)及RCA技術(shù)相結(jié)合用于微量CTC檢測(cè),具有特異性強(qiáng)、靈敏度高、檢測(cè)時(shí)間短、成本低的特點(diǎn)。
技術(shù)實(shí)現(xiàn)要素:
本發(fā)明的目的在于提供一種檢測(cè)哺乳動(dòng)物血液中微量CTC的特異性方法。
本發(fā)明所采取的技術(shù)方案是:
(1)微量循環(huán)腫瘤細(xì)胞表面高表達(dá)蛋白高特異性結(jié)合適配體AP的設(shè)計(jì)與合成:以待測(cè)血樣外周血CTC表面高表達(dá)的蛋白為模板,基于Cell-SELEX技術(shù),設(shè)計(jì)可與該蛋白高特異性結(jié)合的適配體AP;
依據(jù)堿基互補(bǔ)配對(duì)原則,設(shè)計(jì)可與AP連接成多環(huán)的引物DNA1、DNA2;其中,DNA1和DNA2有兩段相同的序列片段①和②,依據(jù)片段①設(shè)計(jì)滾環(huán)擴(kuò)增引物(RCA primer),依據(jù)片段②設(shè)計(jì)分子信標(biāo)(MB);
(2)適配體AP成環(huán)反應(yīng)得到CAP,使用同種方法得到環(huán)CDNA1和環(huán)CDNA2;
(3)DNA納米器件PDN的制備:將步驟(2)中得到的CAP、CDNA1、CDNA2以1:1:1-1:5:5的摩爾比混合,雜交,得到DNA納米器件(PDN);
(4)微量循環(huán)腫瘤細(xì)胞所在的單核細(xì)胞層的分離:將待測(cè)血樣用梯度分離液處理后,分離出目標(biāo)CTC所在的單核細(xì)胞層;
(5)DNA納米器件PDN標(biāo)記單核細(xì)胞層中的目標(biāo)細(xì)胞CTC:將步驟(4)分離出的細(xì)胞與步驟(3)的產(chǎn)物PDN以及特異性的免疫磁珠混合共孵育;
(6)免疫磁珠法分離PDN標(biāo)記的CTC:利用免疫磁珠分離技術(shù)洗脫步驟(5)孵育液得到結(jié)合有PDN的目標(biāo)細(xì)胞;
(7)滾環(huán)擴(kuò)增法測(cè)定微量循環(huán)腫瘤細(xì)胞細(xì)胞數(shù):在步驟(6)產(chǎn)物加入RCA primer進(jìn)行滾環(huán)擴(kuò)增,將分子信標(biāo)MB加入滾環(huán)擴(kuò)增產(chǎn)物中孵育,在堿基互補(bǔ)的競(jìng)爭(zhēng)作用下,MB的發(fā)夾結(jié)構(gòu)被打開(kāi),熒光信號(hào)釋放后,檢測(cè)熒光值,以此判斷CTC的數(shù)量。
使用本發(fā)明的方法,可以快速、高效地檢測(cè)癌癥患者外周血中CTC的數(shù)量。本發(fā)明的檢測(cè)方法,避免了使用PCR儀、流式細(xì)胞儀等大型昂貴儀器及耗時(shí)長(zhǎng)等問(wèn)題,有效降低了癌癥患者外周血中循環(huán)腫瘤細(xì)胞CTC的檢測(cè)成本。
本發(fā)明所述的檢測(cè)方法便宜、簡(jiǎn)單,且與已有的檢測(cè)方法相比,新方法所用時(shí)間短,具有高特異性、超靈敏的特點(diǎn)。本發(fā)明可用于癌癥患者外周血中微量CTC的檢測(cè)。
附圖說(shuō)明
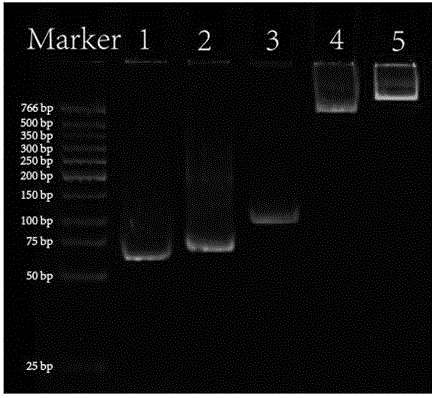
圖1:為本發(fā)明所述的PDN的各單獨(dú)組分及PDN的電泳圖(聚丙烯酰胺凝膠為12%)。圖中:Maker泳道的DNA分子量標(biāo)準(zhǔn)(Low Molecular Weight DNA Ladder);1泳道為:CDNA2;2泳道為:CDNA1;3泳道為:CAP;4泳道為:CDNA1+CDNA2;5泳道為:PDN。
圖2:圖A表示的是熒光值與細(xì)胞數(shù)量的關(guān)系圖,圖B表示的是在518nm處的熒光最大吸收值與CTC數(shù)量的標(biāo)準(zhǔn)曲線(xiàn)。
具體實(shí)施方式
實(shí)施例1
下面結(jié)合實(shí)施例,便于更好地說(shuō)明本發(fā)明。
乳腺癌病人外周血CTC的檢測(cè)新方法的建立
一、引物設(shè)計(jì)
以待測(cè)病人血樣CTC表面高表達(dá)的蛋白Epcam為模板,基于Cell-SELEX技術(shù),設(shè)計(jì)可與Epcam蛋白高特異性結(jié)合的適配體EAD,EAD的序列為:CACTACAGAGGTTGCGTCTGTCCCACGTTGTCATGGGGGGTTGGCCTGGAATCAATCTGAATCAATCTACGACGTACTCCTAACTAGCT;
依據(jù)堿基互補(bǔ)配對(duì)原則,設(shè)計(jì)可與EAD連接成多環(huán)的引物DNA1、DNA2;其中,DNA1和DNA2有兩段相同的序列片段①和②,依據(jù)片段①設(shè)計(jì)滾環(huán)擴(kuò)增引物(RCA primer),依據(jù)片段②設(shè)計(jì)分子信標(biāo)(MB)。
所用到的引物序列如下:
DNA1:
TAGACTTAGTTAGATGCTGCTCCGCCCGTCCCACGTACTTTTTATGTTCTCTCTCTTGCCTCTGtcccacgtccgtctc
DNA2:
GGCAAGAGAGAGAACATAAATCCGCCCGTCCCACGTACTTATCTGAATCAATCTACGACGtcccacgtccgtctc
RCA-primer:AGGGTGCAGGCAGAG
MB:(FAM)GAGTCGCTCCGCCCGTCCCACGTACTTTTAAG GCGACTC(DABCYL)
二、適配體環(huán)化與PDN合成
將稀釋為10μM的EAD進(jìn)行成環(huán)反應(yīng),得到環(huán)CEAD,使用同種方法得到環(huán)CDNA1和環(huán)CDNA2;再將得到的CEAD、CDNA1和CDNA2以1:3:3摩爾比混合,反應(yīng)條件為:90℃退火5min,降至室溫,37℃反應(yīng)1h,得到PDN產(chǎn)物。
成環(huán)反應(yīng)的具體步驟如下:
(1)磷酸化反應(yīng):取1.5ml 離心管,分別加入ddH2O 76.5μl、10×Polynucleotide Kinase Buffer 10μl、ATP 3μl、T4 Polynucleotide Kinase 3μl及Aptamer 7.5μl,總體系為100μl。混勻后置于恒溫金屬浴37℃振蕩反應(yīng)30min后,90℃退火5min,降至室溫。
(2)Ligase連接:在上述aptamer磷酸化產(chǎn)物中加入10×Ligase Buffer 15μl、Templete 10μl及ddH2O 21μl,混勻,置于恒溫金屬浴90℃退火5min,55℃振蕩反應(yīng)2h。待反應(yīng)產(chǎn)物冷卻至室溫后,加入T4 DNA Ligase 4μl,于金屬浴16℃反應(yīng)2h,反應(yīng)結(jié)束后,65℃失活10min,降至室溫。
(3)去templete:在上述反應(yīng)體系中繼續(xù)加入ddH2O 27μl、10×T4 Polymerase Buffer 15μl及T4 Polymerase 3μl,混勻后于恒溫金屬浴37℃振蕩反應(yīng)16h,結(jié)束后85℃失活10min,降至室溫。
(4)產(chǎn)物純化:上述反應(yīng)終體系約200μl,加入1/10體積的3M醋酸鈉溶液(20μl)和2.5體積無(wú)水乙醇(500μl),充分混勻后,豎直放置于-20℃1h,結(jié)束后于4℃ 15,000g離心30min,棄去上清,保留底部沉淀。沉淀用500μl 的70%乙醇(-20℃)打散,于4℃ 15,000g離心30min,棄去上清,保留底部沉淀,重復(fù)此步驟一次。最后,將產(chǎn)物置于真空泵離心濃縮儀中旋轉(zhuǎn)干燥。使用時(shí)加入50μl ddH2O溶解即可。
三、免疫磁珠的選擇
根據(jù)所需檢測(cè)的CTC的類(lèi)型,訂購(gòu)成品的可與CTC相結(jié)合的免疫磁珠。
四、CTC檢測(cè)標(biāo)準(zhǔn)曲線(xiàn)的建立
將乳腺癌BT474細(xì)胞放入血液中來(lái)模擬CTC。
將不同濃度梯度的BT474細(xì)胞(細(xì)胞數(shù)量為0、10、50、100、500、1.0×103、5.0×103、1.0×104、5.0×104、1.0×106)分別與10μl PDN在37℃孵育2h。反復(fù)低速離心3次,洗去未結(jié)合的PDN。在孵育液中10μM 的RCA-primer 6μL 室溫靜置0.5h,隨后加入10μM 的RCA-primer 6μL、10 mM 的dNTP 3μL、5 u/μL 的phi29 polymerase 0.5μL、phi29 DNA polymerase buffer (10×) 5μL以及ddH2O使總體積為200μL在37℃滾環(huán)反應(yīng)4h。
將稀釋為10μM的MB 6μL加入上述步驟的滾環(huán)反應(yīng)產(chǎn)物中,90℃退火5min,室溫放置1h后,利用熒光光譜儀,檢測(cè)熒光值(熒光檢測(cè)條件為:發(fā)射波長(zhǎng)518nm,檢測(cè)范圍500-600nm,室溫)。
由此得到的熒光值與細(xì)胞數(shù)量的關(guān)系圖及CTC檢測(cè)標(biāo)準(zhǔn)曲線(xiàn)如圖2所示,可以看出熒光值隨細(xì)胞數(shù)量增加而增大。從標(biāo)準(zhǔn)曲線(xiàn)的的線(xiàn)性回歸方程的相關(guān)系數(shù)R2可以看出,BT474細(xì)胞數(shù)量與熒光值存在線(xiàn)性正相關(guān)關(guān)系,故可將此回歸方程用于血樣中CTC數(shù)量的計(jì)算。
五、PDN在臨床血樣檢測(cè)中的應(yīng)用
依據(jù)本發(fā)明方法對(duì)隨機(jī)不同腫瘤分期的三個(gè)臨床患乳腺癌病人的血樣進(jìn)行檢測(cè),把檢測(cè)的熒光值(518nm的最大吸收值)代入到標(biāo)準(zhǔn)曲線(xiàn),計(jì)算出血樣中所含的CTC數(shù)量,得到的結(jié)果如表1所示。
表1 本方法對(duì)隨機(jī)不同分期的癌癥病人血樣CTC檢測(cè)的結(jié)果
從臨床血樣檢測(cè)結(jié)果可以看出,由本發(fā)明方法所檢測(cè)到的CTC數(shù)量與癌癥病人的腫瘤分期是相符合的,因此本發(fā)明的方法具有很高的臨床應(yīng)用價(jià)值。
本發(fā)明的方法,依據(jù)CTC表面高表達(dá)的蛋白和Cell-SELEX技術(shù)設(shè)計(jì)的環(huán)狀特異性適配體可實(shí)現(xiàn)檢測(cè)的強(qiáng)特異性,且基于多環(huán)連接的RCA的應(yīng)用,進(jìn)行熒光檢測(cè),大大提高檢測(cè)效率,實(shí)現(xiàn)血液中10個(gè)CTC的超靈敏檢測(cè)。使用本發(fā)明的方法,避免了使用PCR儀、流式細(xì)胞儀等大型昂貴儀器及耗時(shí)長(zhǎng)等問(wèn)題,有效降低了癌癥病人外周血中循環(huán)腫瘤細(xì)胞CTC的檢測(cè)成本,實(shí)現(xiàn)癌癥病人外周血中CTC的微量檢測(cè)。
以上所述僅為本發(fā)明的較佳實(shí)施例,凡依本發(fā)明申請(qǐng)專(zhuān)利范圍所做的均等變化與修飾,皆應(yīng)屬本發(fā)明的涵蓋范圍。
<110> 福州大學(xué)
<120> 一種檢測(cè)哺乳動(dòng)物血液中微量循環(huán)腫瘤細(xì)胞的特異性方法
<130> 5
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 89
<212> DNA
<213> EAD
<400> 1
cactacagag gttgcgtctg tcccacgttg tcatgggggg ttggcctgga atcaatctga 60
atcaatctac gacgtactcc taactagct 89
<210> 2
<211> 79
<212> DNA
<213> DNA1
<400> 2
tagacttagt tagatgctgc tccgcccgtc ccacgtactt tttatgttct ctctcttgcc 60
tctgtcccac gtccgtctc 79
<210> 3
<211> 75
<212> DNA
<213> DNA2
<400> 3
ggcaagagag agaacataaa tccgcccgtc ccacgtactt atctgaatca atctacgacg 60
tcccacgtcc gtctc 75
<210> 4
<211> 15
<212> DNA
<213> RCA-primer
<400> 4
agggtgcagg cagag 15
<210> 5
<211> 39
<212> DNA
<213> MB
<400> 5
gagtcgctcc gcccgtccca cgtactttta aggcgactc 39
- 還沒(méi)有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 一套橙子自檢測(cè)自循環(huán)清洗系統(tǒng)的制作方法
- 一套水果自檢測(cè)自循環(huán)清洗系統(tǒng)的制作方法
- 一種循環(huán)稀有細(xì)胞分選儀的捕捉系統(tǒng)的制作方法
- 一種腫瘤檢測(cè)裝置的制造方法
- 循環(huán)稀有細(xì)胞分選儀的制作方法
- 基于pdms芯片的片上細(xì)胞檢測(cè)系統(tǒng)及方法
- 一種循環(huán)腫瘤細(xì)胞自動(dòng)分離系統(tǒng)的制作方法
- 一種基于手性納米組裝體的循環(huán)腫瘤細(xì)胞檢測(cè)新方法
- 一種人循環(huán)miR?122的檢測(cè)方法
- 一種檢測(cè)循環(huán)腫瘤細(xì)胞的試劑盒的制作方法
- 用于腫瘤早期篩查的腫瘤血小板RNA定量檢測(cè)模型及方法與制造工藝
- 一種偶聯(lián)抗體的仿生免疫磁球及其制備方法與制造工藝
- 一種循環(huán)腫瘤細(xì)胞快速檢測(cè)試劑盒及其制備和應(yīng)用方法與制造工藝
- 循環(huán)腫瘤細(xì)胞表面標(biāo)志分子磷脂酰肌醇蛋白聚糖?3的檢測(cè)方法與制造工藝
- 使用組合的核酸酶、連接酶、聚合酶和測(cè)序反應(yīng)識(shí)別和枚舉核酸序列、表達(dá)、拷貝或DNA甲基化變化的方法與制造工藝
- 一種循環(huán)腫瘤細(xì)胞分析儀的制造方法與工藝
- 一種針對(duì)細(xì)胞的激光導(dǎo)向微流控芯片的制造方法與工藝
- 一種循環(huán)腫瘤細(xì)胞的富集裝置的制造方法
- 一種基于微通孔芯片的腫瘤細(xì)胞分離裝置的制造方法
- 稀有細(xì)胞富集過(guò)濾裝置的制造方法
- 一種用于檢測(cè)循環(huán)腫瘤細(xì)胞侵襲力的試劑盒的制作方法
- 晚期乳腺癌患者外周血循環(huán)腫瘤細(xì)胞pr基因的檢測(cè)方法
- 一種改進(jìn)的低頻細(xì)胞循環(huán)分選方法及其分選系統(tǒng)的制作方法
- 生物組織光聲循環(huán)腫瘤細(xì)胞檢測(cè)診斷裝置及檢測(cè)診斷方法
- 一種無(wú)創(chuàng)循環(huán)腫瘤細(xì)胞檢測(cè)診斷裝置及其檢測(cè)診斷方法
- 一種測(cè)定血液中循環(huán)上皮腫瘤細(xì)胞數(shù)量的方法
- CABYR-a/b在促進(jìn)腫瘤細(xì)胞對(duì)VP16和TRAIL的敏感性中的應(yīng)用
- 腫瘤細(xì)胞及腫瘤血管雙靶向納米粒、構(gòu)建方法及應(yīng)用
- 一種循環(huán)腫瘤細(xì)胞檢測(cè)試劑盒及其制備方法和應(yīng)用
- 具有腫瘤細(xì)胞g1期阻滯作用的化合物及其制備和應(yīng)用
- 一種全自動(dòng)循環(huán)腫瘤細(xì)胞陰性富集裝置的制作方法
- 一種尿液脫落腫瘤細(xì)胞檢測(cè)芯片及其應(yīng)用的制作方法與工藝
- 循環(huán)腫瘤細(xì)胞的分離和檢測(cè)方法與流程
- 一種鼻咽癌循環(huán)腫瘤細(xì)胞檢測(cè)試劑盒的制作方法與工藝
- 一種基于拉曼光譜的循環(huán)腫瘤細(xì)胞自動(dòng)檢測(cè)系統(tǒng)的制作方法與工藝
- 一種循環(huán)腫瘤細(xì)胞富集與顯微成像樣本制作裝置的制作方法
- 循環(huán)血腫瘤細(xì)胞的聯(lián)合分選純化裝置及分選檢測(cè)方法與流程
- 用于捕獲和鑒定循環(huán)腫瘤細(xì)胞的微流控芯片的制作方法與工藝
- 一種結(jié)直腸癌循環(huán)腫瘤細(xì)胞的富集和分析方法與流程
- 一種高通量快速捕獲提純循環(huán)腫瘤細(xì)胞的設(shè)備及方法與流程
- 用于檢測(cè)循環(huán)腫瘤細(xì)胞(ctcs)的方法
- 一種用于檢測(cè)循環(huán)腫瘤細(xì)胞表型的試劑盒的制作方法
- 一種細(xì)胞檢測(cè)儀的制作方法
- 循環(huán)腫瘤細(xì)胞代謝活動(dòng)檢測(cè)裝置的制造方法
- 晚期乳腺癌患者外周血循環(huán)腫瘤細(xì)胞pr基因的檢測(cè)方法
- 一種無(wú)標(biāo)記腫瘤細(xì)胞檢測(cè)診斷裝置及其檢測(cè)診斷方法
- 生物組織光聲循環(huán)腫瘤細(xì)胞檢測(cè)診斷裝置及檢測(cè)診斷方法
- 一種測(cè)定血液中循環(huán)上皮腫瘤細(xì)胞數(shù)量的方法
- 一種循環(huán)腫瘤細(xì)胞檢測(cè)試劑盒及其制備方法和應(yīng)用
- 肺癌循環(huán)腫瘤細(xì)胞檢測(cè)裝置的制造方法
- 一種鼻咽癌循環(huán)腫瘤細(xì)胞檢測(cè)試劑盒的制作方法與工藝
- 一種基于拉曼光譜的循環(huán)腫瘤細(xì)胞自動(dòng)檢測(cè)系統(tǒng)的制作方法與工藝
- 一種循環(huán)腫瘤細(xì)胞富集與顯微成像樣本制作裝置的制作方法
- 循環(huán)血腫瘤細(xì)胞的聯(lián)合分選純化裝置及分選檢測(cè)方法與流程
- 用于捕獲和鑒定循環(huán)腫瘤細(xì)胞的微流控芯片的制作方法與工藝
- 一種結(jié)直腸癌循環(huán)腫瘤細(xì)胞的富集和分析方法與流程
- 一種高通量快速捕獲提純循環(huán)腫瘤細(xì)胞的設(shè)備及方法與流程
- 一種用于捕獲循環(huán)腫瘤細(xì)胞團(tuán)簇的微流體芯片及其制備方法與流程
- 一種全自動(dòng)循環(huán)腫瘤細(xì)胞陽(yáng)性富集裝置的制作方法
- 一種全自動(dòng)循環(huán)腫瘤細(xì)胞陰性富集裝置的制作方法
- 循環(huán)血腫瘤細(xì)胞的聯(lián)合分選純化裝置及分選檢測(cè)方法與流程
- 一種結(jié)直腸癌循環(huán)腫瘤細(xì)胞的富集和分析方法與流程
- 一種高通量快速捕獲提純循環(huán)腫瘤細(xì)胞的設(shè)備及方法與流程
- 一種用于捕獲循環(huán)腫瘤細(xì)胞團(tuán)簇的微流體芯片及其制備方法與流程
- 一種全自動(dòng)循環(huán)腫瘤細(xì)胞陽(yáng)性富集裝置的制作方法
- 用于肺癌的循環(huán)腫瘤細(xì)胞診斷的制作方法與工藝
- 與循環(huán)腫瘤細(xì)胞相關(guān)的方法和測(cè)定法與流程
- 個(gè)體化外周血循環(huán)腫瘤細(xì)胞聯(lián)合腫瘤標(biāo)記物檢測(cè)對(duì)晚期結(jié)腸癌患者化療療效的評(píng)估的制作方法與工藝
- 一種高通量快速捕獲提純循環(huán)腫瘤細(xì)胞的設(shè)備及方法與流程
- 一種高效率循環(huán)腫瘤細(xì)胞富集方法與流程
- 留置針組件及與留置針配套的循環(huán)腫瘤細(xì)胞在體捕獲裝置的制作方法
- 循環(huán)腫瘤細(xì)胞(CTC)全自動(dòng)掃描與分析檢測(cè)系統(tǒng)及臨床檢測(cè)方法與流程
- 一種循環(huán)腫瘤細(xì)胞分選富集裝置的制作方法
- 一種用于基于CTC循環(huán)腫瘤細(xì)胞的腫瘤精準(zhǔn)治療方法的裝置與流程
- 一種細(xì)胞采集器的制造方法與工藝
- 消化道腫瘤細(xì)胞采集器的制造方法與工藝
- 一種循環(huán)腫瘤細(xì)胞分離系統(tǒng)的制造方法與工藝
- 一種用于循環(huán)腫瘤細(xì)胞分離的微流控芯片,一種循環(huán)腫瘤細(xì)胞分離方法以及計(jì)數(shù)方法與流程
- 一種循環(huán)腫瘤細(xì)胞小鼠模型、其構(gòu)建方法及應(yīng)用與流程
- 一種檢測(cè)哺乳動(dòng)物血液中微量循環(huán)腫瘤細(xì)胞的特異性方法與制造工藝