一種玉米整株TRV載體介導病毒誘導基因沉默方法與流程
本發明屬于植物基因工程技術領域,具體涉及一種玉米整株TRV載體介導病毒誘導基因沉默方法。
背景介紹
植物突變體很難獲得,有些基因的突變對植物可能是致死的,基因沉默相對容易獲得,病毒誘導的基因沉默(Virus-induced gene silencing,VIGS)是一種轉錄后基因沉默技術,作為一種有效的反向遺傳學技術已經廣泛應用于植物基因工程的研究中,其作用原理是植物在抵御病毒侵染時會啟動RNA沉默(RNA silencing)機制。植物體內的Dicer-like protein4可以識別病毒復制過程中產生dsRNA,并將其切割成21-24nt的siRNAs(small interferingRNAs),siRNAs中的一條鏈與Agronatue(AGO)等蛋白結合形成RNA誘導的沉默復合體(RNA induced silencing complex,RISC),并特異的與同源的靶標mRNA結合最終導致靶標mRNA的降解,這一過程即病毒誘導的基因沉默。同樣的,如果將寄主植物基因的片段克隆島病毒VIGS載體中,當寄主植物通過RNA沉默引起防御反應時,相應的寄主基因也會被沉默。
一系列改造過的RNA或DNA病毒載體被用于VIGS(Becker and Lange,2010)。煙草脆裂病毒(Tobacco rattle virus,TRV)是一類應用比較廣泛而且效率和持久性較好的病毒載體,能夠介導基因沉默同時不會帶來病毒誘導的癥狀。改造后的病毒能夠促進非病毒序列的插入以及對植物的后續感染,也可以鑒定宿主植物生長點的基因,因此TRV在植物基因功能鑒定中具有廣泛的應用。
玉米(學名:Zea mays),亦稱玉蜀黍、包谷、苞米、棒子。粵語稱為粟米,閩南語稱作番麥。是一年生禾本科草本植物,是重要的糧食作物和重要的飼料來源,也是全世界總產量最高的糧食作物。玉米也是我國重要的糧食作物,玉米基因組測序的初步完成為玉米功能基因組學的研究提供了重要的參考(Schnable et al.,2009)。但是玉米基因組復雜,突變體不易獲得,遺傳轉化困難,受基因型限制等這些對玉米基因功能的研究帶來了諸多不便。
技術實現要素:
為了解決上述問題,本發明提供一種快速方便的玉米整株TRV載體介導病毒誘導基因沉默方法及應用,能夠快速高效的在整個玉米植株中沉默目的基因。
一種玉米整株TRV載體介導病毒誘導基因沉默的方法,具體步驟如下:
步驟(1):取玉米種子50粒,用刀片將胚上方的種皮劃開;用有效氯為1%的次氯酸
鈉消毒液進行種子消毒,備用;
步驟(2):用基因工程的方法將擴增后的番茄八氫番茄紅素脫氫酶(下稱:番茄PDS)基因片段連接到TRV病毒誘導基因沉默載體pTRV2中,得到pTRV-SlPDS;
具體步驟如下:
cDNA合成:按TaKaRa提取試劑盒操作說明提取番茄的總RNA,以1μg的總RNA做模板,按照TaKaRacDNA合成試劑盒操作說明合成cDNA的第一鏈,然后稀釋10倍備用;
PDS基因擴增:設計引物,上游引物5’-CGGGGTACCGGCACTCAACTTTATAAACC-3’和下游引物5’-CGGGGATCCTTCAGTTTTCTGTCAAACC-3’,以番茄的cDNA第一鏈為模板、用KAPA HiFi PCR Kits的50μL體系進行擴增;擴增程序為95℃預變性3min;30個循環的98℃變性20s,60℃退火20s,72℃延伸30s;72℃后延伸5min,4℃保存;PCR產物經電泳檢測為單一條帶,純化后備用;番茄的cDNA經PCR擴增后的產物為409-bp番茄PDS基因片段;
pTRV-SlPDS質粒構建:純化后的PCR基因片段經KpnI-BamHI雙酶切后,與經KpnI-BamHI雙酶切的pTRV2質粒用T4-DNA連接酶連接,連接產物轉化到大腸桿菌DH5α感受態細胞,涂布于含有50mg/L Kan抗生素的LB平板培養基,37℃倒置過夜培養,長出單克隆,挑取單克隆至含有50mg/LKan抗生素的液體LB培養基中,37℃,250轉每分鐘震蕩培養12小時,提取質粒,驗證正確后,備用;
步驟(3)農桿菌轉化及培養:
3.1)將驗證正確的pTRV-SlPDS、pTRV2以及pTRV1質粒分別用液氮凍融法轉化到農桿菌GV3101感受態細胞中,所述的液氮凍融法具體方法為:取農桿菌GV3101感受態細胞,冰上融化,加入200納克待轉質粒,冰浴30分鐘,液氮速凍2分鐘,37℃水浴鍋水浴2分鐘,冰浴2分鐘,加入800微升無抗LB液體培養基,28℃180轉每分鐘震蕩培養3小時,涂布于含有50mg/L Kna和50mg/L Rif抗生素的固體LB培養基上,28℃倒置避光培養3天長出單克隆;挑取單克隆于含有50mg/L Kan和50mg/L Rif抗生素的液體LB培養基中,28℃200轉每分鐘震蕩培養24小時,經菌液PCR鑒定合格后,得到含有質粒pTRV1、pTRV2和pTRV-SlPDS農桿菌GV3101陽性菌株,記為TRV1、TRV2和TRV-SlPDS,保菌備用;
3.2)將含有TRV1、TRV2、TRV-SlPDS質粒的農桿菌GV3101菌液,分別在含有抗生素的LB平板培養基上劃線,28℃倒置避光培養3天長出單克隆;
3.3)分別挑取3.2)中的單克隆放于含有抗生素的LB液體培養基中,用離心管在28℃、200轉/min條件下,震蕩培養24小時,以實現單克隆的增殖;
3.4)將3.3)得到的TRV1與TRV2單克隆培養液以1:1混合,TRV1與TRV-SlPDS單克隆培養液以1:1混合,分別按1:100轉接到相同的LB培養基上,在三角瓶中繼續培養到菌液的O.D.600=0.04-1.5,并調整兩個三角瓶中的菌液的O.D.600值相同;
步驟(4)配制轉化菌液:
向步驟(3)所得的菌液中加入乙酰丁香酮(AS)終濃度為19.62mg·L-1、半胱氨酸(Cys)終濃度為400mg·L-1和吐溫20(Tween 20)終濃度為5ml·L-1,均勻混合得到含TRV1與TRV2的轉化菌液和含TRV1與TRV-SlPDS的轉化菌液,放置于超凈工作臺中備用;
步驟(5)玉米種子侵染:將等量的處理過的玉米分別放入帶橡膠塞的10ml玻璃瓶中,記為玻璃瓶1和2,玻璃瓶1中加入5ml含TRV1與TRV2的轉化菌液,玻璃瓶2中加入5ml含TRV1與TRV-SlPDS的轉化菌液,使種子完全浸泡在轉化菌液中;用20ml注射器對玻璃瓶抽真空,每次保持15s,操作1~4次;最后,分別將玻璃瓶1、玻璃瓶2中的玉米種子和轉化菌液倒入步驟(4)相應的剩余轉化菌液中,在28℃、200轉每分鐘下過夜培養0-25小時;
培養結束,超凈臺中用無菌水清洗干凈,將經TRV1與TRV2以1:1混合侵染過的玉米和經TRV1與TRV-SlPDS以1:1混合侵染過的玉米清洗干凈,分別轉接到相同的固體MS培養基上,培養條件為:19-22℃,光照強度為150μmol·m-2·s-1,光周期為16小時光照/8小時黑暗,相對濕度為55%,培養至長出葉片,移栽至土壤中繼續生長兩周后觀察表型,提取DNA采用TRV殼蛋白基因檢測番茄PDS病毒的擴增情況,提取RNA使用半定量RT-PCR方法檢測被沉默玉米中PDS基因轉錄本的沉默效果。
進一步,步驟(3)中,100ml三角瓶中培養的菌液的OD600的最優值是0.3.
進一步,步驟(4)中,采用乙酰丁香酮、半胱氨酸和吐溫20的混合液培養效果最佳,混合液中,乙酰丁香酮,終濃度為19.62mg·L-1;半胱氨酸,終濃度為400mg·L-1,;吐溫20,終濃度為5ml·L-1。
進一步,步驟(5)中,帶橡膠塞的10ml玻璃瓶中,同時加入轉化菌液5ml,是種子完全浸泡在轉化菌液中;用20ml注射器抽真空,每次保持15秒,操作4次,效果最佳。
進一步,步驟(5)中,所述的分別將玻璃瓶1、玻璃瓶2中的玉米種子和轉化菌液倒入步驟(4)相應的剩余轉化菌液中,在28℃、200轉每分鐘下過夜培養15小時,侵染效果最佳。
與現有技術相比較,本發明具有以下技術創新點:
(1)玉米基因組復雜,突變體不易獲得,遺傳轉化困難且受基因型限制,本發明首創利用利用TRV、采用番茄PDS病毒基因對玉米種子進行病毒載體的侵染,進而實現玉米PDS基因沉默,本發明方法簡便、快捷、高效、低成本、不需要基因轉化,且本發明為全株沉默,效率高,方便研究目的基因在各個組織中功能。
(2)本發明首創對玉米種子進行負壓輔助侵染的方法,該法方便快捷、侵染效果好。
附圖說明
圖1玉米PDS基因ZmPDS和番茄PDS基因SlPDS片段相似度比對結果;
圖2 TRV介導的番茄PDS基因沉默的玉米植株萌發16天的表型;
圖3半定量檢測沉默玉米植株中PDS基因表達水平;
圖4不同參數下TRV誘導玉米基因沉默效果。
具體實施方式
下面通過實例對本發明作進一步闡述,其目的在于更好理解本發明內容而非限制本發明的保護范圍。
實施例沉默玉米PDS基因
一種玉米整株TRV載體介導病毒誘導基因沉默的方法:
原料來源:玉米品種為鄭單958
KpnI-BamHI,購自NEB公司;
T4-DNA連接酶,購自NEB公司;
VIGS實驗所用沉默載體為煙草脆裂病毒(TRV)的RNA1和RNA2cDNA的雙元表達載體,分別為TRV1和TRV2由劍橋大學David Baulcombe教授和清華大學劉玉樂教授饋贈。pTRV1載體包括編碼RNA依賴的RNA聚合酶、運動蛋白和16kD蛋白的基因,是VIGS體系的輔助病毒載體。pTRV2載體包括衣殼蛋白(Cp)基因、多克隆位點(MCS)等,用于目的基因的構建。
具體步驟如下:
步驟(1):取玉米種子50粒,用刀片將胚上方的種皮劃開;用有效氯為1%的次氯酸鈉消毒液進行種子消毒,備用;
步驟(2):用基因工程的方法將擴增后的番茄八氫番茄紅素脫氫酶(下稱:番茄PDS)基因片段連接到TRV病毒誘導基因沉默載體pTRV2中,得到pTRV-SlPDS;
具體步驟如下:
cDNA合成:按TaKaRa提取試劑盒操作說明提取番茄的總RNA,以1μg的總RNA做模板,按照TaKaRacDNA合成試劑盒操作說明合成cDNA的第一鏈,然后稀釋10倍備用;
PDS基因擴增:設計引物,上游引物5’-CGGGGTACCGGCACTCAACTTTATAAACC-3’和下游引物5’-CGGGGATCCTTCAGTTTTCTGTCAAACC-3’,以番茄的cDNA第一鏈為模板、用KAPA HiFi PCR Kits的50μL體系進行擴增;擴增程序為95℃預變性3min;30個循環的98℃變性20s,60℃退火20s,72℃延伸30s;72℃后延伸5min,4℃保存;PCR產物經電泳檢測為單一條帶,純化后備用;番茄PDS經PCR擴增后的產物為409-bp番茄PDS基因片段;番茄PDS經PCR擴增后所得的番茄PDS基因片段與玉米PDS基因ZmPDS的相似度為78.24%,詳見圖1;
pTRV-SlPDS質粒構建:純化后的PCR基因片段經KpnI-BamHI雙酶切后,與經KpnI-BamHI雙酶切的pTRV2質粒用T4-DNA連接酶連接,連接產物轉化到大腸桿菌DH5α感受態細胞,涂布于含有50mg/L Kan抗生素的LB平板培養基,37℃倒置過夜培養,長出單克隆,挑取單克隆至含有50mg/LKan抗生素的液體LB培養基中,37℃,250轉每分鐘震蕩培養12小時,提取質粒,驗證正確后,備用;
步驟(3)農桿菌轉化及培養:
3.1)將驗證正確的pTRV-SlPDS、pTRV2以及pTRV1質粒分別用液氮凍融法轉化到農桿菌GV3101感受態細胞中,所述的液氮凍融法具體方法為:取農桿菌GV3101感受態細胞,冰上融化,加入200納克待轉質粒,冰浴30分鐘,液氮速凍2分鐘,37℃水浴鍋水浴2分鐘,冰浴2分鐘,加入800微升無抗LB液體培養基,28℃180轉每分鐘震蕩培養3小時,涂布于含有50mg/L Kna和50mg/L Rif抗生素的固體LB培養基上,28℃倒置避光培養3天長出單克隆;挑取單克隆于含有50mg/L Kan和50mg/L Rif抗生素的液體LB培養基中,28℃200轉每分鐘震蕩培養24小時,經菌液PCR鑒定合格后,得到含有質粒pTRV1、pTRV2和pTRV-SlPDS農桿菌GV3101陽性菌株,記為TRV1、TRV2和TRV-SlPDS,保菌備用;
3.2)將含有TRV1、TRV2、TRV-SlPDS質粒的農桿菌GV3101菌液,分別在含有抗生素的LB平板培養基上劃線,28℃倒置避光培養3天長出單克隆;
3.3)分別挑取3.2)中的單克隆放于含有抗生素的LB液體培養基中,用離心管在28℃、200轉/min條件下,震蕩培養24小時,以實現單克隆的增殖;
3.4)將3.3)得到的TRV1與TRV2單克隆培養液以1:1混合,TRV1與TRV-SlPDS單克隆培養液以1:1混合,分別按1:100轉接到相同的LB培養基上,在三角瓶中繼續培養到菌液的O.D.600=0.04-1.5(OD600最優值是0.3,參見圖4(C)),并調整兩個三角瓶中的菌液的O.D.600值相同;
步驟(4)配制轉化菌液:
向步驟(3)所得的菌液中加入乙酰丁香酮(AS)終濃度為19.62mg·L-1、半胱氨酸(Cys)終濃度為400mg·L-1和吐溫20(Tween 20)終濃度為5ml·L-1,(采用乙酰丁香酮、半胱氨酸和吐溫20的混合液培養效果最佳,圖4表示不同參數下,TRV誘導基因沉默效果,圖4A表示:不同組分侵染液對基因沉默效率的影響,結果顯示:采用乙酰丁香酮、半胱氨酸和吐溫20的混合液培養效果最佳,混合液中,乙酰丁香酮,終濃度為19.62mg·L-1;半胱氨酸,終濃度為400mg·L-1;吐溫20,終濃度為5ml·L-1),均勻混合得到含TRV1與TRV2的轉化菌液和含TRV1與TRV-SlPDS的轉化菌液,放置于超凈工作臺中備用;
步驟(5)玉米種子侵染:
將等量的處理過的玉米分別放入帶橡膠塞的10ml玻璃瓶中,記為玻璃瓶1和2,玻璃瓶1中加入5ml含TRV1與TRV2的轉化菌液,玻璃瓶2中加入5ml含TRV1與TRV-SlPDS的轉化菌液,使種子完全浸泡在轉化菌液中;用20ml注射器對玻璃瓶抽真空,每次保持15s,操作1~4次(利用注射器抽真空能非常有效的輔助侵染,真空處理每次15s,四次即總時間60s沉默效率最高(參見圖4(B));最后,分別將玻璃瓶1、玻璃瓶2中的玉米種子和轉化菌液倒入步驟(4)相應的剩余轉化菌液中,在28℃、200轉每分鐘下過夜培養0-25h(侵染效果最好的是和農桿菌共培養15小時,參見圖4(D));
培養結束,超凈臺中用無菌水清洗干凈,將經TRV1與TRV2以1:1混合侵染過的玉米和經TRV1與TRV-SlPDS以1:1混合侵染過的玉米清洗干凈,分別轉接到相同的固體MS培養基上,培養條件為:19-22℃,光照強度為150μmol·m-2·s-1,光周期為16小時光照/8小時黑暗,相對濕度為55%,培養至長出葉片,移栽至土壤中繼續生長兩周后觀察表型,提取DNA采用TRV殼蛋白基因檢測番茄PDS病毒的擴增情況,提取RNA使用半定量RT-PCR方法檢測被沉默玉米中PDS基因轉錄本的沉默效果。
結果分析:
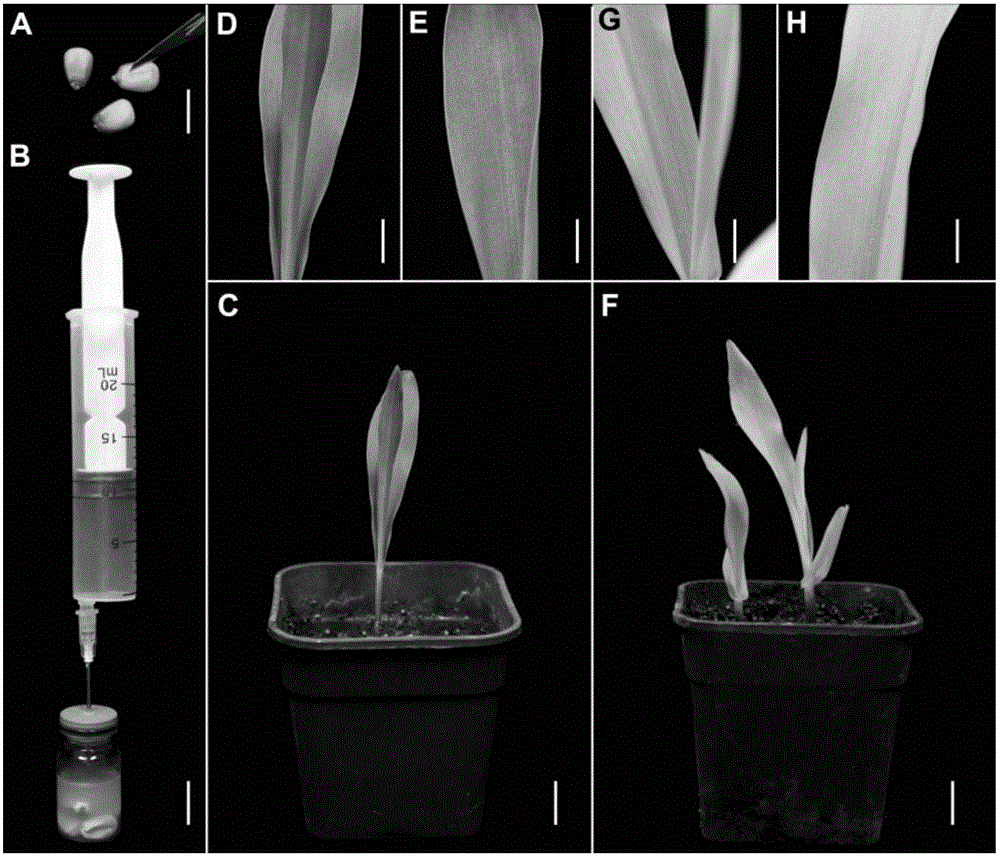
1.對經TRV1與TRV2以1:1混合侵染過的玉米和經TRV1與TRV-SlPDS以1:1混合侵染過的玉米清洗干凈,分別轉接到相同的固體MS培養基上,培養條件為:19-22℃,光照強度為150μmol·m-2·s-1,光周期為16小時光照/8小時黑暗,相對濕度為55%,培養至長出葉片,移栽至土壤中繼續生長兩周后觀察表型,結果如圖2所示(圖中,A.表示本實驗使用的玉米種子,用手術刀劃開種皮;B表示:真空輔助攜帶病毒質粒的農桿菌侵染玉米種子;C-E表示經TRV1與TRV2以1:1侵染的玉米種子萌發16天后的表型(作為對照組);F-H表示:經TRV1與TRV-SlPDS以1:1侵染后的玉米種子萌發16天后的表型;圖中,標尺(A和B),1.41cm;(C,和F),1.27cm;(D,E,G和H),6.16mm;):經TRV1與TRV2以1:1混合侵染過的玉米種子,萌發16天后長勢良好,葉子呈綠色或黃綠色,表示控制其葉綠素合成的基因未沉默;經TRV1與TRV-SlPDS 1:1混合侵染過的玉米種子,萌發16天后,葉子呈白色,產生光漂白現象,表示控制其葉綠素合成的PDS基因沉默;由此可知,玉米種子經TRV載體介導番茄PDS病毒基因侵染后,控制其葉綠素合成的PDS基因沉默。
3.按照TaKaRa提取試劑盒提取經TRV1與TRV2 1:1混合侵染過的玉米萌發16天的植株和經TRV1與TRV-SlPDS 1:1混合侵染過的玉米萌發16天的植株的總RNA。以1μg提的總RNA做模板,按照cDNA合成試劑盒(TaKaRa)操作說明合成第一鏈cDNA,然后稀釋10倍備用。采用半定量RT-PCR方法檢測沉默植株中PDS基因轉錄本的沉默效果。玉米Actin基因(登錄號J01238)為內參基因,玉米PDS基因(登錄號L39266)。半定量RT-PCR引物序列(ZmActin:5’-CAATGGCACTGGAATGGT-3’和5’-ATCTTCAGGCGAAACACG-3’,ZmPDS:5’-GCTTACCTGGCCCGAGAAGGTGAAGTTT-3’和5’-TTCAGTTTTCTGTCAAACC-3’)。PCR所用試劑為Taq酶預混液(2×Taq PCR StarMix with Loading Dye,購于北京康潤科技有限公司),20μl體系,按照說明書配制,PCR反應條件:95℃預變性3min;28-36個循環的95℃變性30s,58℃退火30s,72℃延伸30s;72℃延伸5min,4℃保存;按照上述條件進行28、30、32、34和36個不同循環數的擴增,采用1%瓊脂糖凝膠電泳檢測PCR擴增產物。結果如圖3所示:與內參基因相比較,經TRV1與TRV-SlPDS 1:1混合侵染過的玉米萌發16天的植株的根部和葉片中,玉米PDS基因的表達量顯著降低。
結果分析1、結果分析2和結果分析3分別從植株表型和RNA水平兩個角度證明了本申請提出的“一種玉米整株TRV載體介導病毒誘導基因沉默的方法”,能夠實現對特定基因進行基因沉默。
- 還沒有人留言評論。精彩留言會獲得點贊!