藍舌病病毒VP7蛋白群特異性抗原表位多肽及其應用的制作方法
本發明涉及一種抗原表位多肽,特別涉及一種藍舌病病毒25型VP7蛋白單克隆抗體3H7細胞株識別的藍舌病病毒VP7蛋白群特異性抗原表位多肽及其在檢測藍舌病病毒中的用途,本發明屬于生物技術領域。
背景技術:
目前世界上多個國家都已分離到藍舌病病毒(Bluetongue virus,BTV),并且隨著全球氣候變暖該病的分布范圍在不斷的擴大,呈現全球性分布。迄今為止已發現27種血清型的藍舌病病毒,各型之間無交叉保護[1-2]。世界動物衛生組織(OIE)將藍舌病列為必須通報疫病,我國也將藍舌病列為一類疫病。該病主要通過庫蠓、伊蚊等進行傳播,也可經由胎盤感染胎兒進行垂直傳播[3]。BTV主要感染綿羊等反芻類動物,其主要癥狀為病畜體溫升高,精神萎靡、厭食流涎,患畜諸多部位出現不同程度的水腫。口腔黏膜充血、糜爛、發紺,為藍舌病的典型癥狀。BTV25型于2008年從瑞士山羊血液樣本中分離獲得。BTV 25型的VP2與其他血清型病毒VP2的同源性僅為23%-79%。感染BTV25型的牲畜無典型癥狀,常常被忽略,疫病一旦爆發,會造成極為嚴重的經濟損失[4]。
藍舌病于1876年首次發現以來,新的血清型不斷的被發現,同時爆發的范圍也在逐漸的擴大。2014年在法國科西嘉島首次發現并分離到了27型藍舌病病毒[5],有報道稱目前正在中東及南非相繼發現并正在分離28型和29型藍舌病病毒[6-7]。我國已檢測出BTV-1、BTV-2、BTV-3、BTV-4、BTV-12、BTV-15、BTV-16七種血清型,其中BTV1型和16型為我國主要的致病血清型[8]。
BTV基因組由10個線性雙鏈RNA組成,總分子量為1.3×107Da。基因組由大片段(L1-L3)、中片段(M4-M6)、小片段(S7-S10)組成,其共編碼7個結構蛋白(VP1-VP7)和4種非結構蛋白(NS1、NS2、NS3/NS3a和NS4)[9-10]。藍舌病的病毒有雙衣殼結構,L2和M5基因編碼的VP2和VP5是構成BTV外殼主要成分,約為病毒總蛋白的40%。病毒內殼即核心衣殼主要由L3和S7編碼的VP3和VP7構成。VP7在核衣殼內主要是以三聚體的形式存在,VP3是亞核心顆粒的主要蛋白,兩者均是BTV群特異性抗原。
病毒基因組及VP1、VP4、VP6三種結構蛋白被包裹在核心衣殼內部[11]。VP7蛋白是用于建立BTV群特異性血清學檢測方法的最佳選擇,由于在所有血清型當中其序列和抗原性是高度保守。細胞被BTV感染后,VP7是最早被檢測出的抗原,而且BTV感染動物后,抗VP7抗體是機體產生的抗BTV主要的抗體之一。在缺乏VP2或VP5的情況下VP7可調節BTV對昆蟲細胞的吸附和侵入[12]。
因此,藍舌病病毒VP7蛋白的群特異性抗原表位多肽的鑒定,對于BT疫苗的設計及高通量藍舌病病毒檢測試劑盒的研制均具有重要意義。
參考文獻:
[1]苗志強,鄭明學等.藍舌病流行狀況及防控措施[J].黑龍江畜牧獸醫,2010(5):28-30.
[2]Legisa.,et al.Bluetongue virus in South America,Central America and the Caribbean[J].Virus research,2014,182:87-94.
[3]王凌鳳,楊濤,等.藍舌病病毒17型VP2蛋白單克隆抗體的制備及其抗原表位的鑒定[J].中國預防獸醫學報,2011,33(6):465-470.
[4]Hofmann M A,Renzullo S,Mader M,et al.Genetic characterization of toggenburg orbivirus,a new bluetongue virus,from Goats,Switzerland[J].Emerg Infect Dis,2008,14(12):1855-1861.
[5]Zientara S,Sailleau C,Viarouge C,et al.Novel bluetongue virus in Goats,Corsica,France,2014[J].Emerg Infect Dis,2014,20(12):2123-2125.
[6]Maan S,Maan N S,Nomikou K,et al.Novel bluetongue virus serotype from Kuwait[J].Emerg Infect Dis,2011,17(5):886-889.
[7]Maan S,Maan N S,Belaganahalli M N,et al.Full-genome sequencing as a basis for molecular epidemiology studies of bluetongue virus in India[J].PLoS One,2015,10(6):e0131257.
[8]李楠,朱建波,肖雷等.云南藍舌病病毒1型毒株M6基因序列分析[J].中國畜牧獸醫,2016,43(2):340-347
[9]Umeshappa CS,Singh KP,Pandey A B,et al.Cell-mediated immune response and cross-protective efficacy of binary ethylenimine-inactivated bluetongue virus serotype-1vaccine in sheep[J].Vaccine,2010,28(13):2522-2531.
[10]黃繡,普淑英.甘肅省動物藍舌病流行病學調查與病原分離、鑒定.第一屆東南亞太平洋地區藍舌病學術討論會論文匯編[C].云南昆明,1995.
[11]Hassan S.H,Wirblich C,Forzan M,et al.Expression and functional characterization of bluetongue virus VP5protein:role in cellular permeabilization[J].Virol,2001,75(18):8356-8367.
[12]Mertens,P.,Burroughs,J.,Walton,A.et al.,Enhanced Infectivity of Modified Bluetongue Virus Particles for Two Insect Cell Lines and for TwoCulicoidesVector Species[J].Virology.1996,217:582-593.
技術實現要素:
本發明所要解決的技術問題是提供一種藍舌病病毒VP7蛋白群特異性抗原表位多肽及其應用及其在檢測藍舌病病毒中的用途。
為了達到上述目的,本發明采用了以下技術手段:
本發明使用前期制備的穩定分泌抗25型BTV VP7的雜交瘤細胞株3H7,利用噬菌體展示肽技術對3H7細胞株識別的抗原表位進行篩選。經過3輪淘選后進行測序,結果表明3H7細胞株識別的抗原表位為QYHAM(SEQ ID NO.1所示)。進一步合成短肽利用間接ELISA對3H7細胞株進行鑒定。實驗結果表明3H7細胞株識別的抗原表位為QYHAM;通過與NCBI中25種藍舌病病毒VP7蛋白氨基酸序列進行對比,分析表明3H7細胞株識別的線性抗原表位QYHAM與藍舌病病毒VP7蛋白發生兩個氨基酸突變,即239位氨基酸由精氨酸突變成酪氨酸,240位氨基酸由天冬酰胺突變成組氨酸,其他氨基酸在藍舌病病毒25種血清型中高度保守。因此可作為藍舌病病毒VP7蛋白群特異性抗原表位多肽,用于藍舌病毒的檢測。
在上述研究的基礎上,本發明提出了一種藍舌病病毒VP7蛋白群特異性抗原表位多肽,所述的抗原表位多肽的氨基酸序列如SEQ ID NO.1所示。
編碼所述的抗原表位多肽的核苷酸序列、含有所述核苷酸序列的表達載體以及含有所述表達載體的宿主細胞也在本發明的保護范圍之內。
進一步的,本發明還提出了所述的抗原表位多肽在制備檢測藍舌病毒試劑中的用途。
本發明的提出為采用間接ELISA法檢測藍舌病病毒提供了技術支持,對于藍舌病毒的早期檢測具有重要的意義。
附圖說明
圖1為3H7與BHK細胞間接免疫熒光反應結果;
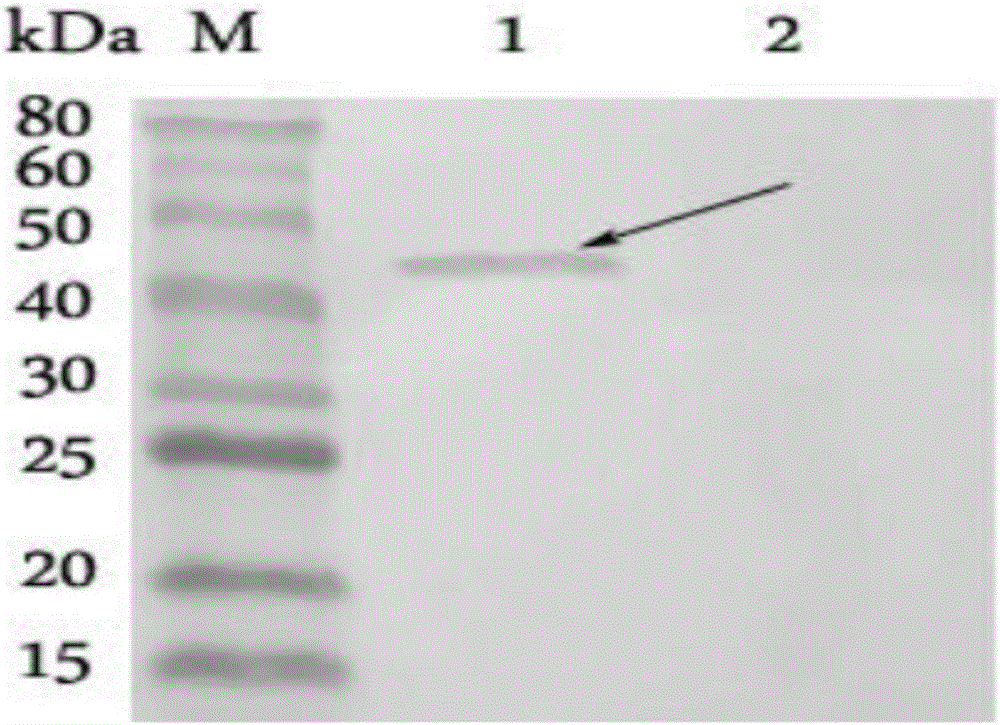
圖2為重組蛋白VP7與3H7細胞上清Western blot鑒定結果;
M、蛋白Marker;1、pET-28a-VP7/BL21純化蛋白;2、pET-28a-VP7/BL21誘導前;
圖3為18個噬菌體克隆展示的12肽測序結果;
圖4為合成短肽與單抗上清及腹水間接ELISA鑒定結果;
圖5為合成短肽與不同型BTV陽性血清間接ELISA鑒定結果;
圖6為短肽序列與BTV1-BTV12型基因序列BLAST結果;
圖7為短肽序列與BTV13-BTV26型基因序列BLAST結果。
具體實施方式
下面結合具體實施例和附圖來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但這些實施例僅是范例性的,并不對本發明的范圍構成任何限制。本領域技術人員應該理解的是,在不偏離本發明的精神和范圍下可以對本發明技術方案的細節和形式進行修改或替換,但這些修改和替換均落入本發明的保護范圍內。
實施例1 3H7細胞株識別的抗原表位多肽的鑒定
1材料與方法
1.1細胞、病毒與抗體
穩定分泌抗25型BTV VP7的雜交瘤細胞株3H7(該細胞株已記載以下非專利文獻中:25型藍舌病病毒VP7和VP2蛋白的原核表達及其單克隆抗體的制備,武嘯,東北農業大學碩士學位論文,2015)由東北農業大學保存并提供、藍舌病病毒陽性血清、BHK21細胞由本實驗室保存、辣根過氧化物酶標記的山羊抗鼠IgG、FITC熒光標記的山羊抗鼠、鼠抗His標簽單抗購自中杉金橋有限公司,藍舌病標準陽性血及陰性清購自藍舌病參考實驗室Pirbright institute。
1.2主要試劑
PRMI 1640培養液購自Gibicol公司;HAT(50×)、HT(100×)、二甲基亞砜(DMSO)、抗體亞類鏈特異性鑒別試劑盒購自SIGMA公司產品;蛋白質Marker購自寶生物工程(大連)有限公司。
1.3細胞復蘇與鑒定
將本實驗室保存的穩定分泌抗25型BTV VP7的雜交瘤細胞株3H7進行復蘇。并進行連續傳代,留取細胞上清。使用競爭ELISA方法對單抗上清進行鑒定,以原核表達純化的VP7蛋白作為抗原,單抗上清為一抗,HRP標記山羊抗鼠IgG為二抗。
1.4間接免疫熒光鑒定
將BHK21細胞傳至24孔板上,孔內放置爬片,待細胞長滿單層后接種8型BTV,同時設置正常BHK21細胞作為陰性對照。37℃,5%CO2培養48h后棄去培養上清液,用PBS輕輕洗滌3次,4%多聚甲醛固定液室溫固定30min,每孔加入3%的BSA 37℃封閉1h,每孔加入1ml的雜交瘤細胞培養上清液作為一抗,以及對照組SP2/0細胞培養上清液,37℃作用1h,加入以0.3%BSA稀釋的FITC標記山羊抗鼠IgG作為二抗,200μL/孔,避光37℃作用1h,在熒光顯微鏡下觀察結果,并拍照記錄。
1.5 Western-Blot鑒定
以原核表達純化的蛋白進行SDS-PAGE電泳整齊的切去積層膠部分,將分離膠部分電轉印至硝酸纖維素膜上,50mA轉印50min然后將NC膜放入5%的脫脂乳中37℃作用2.5h,取出NC膜用PBST洗滌三次,10min/次,然后以3H7細胞培養上清中作為一抗進行孵育,4℃封閉過夜。取出NC膜用PBST洗滌三次,10min/次,然后放入用經5%脫脂乳按1∶2000稀釋的HRP標記山羊抗鼠IgG中,進行二抗孵育,室溫作用2.5h,取出NC膜用PBST洗滌三次,10min/次,用DAB-H2O2顯色液室溫顯色,觀察結果。
1.6抗原表位鑒定
參照Ph.D.-12TM13噬菌體肽庫說明書,用純化后的單克隆抗體IgG對噬菌體肽庫進行3次淘選。將經純化的單克隆抗體腹水IgG用包被稀釋液稀釋到100ng/mL濃度,按照150μL/孔的包被量加入到微孔板中。去除包被液,每孔加滿封閉液。用100μLPBST稀釋10μL原始噬菌體文庫,加入到微孔板中,室溫溫和搖動。取100μL洗脫緩沖液,加入到微孔板中,室溫溫和搖動。取出洗脫物并加入中和液,即為第一輪淘選后的噬菌體。取100μL淘選后的噬菌體加入到用于噬菌體擴增的ER2738菌液中,37℃震蕩培養。取上清,加入2.67mL PEG/NaCl溶液,4℃過夜沉淀擴增后的噬菌體。將經過夜沉淀的噴菌體溶液4℃離心,棄上清,短暫離心,吸去殘留液。取上清加入PEG/NaCl,冰上作用1h。4℃離心沉淀噬菌體,棄上清,短暫離心,吸去殘留液。沉淀用200μLTBS回溶,4℃離心1min,上清轉入新的離心管中,此即為擴增后的噬菌體。取10μL擴增后的噬菌體,用LB液體培養基進行10倍系列的倍比稀釋,在每一稀釋度的溶液中各取10μL分別接種在200mL宿主菌ER2738中,室溫作用5min后,將其加入到3mL 45℃預熱的頂層瓊脂中,快速混勾后傾倒于經37℃預熱的LB/IPTG/X-gal固體瓊脂蹄選平板上,37℃避光培養過夜查平板,計數有約100個藍色噬菌斑的平板上的斑數,用此數目乘以其對應的稀釋倍數,即為擴增后每10μL噬菌體的滴度(pfu)。重復三次淘選。將三次淘選后的產物測序。并合成短肽與單抗上清進行間接ELISA鑒定。
1.7短肽ELISA鑒定
包被:用包被稀釋液將短肽稀釋100μl/孔包被酶標板,4℃過夜;封閉:棄去板中包被液體,加入200μl/孔的PBST溶液震蕩洗滌每孔加200μl封閉液(5%的脫脂乳),陽性血清用5%的脫脂乳稀釋每孔加入100μl,每個樣品作2個平行孔,同時設置空白對照孔,37℃作用1h,二抗用5%脫脂乳將山羊抗鼠酶標二抗,100μl/孔加入各反應孔,37℃作用1h.。顯色:加入現配制的OPD-H2O2底物顯色液,100μl/孔,37℃避光顯色15min,加入終止液(2M/H2SO4)50μl/孔,終止顯色。
1.8保守性分析
利用NCBI數據庫中的Blast對3H7細胞株的抗原表位保守性進行分析。
2結果
2.1單抗的特異性鑒定
3H7與BHK細胞間接免疫熒光反應結果如圖1所示,其中,圖A為3H7細胞上清與接種25型BTV的BHK細胞21細胞反應的結果。圖B為3H7上清與未接種25型BTV的BHK21細胞反應結果。結果表明,3H7細胞呈明顯的陽性反應,與對照呈陰性反應。
2.2單克隆抗體的Western-Blot鑒定
用3H7上清檢測原核表達純化的VP7蛋白,同時設置空白菌體對照。經DAB顯色后結果顯示3H7分泌的抗體能與原核表達的蛋白特異性的結合,同時與空白菌體對照不能特異性結合。用3H7上清檢測原核表達純化的VP7蛋白,同時設置空白菌體對照。經DAB顯色后結果顯示3H7分泌的抗體能與原核表達的蛋白特異性的結合,同時與空白菌體對照不能特異性結合(圖2)。
2.3 DNA序列測定及表位分析
將18個噬菌體陽性克隆進行DNA測序并對展示的短肽進行序列比對,結果如圖3所示,結果顯示18個噬菌體克隆展示有共同的序列QYHAM(SEQ ID NO.1所示)。并經過序列比對表明該序列在各個BTV血清型中相對保守。我們推測QYHAM序列可能是一個線性B細胞表位。
2.4短肽ELISA鑒定結果
用合成短肽分別與單抗上清及腹水反應,所取結果為進行20次ELISA反應的平均值,結果顯示,與腹水反應的值明顯高于上清,這可能是由于腹水中與短肽結合的非特異性抗體較多。短肽與單抗上清反應S/N比值均大于2表明短肽能與上清中的抗體發生特異性結合(圖4)。
使用合成短肽鑒定不同血清型BTV陽性血清進行間接ELISA鑒定,結果如圖5所示,結果表明,合成肽QYHAM與BTV2型、3型、5型、7型、8型、11型、12型、13型、14型、15型、16型、17型、18型、19型、20型、21型、22型、23型、24型均呈陽性反應。與BTV1型、BTV4型、BTV9型、BTV10型的反應呈弱陽性。合成肽能與大多數BTV血清型陽性血清呈陽性反應,表明QYHAM序列為藍舌病病毒群特異性抗原的關鍵表位。
2.5保守性分析結果
將噬菌體克隆展示技術測序結果得到的短肽序列與Genbank中25個血清型藍舌病病毒VP7蛋白氨基酸序列進行比對,結果如圖6和圖7所示,結果發現在第239氨基酸序列處由精氨酸突變成酪氨酸,在第240氨基酸序列處由天冬酰胺突變成組氨酸。在BTV 7、BTV15、BTV19第239氨基酸序列處由丙氨酸突變成酪氨酸。
使用合成短肽鑒定不同血清型BTV陽性血清進行間接ELISA鑒定,結果表明,合成肽與BTV2型、3型、5型、7型、8型、11型、12型、13型、14型、15型、16型、17型、18型、19型、20型、21型、22型、23型、24型均呈陽性反應。與BTV1型、BTV4型、BTV9型、BTV10型的反應呈弱陽性。合成肽能與大多數BTV血清型陽性血清呈陽性反應,表明QYHAM序列為藍舌病病毒群特異性抗原的關鍵表位。
3、討論
迄今為止已發現27種藍舌病血清型,且各個型之間不存在交叉保護。藍舌病目前沒有有效的治療方法,因此該病主要以預防為主。本研究中以實驗室保存的單克隆抗體3H7株為實驗基礎,應用噬菌體展示技術檢測該單克隆抗體的抗原表位。經過三次淘選檢測出該單抗的一條線性表位QYHAM。并通過合成短肽應用競爭ELISA方法與24種藍舌病病毒陽性血清反應,結果表明合成短肽可與大多數陽性血清呈陽性反應,分析原因可能由于藍舌病病毒陽性血清長期保存于-80℃條件下,血清效價下降導致與少數幾種血清反應呈弱陽性。通過與NCBI中25種藍舌病病毒VP7蛋白氨基酸序列進行對比,分析表明3H7細胞株識別的線性抗原表位QYHAM與藍舌病病毒VP7蛋白發生兩個氨基酸突變,即239位氨基酸由精氨酸突變成酪氨酸,240位氨基酸由天冬酰胺突變成組氨酸,其他氨基酸在藍舌病病毒25種血清型中高度保守。本發明鑒定了藍舌病病毒VP7蛋白群特異性抗原表位多肽,為建立針對藍舌病病毒的競爭ELISA方法奠定了基礎,鑒定出的抗原表位也可應用于今后疫苗設計中,對于我國藍舌病的防治具有重要的意義。
序列表
<110> 東北農業大學
<120> 藍舌病病毒VP7蛋白群特異性抗原表位多肽及其應用
<130> KLPI161343
<160> 1
<170> PatentIn 3.5
<210> 1
<211> 5
<212> prt
<213> 表位多肽
<400> 1
Gln Tyr His Ala Met
- 還沒有人留言評論。精彩留言會獲得點贊!