具有高抗原呈遞的DC細胞和抗原特異性T細胞及其制備方法和應用與流程
本發明涉及生物技術領域,特別是涉及一種具有高抗原呈遞的dc細胞和抗原特異性t細胞及其制備方法和應用。
背景技術:
近年來,自體免疫細胞治療腫瘤成為繼手術、放療、化療后最有前景的腫瘤治療方法。dc細胞(dendriticcell,樹突狀細胞)是人體已知的最重要的抗原呈遞細胞,在介導腫瘤抗原特異性細胞免疫及腫瘤免疫應答方面所起的作用成為人們研究之熱點。dc細胞介導的腫瘤特異性抗原呈遞及t細胞免疫應答,既是腫瘤發病早期機體對抗腫瘤的有效手段,也是腫瘤發生免疫逃逸的重要機制。
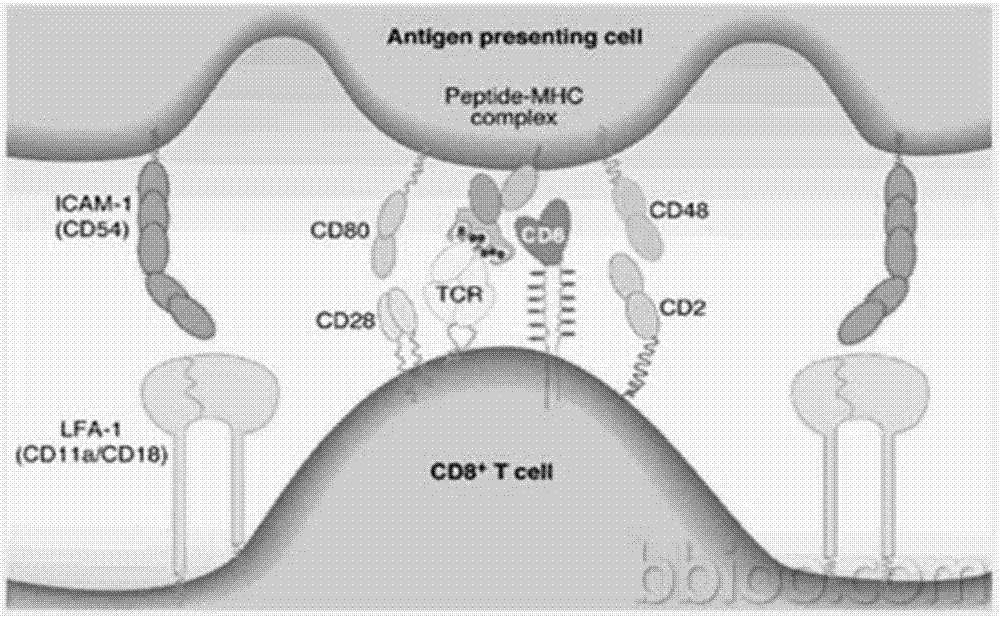
在體內dc細胞與t細胞(thymus-dependentlymphocyte,胸腺依賴性淋巴細胞)進行抗原傳遞的過程中有一個關鍵的步驟:形成免疫突觸(immunologicsynapse,is)結構。免疫突觸的結構請參閱圖1,具體形成過程如下:大量t細胞游走于淋巴結等淋巴器官,當t細胞遇到dc細胞時其運動速度減低并被dc細胞捕獲,接受外源信號后t細胞發生極化反應,t細胞產生偽足,并形成適合分子信號傳遞的三維空間結構。細胞質內以微管組織中心(microtubuleorganizationcenter,mtoc)移動到靠近dc細胞的一側邊緣為基本特征的一系列細胞器重組變化發生,其表面粘附分子通過受體-配體相互作用得以緊密接觸dc細胞,形成了一個臨時性結構,該結構以tcr-mhc-抗原肽三元結構為簇狀中心,周圍環形分布著粘附分子,該結構即為免疫突觸(immunologicsynapse,is)結構。
然而,目前體外培養的dc細胞-t細胞之間存在抗原呈遞效率不高,t細胞特異性免疫應答效果不理想等缺陷。
技術實現要素:
基于此,有必要提供一種能夠制備抗原呈遞效率高的具有高抗原呈遞的dc細胞的制備方法以及一種能夠提高t細胞特異性免疫應答效果的抗原特異性t細胞的制備方法。
一種具有高抗原呈遞的dc細胞的制備方法,包括以下步驟:
提供dc細胞;
在所述dc細胞上負載抗原;以及
向所述dc細胞內導入基因表達沉默劑,所述基因表達沉默劑用于沉默tao-1蛋白磷酸激酶基因的表達,得到所述具有高抗原呈遞的dc細胞。
在一個實施方式中,所述基因表達沉默劑為所述tao-1蛋白磷酸激酶的shrna。
在一個實施方式中,所述tao-1蛋白磷酸激酶的shrna的正義鏈的堿基序列如seqidno.1所示,所述tao-1蛋白磷酸激酶的shrna的反義鏈的堿基序列如seqidno.2所示。
一種具有高抗原呈遞的dc細胞,所述具有高抗原呈遞的dc細胞通過上述具有高抗原呈遞的dc細胞的制備方法制備得到。
一種抗原特異性t細胞的制備方法,包括以下步驟:
提供dc細胞;
在所述dc細胞上負載抗原;
向所述dc細胞內導入基因表達沉默劑,所述基因表達沉默劑用于沉默tao-1蛋白磷酸激酶基因的表達,得到具有高抗原呈遞的dc細胞;
將t細胞與所述具有高抗原呈遞的dc細胞混合,并置于含有四環素的培養基中共同培養;以及
收集共同培養后的所述t細胞,得到所述抗原特異性t細胞。
在一個實施方式中,所述含有四環素的培養基中,所述四環素的終濃度為0.5mg/ml~5mg/ml。
在一個實施方式中,所述含有四環素的培養基中還含有終濃度為10ng/ml~1000ng/ml的gm-csf、終濃度為0.1ng/ml~100ng/ml的il-4和體積分數為0.1%~20%的血漿。
在一個實施方式中,所述將t細胞與所述具有高抗原呈遞的dc細胞混合,并置于含有四環素的培養基中共同培養的操作中,所述t細胞與所述具有高抗原呈遞的dc細胞的個數比為1~20:1,所述共同培養的時間為1天~15天。
一種抗原特異性t細胞,所述抗原特異性t細胞通過上述抗原特異性t細胞的制備方法制備得到。
上述高抗原呈遞的dc細胞的制備方法制備得到的具有高抗原呈遞的dc細胞或上述的抗原特異性t細胞的制備方法制備得到的抗原特異性t細胞在制備抗腫瘤的藥物中的應用。
上述具有高抗原呈遞的dc細胞的制備方法,通過在dc細胞上負載抗原,并向dc細胞內導入基因表達沉默劑得到具有高抗原呈遞的dc細胞。該具有高抗原呈遞的dc細胞與t細胞在四環素的條件下,四環素能夠調控dc細胞內的基因表達沉默劑的開關,使得dc細胞和t細胞相互接觸并形成免疫突觸結構的過程中抑制dc細胞內具有負調控作用的tao-1蛋白磷酸激酶的基因表達,增加免疫突觸形成的時間和強度,提高形成的免疫突觸的穩定性。而一旦dc細胞與t細胞抗原呈遞結束,即可去掉四環素,恢復dc細胞內tao-1蛋白磷酸激酶的表達,保證了dc細胞在非抗原呈遞階段的正常生理功能不受影響。結果表明,上述具有高抗原呈遞的dc細胞能夠在四環素的作用下刺激t細胞,使t細胞分化程度高,形成的抗原特異性t細胞cd3和hla-dr雙陽性的t細胞比例高,dc細胞-t細胞之間的抗原呈遞效率高。
附圖說明
圖1為一實施方式dc細胞與t細胞進行抗原傳遞形成免疫突觸的示意圖;
圖2為一實施方式的制備具有高抗原呈遞的dc細胞的流程圖;
圖3為一實施方式的制備抗原特異性t細胞的流程圖;
圖4為實施例1中構建的plko-tet-on/tao-1-shrna慢病毒表達質粒經過xhoi單酶切后得到的產物的瓊脂糖凝膠電泳圖;
圖5為實施例2制備的四組t細胞cd3+及hla-dr+的流式檢測對比圖;
圖6為實施例2制備的四組t細胞對正常細胞系mcf-10a以及乳腺癌mcf-7細胞的殺傷效率的流式檢測對比圖。
具體實施方式
為使本發明的上述目的、特征和優點能夠更加明顯易懂,下面結合具體實施例及附圖對本發明的具體實施方式做詳細的說明。在下面的描述中闡述了很多具體細節以便于充分理解本發明。但是本發明能夠以很多不同于在此描述的其它方式來實施,本領域技術人員可以在不違背本發明內涵的情況下做類似改進,因此本發明不受下面公開的具體實施的限制。
請參閱圖2,一實施方式的具有高抗原呈遞的dc細胞的制備方法,包括以下步驟s110~s130。
s110、提供dc細胞。
具體地,dc細胞為生物內正常的dc細胞,可以通過提取外周血中的細胞獲得,也可以是傳代培養dc細胞株獲得。
本實施方式中,dc細胞為人源dc細胞。
具體地,dc細胞通過以下制備方法獲得:抽取健康志愿者的外周血,肝素抗凝,用淋巴細胞分離液分離外周血的單個核細胞。然后重懸單個核細胞,培養1h~4h后,洗滌并收集貼壁的細胞,得到dc細胞。
具體地,收集的dc細胞置于含有gm-csf(granulocyte-macrophagecolonystimulatingfactor,粒細胞-巨噬細胞集落刺激因子)、il-4(白細胞介素4)和血漿的培養基中培養。具體地,培養基中gm-csf的終濃度為10ng/ml~1000ng/ml,培養基中il-4的終濃度為0.1ng/ml~100ng/ml,培養基中血漿的體積分數為0.1%~20%,促進dc細胞的生長。
s120、在s110中的dc細胞上負載抗原。
具體地,可以根據需要,在dc細胞上負載不同的抗原。當負載有抗原的dc細胞與t細胞相互接觸時,抗原能夠刺激t細胞形成免疫突觸結構。
本實施方式中,dc細胞上負載的抗原為乳腺癌抗原。
具體地,向培養的dc細胞中加入一定量的抗原,置于培養箱中培養1~2天,使得dc細胞上負載抗原。
具體地,負載抗原時,dc細胞與抗原的比例約為106個細胞:1ml抗原。
s130、向s120中得到的dc細胞內導入基因表達沉默劑,該基因表達沉默劑用于沉默tao-1蛋白磷酸激酶基因的表達,得到具有高抗原呈遞的dc細胞。
發明人發現,在免疫突觸(is)形成過程中細胞骨架的動態變化及調控是實現其生理功能的重要基礎。它不僅為is的形成提供三維空間構型的基礎,還將眾多信號分子帶到這一區域內,同時為抗原呈遞及細胞信號傳遞提供保障。is形成需要較長時間,體外實驗觀察t細胞需要與dc細胞緊密結合數小時以上才能夠形成免疫突觸結構。免疫突觸形成的這一特點需要維持支持其3d結構的細胞骨架維持較長的時間不發生解聚。這是保障后續抗原交換、細胞激活信號傳遞、t細胞激活等一系列細胞生物學行為發生的重要前提和基礎。因此,免疫細胞調控is部位細胞骨架的信號分子及其調控機制就成為理解整個is生理功能的關鍵。
而tao-1蛋白磷酸激酶(thousand-and-oneaminoacids)是sterile-20家族的成員之一,在所有真核細胞中高保留表達。它們的共同特征是都擁有一個絲氨酸/蘇氨酸激酶結構域。tao家族蛋白的一個重要功能是激活mapk(mitogen-activatedproteinkinase)細胞信號傳到通路,以蛋白磷酸化和去磷酸化的方式調控細胞生長因子,從而調控細胞的增殖和分裂。此外,tao-1蛋白磷酸激酶還可以在微管延長端到達細胞邊緣過渡增長時誘發微管的去穩定性,同時可以通過調控rhogtpase(rhogtp酶)在細胞表面的位置從而動態的調控細胞極化過程。發明人猜測tao-1在細胞骨架相互作用的動態調控中扮演著重要角色,tao-1在dc細胞和t細胞相互接觸,形成免疫突觸結構的過程中發揮著關鍵的負調控作用。因此通過向dc細胞內導入基因表達沉默劑,在dc細胞和t細胞相互接觸形成免疫突觸結構的過程沉默t細胞內的tao-1蛋白磷酸激酶的基因表達,控制細胞接觸部位微管和細胞骨架的穩定性,從而控制免疫突觸形成的時間和強度,提高形成的免疫突觸的穩定性。
在一個實施方式中,基因表達沉默劑為tao-1蛋白磷酸激酶的shrna。將tao-1蛋白磷酸激酶的shrna導入進入dc細胞中,shrna與tao-1蛋白磷酸激酶的mrna互補結合序列特異性地實現靶mrna降解。通過基因敲除的方法對dc細胞中的tao-1蛋白磷酸激酶表達基因進行沉默,從而提高dc細胞和t細胞相互接觸形成免疫突觸的穩定性。
具體地,tao-1蛋白磷酸激酶的shrna的正義鏈的堿基序列如seqidno.1所示,tao-1蛋白磷酸激酶的shrna的反義鏈的堿基序列如seqidno.2所示。上述堿基序列的tao-1蛋白磷酸激酶的shrna特異性好,對目的基因沉默效果穩定。
在一個實施方式中,基因表達沉默劑負載在慢病毒中,通過慢病毒轉染進入t細胞內,并在轉染過程中加入聚凝胺(polybrane),促進慢病毒的轉染。具體地,加入的聚凝胺的終濃度為1μg/ml~100μg/ml。
具體地,將tao-1蛋白磷酸激酶的shrna連接到經agei和ecor1雙酶切后慢病毒載體plko-tet-on中,得到重組plko-tet-o載體。經酶切鑒定正確后,將其與慢病毒包裝質粒plp1、plp2、plp/vsvg共轉染293t細胞,制備出plko-tet-on/tao-1-shrna慢病毒,然后將plko-tet-on/tao-1-shrna慢病毒轉染進入dc細胞內。
具體地,plko-tet-on/tao-1-shrna慢病毒轉染dc細胞時,病毒滴度moi=10~100。
通過將基因表達沉默劑負載在慢病毒中并轉染到dc細胞內,轉染效率高,轉染效果好。
上述方法制備的具有高抗原呈遞的dc細胞內具有沉默tao-1蛋白磷酸激酶基因表達的基因表達沉默劑。該具有高抗原呈遞的dc細胞在四環素的條件下與t細胞接觸時,能夠抑制dc細胞內具有負調控作用的tao-1蛋白磷酸激酶的基因表達,提高dc細胞與t細胞形成的免疫突觸的穩定性,增加免疫突觸形成的時間和強度,提高抗原呈遞效率,刺激t細胞分化的更成熟、更具抗原特異性。
實驗結果表明,經上述具有高抗原呈遞的dc細胞刺激的t細胞分化更加成熟,t細胞中cd3和hla-dr雙陽性的t細胞數量占總t細胞數量的60%以上。dc細胞與t細胞表面形成的表面突觸更加穩定,dc細胞-t細胞之間的抗原呈遞的效率高,t細胞的免疫應答效果好。
此外,本文還提供一實施方式的具有高抗原呈遞的dc細胞及其在制備抗腫瘤的藥物中的應用。
具體地,上述具有高抗原呈遞的dc細胞可以是應用于預防腫瘤的疫苗,也可以是應用于治療已經確診為腫瘤甚至癌癥的藥物。
進一步地,上述具有高抗原呈遞的dc細胞為用于制備抗乳腺癌的藥物。
實驗結果表明,上述具有高抗原呈遞的dc細胞能夠刺激t細胞分化更加成熟,增強t細胞對乳腺癌特異性的高效殺傷作用,而對正常的乳腺細胞的殺傷作用很小。因此,該具有高抗原呈遞的dc細胞有望應用在抗腫瘤的藥物中,為腫瘤治療提供一種思路。
請參閱圖3,一實施方式的抗原特異性t細胞的制備方法,包括步驟s110~s150。
其中,步驟s110~s130請參見上文制備具有高抗原呈遞的dc細胞的描述,在此不作贅述。
s140、將t細胞與s130中得到的具有高抗原呈遞的dc細胞混合,并置于含有四環素的培養基中共同培養。
四環素能夠調控dc細胞內的基因表達沉默劑的開關,實驗結果表明,只有在四環素存在的情況下,tao-1蛋白磷酸激酶基因表達沉默。而一旦dc細胞與t細胞抗原呈遞結束,即可去掉四環素,恢復dc細胞內tao-1蛋白磷酸激酶的表達,保證了dc細胞在非抗原呈遞階段的正常生理功能不受影響。
在一個實施方式中,含四環素的培養基中,四環素的終濃度為0.5mg/ml~5mg/ml。例如0.8mg/ml、1mg/ml、2mg/ml或4mg/ml等等。四環素的濃度適宜,調控dc細胞內的基因表達沉默劑,在dc細胞和t細胞相互接觸并形成免疫突觸結構的過程中,抑制tao-1蛋白磷酸激酶的基因表達。
在一個實施方式中,含有四環素的培養基的基礎培養基為無血清培養基,例如alys-505培養基。培養基中還含有gm-csf、il-4和血漿,gm-csf的終濃度為10ng/ml~1000ng/ml,il-4的終濃度為0.1ng/ml~100ng/ml,血漿的體積分數為0.1%~20%。
本實施方式中,含有四環素的培養基的基礎培養基為alys-505培養基,培養基中含有四環素、有gm-csf、il-4和血漿,四環素的終濃度為1mg/ml,gm-csf的終濃度為100ng/ml,il-4的終濃度為10ng/ml,血漿的體積分數為10%。
具體地,血漿與提取dc細胞的外周血為同源的。培養基中加入gm-csf、il-4和血漿能夠促進dc細胞的生長、增強dc細胞的抗原呈遞能力。
在一個實施方式中,將具有高抗原呈遞的dc與t細胞與混合,并置于含有四環素的培養基中共同培養的操作中,t細胞與具有高抗原呈遞的dc的個數比為1~20:1,共同培養的時間為1天~15天。在四環素存在的條件下,具有高抗原呈遞的dc內tao-1蛋白磷酸激酶基因表達受到抑制,將t細胞與dc細胞共同培養1天以上,形成穩定的免疫突觸結構,提高dc細胞抗原呈遞能力以及t細胞分化成熟度。
具體地,將具有高抗原呈遞的dc與t細胞混合,置于含有四環素的培養基中共同培養共同培養1天~7天,例如2天、3天或4天等。
具體地,混合時,具有高抗原呈遞的dc為1×105個/孔,t細胞約為1×106個/孔。將具有高抗原呈遞的dc與t細胞共同培養,培養時隔天補加四環素。
s150、收集s140中共同培養后的t細胞,得到抗原特異性t細胞。
實驗結果表明,在四環素存在的條件下,導入了基因表達沉默劑的dc細胞更能高效地將抗原呈遞給t細胞,提高t細胞的成熟度和抗原特異性。該具有高抗原呈遞的dc細胞與t細胞在四環素的條件下,四環素能夠調控dc細胞內的基因表達沉默劑的開關,使得dc細胞和t細胞相互接觸并形成免疫突觸結構的過程中抑制dc細胞內具有負調控作用的tao-1蛋白磷酸激酶的基因表達,增加免疫突觸形成的時間和強度,提高形成的免疫突觸的穩定性。
而一旦dc細胞與t細胞抗原呈遞結束,即可去掉四環素,恢復dc細胞內tao-1蛋白磷酸激酶的表達,保證了dc細胞在非抗原呈遞階段的正常生理功能不受影響。
需要說明的是,制備具有高抗原呈遞的dc細胞和高抗原特異性的t細胞不局限于上述s110~s150的順序,本領域技術人員可根據需要調整先后順序,例如s120與s130可以調換。
在一個實施方式中,制備得到的抗原特異性t細胞中cd3和hla-dr雙陽性的t細胞數量占總t細胞數量的60%以上。
上述制備抗原特異性t細胞,在制備時,向dc細胞內導入基因表達沉默劑,并將負載有抗原的dc細胞與t細胞混合,置于含有四環素的培養基中共同培養。四環素能夠調控dc細胞內的基因表達沉默劑的開關,在dc細胞和t細胞相互接觸并形成免疫突觸結構的過程中抑制具有負調控作用的tao-1蛋白磷酸激酶的基因表達,提高形成的免疫突觸的穩定性,增加免疫突觸形成的時間和強度。而一旦dc細胞與t細胞抗原呈遞結束,即可在去掉四環素,恢復dc細胞內tao-1蛋白磷酸激酶的表達,保證了dc細胞在非抗原呈遞階段的正常生理功能不受影響。
實驗結果表明,在四環素存在的條件下,導入了基因表達沉默劑的dc細胞與t細胞共同培養時,dc內tao-1蛋白磷酸激酶基因表達受到抑制,dc細胞與t細胞表面形成的表面突觸更加穩定,能夠刺激t細胞分化更加成熟,制備的抗原特異性t細胞中cd3和hla-dr雙陽性的t細胞數量能夠占總t細胞數量的60%以上,增強t細胞的免疫活性,得到的抗原特異性t細胞的免疫應答效果好。
此外,本文還提供一實施方式的抗原特異性t細胞及其在制備抗腫瘤的藥物中的應用。
具體地,上述抗原特異性t細胞可以是應用于預防腫瘤的疫苗,也可以是應用于治療已經確診為腫瘤甚至癌癥的藥物。
進一步地,上述抗原特異性t細胞為用于制備抗乳腺癌的藥物。
實驗結果表明,上述抗原特異性t細胞對乳腺癌有特異性的高效殺傷作用,而對正常的乳腺細胞的殺傷作用很小。因此,該抗原特異性t細胞有望應用在抗腫瘤的藥物中,為腫瘤治療提供一種思路。
下面為具體實施例部分。
以下實施例中,如無特別說明,未注明具體條件的實驗方法,通常按照常規條件,例如參見薩姆布魯克、ef弗里奇、t曼尼阿蒂斯等(金冬雁,黎孟楓等譯)所著的分子克隆實驗指南[m](北京:科學出版社,1992)中所述的條件或者試劑盒生產廠家推薦的方法實現。實施例中所使用的試劑均為市售。
未特別說明,nc-dc-t表示dc細胞與t細胞共同培養后,收集的第一陰性對照t細胞。elv-dc-t表示plko-tet-on空載體慢病毒感染dc細胞與t細胞共同培養后,收集的第二陰性對照t細胞。tlv-dc-t表示plko-tet-on/tao-1-shrna慢病毒感染dc細胞與t細胞共同培養后,收集的第三陰性對照t細胞。tet-tlv-dc-t(抗原特異性t細胞)表示plko-tet-on/tao-1-shrna慢病毒感染dc細胞與t細胞在四環素的條件下共同培養后,收集的抗原特異性t細胞。
實施例1
制備基因表達沉默劑
(1)設計tao-1蛋白磷酸激酶的shrna
利用thermo網站的shrna序列在線設計程序(http://rnaidesigner.thermofisher.com/rnaiexpress/setoption.do?designoption=shrna&pid=-2900031043253144145),設計出tao-1shrnaoligos序列,如下所示:
正義鏈:
5’-ccggggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttccttttt-3’(seqidno.1)。
反義鏈:
5’-aattggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttcc-3’(seqidno.2)。
(2)制備plko-tet-on/tao-1-shrna慢病毒
將上述設計的tao-1蛋白磷酸激酶的shrna送交基因公司合成,利用agei和ecor1雙酶切慢病毒載體plko-tet-on,將退火后的tao-1-shrna寡核苷酸鏈連接到plko-tet-on載體中,dna連接反應體系如下:
室溫反應3h后,對連接產物plko-tet-on/tao-1-shrna慢病毒表達質粒進行酶切鑒定。構建的plko-tet-on/tao-1-shrna慢病毒表達質粒經過xhoi單酶切后得到的產物經瓊脂糖凝膠電泳檢測,結果如圖4,分別在大約150bp、200bp和8kb處有三條清晰條帶,與預期片段數和片段大小一致(8kb條帶因為慢病毒載體plko-tet-on中也有一個xhoi酶切位點)。證明tao-1-shrna寡核苷酸成功插入到plko-tet-on載體中。經酶切鑒定正確后,將其與三個慢病毒包裝質粒plp1、plp2、plp/vsvg共轉染293t細胞,制備出plko-tet-on/tao-1-shrna慢病毒。
實施例2
dc細胞和t細胞共同培養制備具有高抗原呈遞的dc細胞以及抗原特異性t細胞
1、dc細胞和t細胞的培養
(1)抽取健康志愿者外周血50ml,肝素抗凝,用淋巴細胞分離液分離出外周血單個核細胞(pbmc)。
(2)用含10%自體血漿的alys-505培養液重懸pbmc細胞,分裝入六孔板中,5×106個/ml,2ml/孔,置于飽和濕度、37℃、5.0%co2的培養箱中培養2h。
(3)洗滌并收集(2)中未貼壁的細胞,該未貼壁細胞為t細胞。將未貼壁的細胞用含50ng/mlcd3單抗、1000u/ml的il-2和0.5%自體血漿的alys-505培養液進行刺激培養,調整細胞密度為1×106/ml,轉入六孔板中,2ml/孔,同時每孔添加1000u/ml的ifn-γ,置于飽和濕度、37℃、5.0%co2培養箱中培養。每3天調整細胞密度為1×106/ml,添加含1000u/ml的il-2和0.5%自體血漿的alys-505培養液。
(4)保留(2)中貼壁細胞于六孔板中,貼壁細胞為dc細胞,向六孔板加入含100ng/mlgm-csf、10ng/ml的il-4及10%自體血漿的alys-505培養液,置于飽和濕度、37℃、5.0%co2培養箱中誘導培養dc細胞。培養3天后半量換液并補充新鮮的細胞因子,另外加入一支腫瘤抗原(本專利使用乳腺癌細胞系mcf-7的凍融抗原,1ml)對dc細胞進行抗原負載,置于飽和濕度、37℃、5.0%co2培養箱中繼續培養48h。
(5)收集(4中)培養的dc細胞,計數,離心后以含100ng/mlgm-csf、10ng/mlil-4及10%自體血漿的alys-505培養液重懸細胞,調整細胞密度,接種于6孔板中,1×105個細胞/孔,共接種8個孔。實驗平均分成四組,每組2個平行對照。4組細胞分別為陰性對照dc細胞組(nc-dc-t)、plko-tet-on空載體慢病毒感染dc細胞組(elv-dc-t)、plko-tet-on/tao-1-shrna慢病毒感染dc細胞組(tlv-dc-t)、四環素誘導的plko-tet-on/tao-1-shrna慢病毒感染t細胞組(tet-tlv-dc-t)。
(6)按照moi=30的比值,elv-dc-t組加入plko-tet-on空載體慢病毒,tlv-dc-t細胞組和tet-tlv-dc-t細胞組分別加入plko-tet-on/tao-1-shrna慢病毒,同時加入8μg/ml的polybrane促進慢病毒感染,病毒轉染后,培養24h。
(7)將(6)中培養的各組dc細胞更換新鮮的含100ng/mlgm-csf、10ng/ml的il-4及10%自體血漿的alys-505培養液,繼續培養24h。
(8)在(7)中培養的各組dc細胞每孔加入106個(3)中培養的t細胞,與dc細胞共培養。其中,tet-tlv-dc-t細胞組額外加入1mg/ml四環素,共同培養48h。
(9)補加新鮮的t細胞完全培養基(含1000u/mlil-2和0.5%自體血漿的alys-505培養液),tet-tlv-dc-t細胞組額外加入1mg/ml四環素,繼續共同培養48h。
(10)補加新鮮的t細胞完全培養基,tet-tlv-dc-t細胞組不再添加四環素,繼續共同培養48h。
(11)收獲四組dc細胞刺激的t細胞(nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t),其中t細胞增殖較快,而dc細胞基本不增值。共同培養后,貼壁生長的為具有高抗原呈遞的dc細胞,懸浮生長為t細胞。然后檢測各組t細胞表面hla-dr的表達,以及t細胞對乳腺癌細胞系mcf-7的特異性殺傷作用。
t細胞成熟度的流式檢測
將實施例2中收取的第一陰性對照組、第二陰性對照組、第三陰性對照組以及實驗組的四組t細胞(nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t)分別取1×106個細胞,pbs洗滌一次后,利用cd3-fitc抗體、hla-dr-percp抗體進行染色,流式上樣檢測t細胞中cd3+以及hla-dr+的t細胞的比例,以鑒定四組t細胞在成熟度上的差異。
四組t細胞cd3+且hla-dr+比例的流式檢測結果如圖5所示。流式檢測圖中左上角內的散點表示cd3-而hla-dr+的t細胞,左下角內的散點表示cd3-且hla-dr-的t細胞,右上角內的散點表示cd3+且hla-dr+雙陽性的t細胞,右下角內的散點表示cd3+而hla-dr-的t細胞。一般cd3+表示的淋巴細胞為t細胞,且hla-dr+表示分化后活性好的t細胞。右上角內百分數表示cd3+且hla-dr+的t細胞的比例。其中nc-dc-t組比例最低,為28.30%。elv-dc-t組和tlv-dc-t組的cd3+且hla-dr+比例接近,分別為43.28%和46.03%。說明在沒有四環素誘導時,tlv-dc細胞對t細胞的刺激作用與空病毒載體感染elv-dc細胞相比,沒有顯著差異。而tet-tlv-dc-t細胞組的cd3+hla-dr+比例最高,達到63.58%,與其它組相比有顯著差異,說明在四環素誘導下,轉染了plko-tet-on/tao-1-shrna慢病毒的dc細胞可以刺激獲得更成熟、更活化的t細胞。
t細胞對靶細胞殺傷的流式檢測結果
(1)以實施例2中收取的第一陰性對照組、第二陰性對照組、第三陰性對照組以及實驗組的四組t細胞nc-dc-t、elv-dc-t、tlv-dc-t、tet-tlv-dc-t分別作為效應細胞,分別以cfse標記的乳腺癌mcf-7細胞、cfse標記的乳腺正常細胞系mcf-10a作為靶細胞,按照20:1的效靶比混合效應細胞和靶細胞,輕輕混勻,置于5%co2,37℃培養箱中孵育。
(2)24h后,加入1μg/mlpi染液,混勻,室溫避光孵育15min后,利用流式細胞儀檢測cfse+pi+細胞(死亡的靶細胞)的百分率。
實驗結果如圖6所示:各組t細胞對正常細胞系mcf-10a的殺傷效率差異不大,殺傷效率大致相同,在13%~16%之間。而各組t細胞對乳腺癌mcf-7細胞的殺傷效率則有較大的區別:nc-dc-t細胞的殺傷效率最低,僅有18.23%的靶細胞被殺傷。在dc與t細胞共培養過程中沒有添加四環素時,tlv-dc-t細胞對mcf-7的殺傷比例為32.78%。而dc與t細胞共培養時添加1mg/ml四環素獲得的tet-tlv-dc-t細胞對mcf-7細胞的殺傷比例提高到了68.92%。
這一結果說明,在四環素誘導下,plko-tet-on/tao-1-shrna慢病毒感染dc細胞所刺激的t細胞(tet-tlv-dc-t)對乳腺癌細胞mcf-7有特異性的高效殺傷作用,而對正常的乳腺細胞mcf-10a的殺傷作用很小。
綜上,與對照組相比,在四環素的條件下,經plko-tet-on/tao-1-shrna慢病毒感染dc細胞與t細胞共同培養能夠得到具有高抗原呈遞的dc細胞。dc細胞刺激收集的抗原特異性t細胞的cd3和hla-dr雙陽性的t細胞比例高,t細胞分化更加成熟,dc細胞-t細胞之間的抗原呈遞的效率高,t細胞的免疫應答效果好。抗原特異性t細胞對乳腺癌有特異性的高效殺傷作用,而對正常的乳腺細胞的殺傷作用很小,有望應用在抗腫瘤的藥物中,為腫瘤治療提供一種思路。
以上所述實施例僅表達了本發明的一種或幾種實施方式,其描述較為具體和詳細,但并不能因此而理解為對本發明專利范圍的限制。應當指出的是,對于本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬于本發明的保護范圍。因此,本發明專利的保護范圍應以所附權利要求為準。
sequencelisting
<110>劉韜
<120>具有高抗原呈遞的dc細胞和抗原特異性t細胞及其制備方法和應用
<160>2
<170>patentinversion3.3
<210>1
<211>57
<212>dna
<213>人工序列
<400>1
ccggggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttccttttt57
<210>2
<211>52
<212>dna
<213>人工序列
<400>2
aattggaagtcaagtttctacaaagctcgagctttgtagaaacttgacttcc52
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種腫瘤特異抗原及其應用的制作方法與工藝
- 用于制備具有增加的特異性基因表達的樹突細胞的方法和包含使用所述方法制備的樹突細胞的用于治療或預防自身免疫性疾病的組合物與流程
- 一種兼有NK細胞特質的抗原特異性T細胞的制備方法與流程
- 一種特異性腫瘤抗原NSE的CTL識別表位肽及其應用的制作方法與工藝
- 一種特異性腫瘤抗原SF的CTL識別表位肽及其應用的制作方法與工藝
- 用于建立具有編碼抗原特異性T細胞受體的基因的多能性干細胞的方法與流程
- 用于建立具有編碼抗原特異性T細胞受體的基因的多能性干細胞的方法與流程
- 特異性識別胃癌細胞的DNA適配子GCA?5及其應用的制造方法與工藝
- 一種制備結直腸癌抗原特異性T細胞的方法與流程
- 用作誘導抗原特異性T細胞反應的免疫原性增強劑的融合蛋白的制造方法與工藝