一種BHK21懸浮細胞高密度流加培養方法及其在口蹄疫病毒增殖中的應用與流程
本發明涉及一種BHK21懸浮細胞的培養方法,特別涉及一種BHK21懸浮細胞高密度流加培養方法、用于該方法的流加培養液以及該方法在口蹄疫病毒增殖中的應用。本發明屬于細胞培養
技術領域:
。
背景技術:
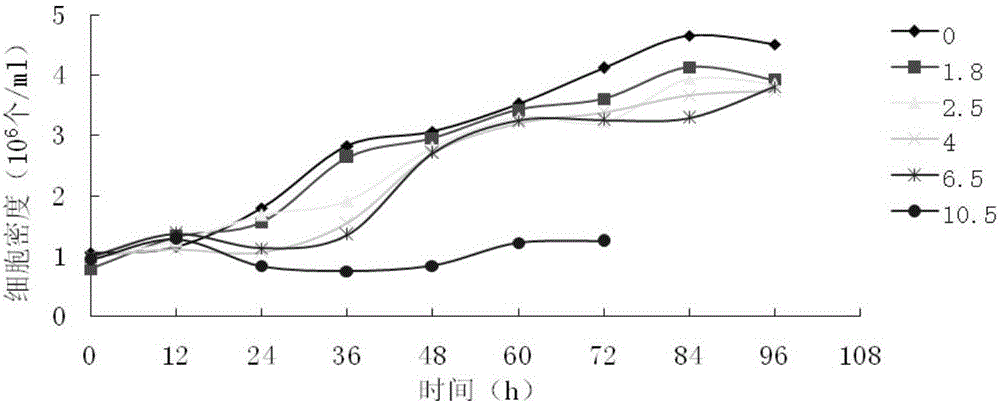
:口蹄疫(Foot-and-MouthDisease,FMD)是致偶蹄動物感染的一種急性、高度接觸性、發熱性傳染病,以傳播迅速、感染率高而著稱,國際獸疫局(OIE)將其列為A類傳染病之首。多年來,口蹄疫作為重大動物疫病不僅嚴重威脅畜牧業的健康發展,而且會引起人們對食品安全擔憂等一系列社會問題。目前的防控手段主要是采取撲殺感染動物和免疫接種健康易感動物達到凈化的目的。隨著生物生產技術的不斷發展,對疫苗產品品質提出了更高的要求。因此開發和優化BHK-21細胞的大規模培養技術,研究維持細胞生長和病毒繁殖的最優化環境控制,是口蹄疫疫苗生產的必然趨勢。本發明根據BHK-21細胞基礎代謝流水平,在前期研究得到的一種用于BHK-21細胞高密度懸浮培養的低血清培養基(命名為ZN-MEM,申請號為201510980603.7)的基礎上,設計了營養物均衡供給的流加培養基,并調整了ZN-MEM中葡萄糖以及谷氨酰胺的含量,采用調整后的ZN-MEM基礎培養基和流加培養基進行流加培養,設計不同的流加策略,確定適宜于口蹄疫病毒生產的BHK-21細胞流加培養關鍵過程控制工藝參數,使得培養細胞在維持高活率的條件下,終密度提高近2倍左右,細胞代謝副產物濃度降低30%,增殖的口蹄疫病毒抗原含量提高達80%左右,提高了口蹄疫病毒的生產效率,為口蹄疫疫苗高效大規模工業化生產奠定了基礎。技術實現要素:本發明的目的之一是提供一種成分較為明確、培養效果顯著的適用于BHK-21細胞流加培養的個性化濃縮培養液;本發明的目的之二是提供一種BHK21懸浮細胞高密度流加培養方法;本發明的目的之三是提供所述流加培養方法在口蹄疫病毒增殖中的應用。為了達到上述目的,本發明采用了以下技術手段:本發明的一種適用于BHK-21細胞流加培養的濃縮培養液,由以下含量的各原料物質組成:在本發明所述的濃縮培養液中,優選的,由以下含量的各原料物質組成:進一步的,本發明還提出了所述的濃縮培養液在BHK-21細胞培養中的應用。再進一步的,本發明還提出了一種BHK-21懸浮細胞高密度流加培養方法,該方法利用生物反應器進行流加培養,所用培養基為調整后的ZN-MEM基礎培養基,在細胞培養過程中,補加本發明所述的濃縮培養液,繼續培養,收獲細胞;其中,所述的調整后的ZN-MEM基礎培養基包括氨基酸部分,平衡鹽部分,維生素部分、其他添加物、血清以及蒸餾水,pH值7.0~7.2,其中,血清添加濃度為1%(v/v),其他各原料物質在培養基中的終濃度為:①氨基酸部分,包括:②平衡鹽部分,包括:③維生素部分,包括:④其它添加物,包括:優選的,其他各原料物質在培養基中的終濃度為:①氨基酸部分,包括:②平衡鹽部分,包括:③維生素部分,包括:④其它添加物,包括:在本發明所述的方法中,優選的,以初始接種密度0.4~0.5×106個/ml向調整后的ZN-MEM基礎培養基中接種復蘇后的BHK-21細胞,培養參數:溫度為36.5~37.0℃,pH值為6.8~7.0,DO值為60.0%~80.0%,攪拌轉速為100~120r/min;在細胞培養至24-36h,細胞生長密度達到1.5×106個/ml以上時,開始補加本發明所述的濃縮培養液,補加體積為原培養基體積的3%;培養至48h-60h,再補加原培養基體積2%的本發明所述的濃縮培養液;培養至72h,收獲細胞;優選的,在細胞培養至24h,細胞生長密度達到1.5×106個/ml以上時,開始補加本發明所述的濃縮培養液,補加體積為原培養基體積的3%;培養至48h,再補加原培養基體積2%的本發明所述的濃縮培養液;培養至72h,收獲細胞。在本發明所述的方法中,優選的,補加培養液后的培養參數為:溫度37.0~37.5℃、pH值為6.95~7.20、DO值為50.0%~80.0%、攪拌轉速為60~100r/min、滲透壓值為260~320mOsm/L,更優選的,培養參數為:溫度37.0、pH值為6.95、DO值為80.0%、攪拌轉速為100r/min、滲透壓值為320mOsm/L。再進一步的,本發明還提出了按照本發明所述的方法制備得到的BHK-21細胞及所述的BHK-21細胞在口蹄疫病毒增殖中的應用,相對于普通BHK-21細胞,該BHK-21細胞對口蹄疫病毒的感染性增加。其中,優選的,所述的病毒增殖包括向按照本發明所述的方法制備得到的BHK-21細胞接種病毒,設定控制參數為:溫度36.5~37.0℃,pH值7.4~7.6,DO值為50.0%~70.0%,攪拌轉速為50~70r/min,進行病毒增殖培養。更優選的,設定控制參數為:溫度37.0℃,pH值7.6、DO為50.0%、攪拌為70r/min,進行病毒增殖培養。其中,優選的,所述的口蹄疫病毒為FMD/O/MYA98/BY/2010、FMD/Re-AWH/09和FMD/Asia1JSL/06毒株。相較于現有技術,本發明的有益效果為:1、采用本發明建立的流加培養方法培養的BHK-21細胞,細胞活率保持在96%以上,細胞密度可達6.0×106個/ml,較普通批式培養提高近2倍;2、采用本發明建立的流加培養方法培養BHK-21細胞,通過優化生物反應器設定參數,有效控制了細胞及環境因素的變化,確保了生產過程的一致性和穩定性,確保細胞產品產量和質量在可控范圍內,BHK-21細胞在流加培養過程中,乳酸濃度低于9.4mM,氨離子濃度小于4.5mM,有效地消除了底物和產物抑制、毒害作用,促進了細胞的生長和代謝,提高了細胞的培養效能;3、采用本發明建立的流加培養方法獲得的BHK21細胞,對口蹄疫病毒的感染性增加,病毒的有效抗原含量得到顯著提升(提高80%左右),從而實現了BHK21細胞高密度懸浮培養的目標,達到了細胞培養過程的可控性和有效性,提高了口蹄疫病毒的生產效率,為高品質疫苗的生產奠定了基礎,具有顯著的經濟效益。附圖說明圖1為不同葡萄糖濃度對細胞增殖的影響;圖2為不同氨濃度對BHK-21細胞生長的影響;圖3為乳酸濃度對細胞增殖的影響;圖4為BHK21細胞流加培養和批式培養的生長曲線;圖5為應用流加培養基代謝產物的積累;圖6為不同組別病毒滴度分析圖。具體實施方式下面結合具體實施例和附圖來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。但這些實施例僅是范例性的,并不對本發明的范圍構成任何限制。本領域技術人員應該理解的是,在不偏離本發明的精神和范圍下可以對本發明技術方案的細節和形式進行修改或替換,但這些修改和替換均落入本發明的保護范圍內。實施例一BHK21懸浮細胞基礎代謝水平的研究以及BHK-21細胞懸浮培養流加培養基的建立1材料1.1BHK-21細胞懸浮培養BHK-21細胞工作細胞庫,批號為BHK-21/W/S-201201。1.2培養基ZN-MEM培養基,按照申請號為201510980603.7,發明名稱為“一種用于BHK-21細胞高密度懸浮培養的低血清培養基及其在口蹄疫病毒增殖中的應用”的專利申請的配方,調整葡萄糖和谷氨酰胺濃度分別為1.98g/L和0.47g/L,委托宜興賽爾公司加工。調整后的ZN-MEM培養基包括氨基酸部分,平衡鹽部分,維生素部分、其他添加物、血清以及蒸餾水,pH值7.0~7.2,其中,血清添加濃度為1%(v/v),其他各原料物質在培養基中的終濃度如下所示:①氨基酸部分,包括:②平衡鹽部分,包括:③維生素部分,包括:④其它添加物,包括:1.3血清新生牛血清,購自合格供應商,按照中農威特生物科技股份有限公司新生牛血清內控質量標準檢驗合格后使用。1.4試劑與設備主要試劑:Labtech氨基酸色譜柱(5μm,250×4.6mmol);20種氨基酸標樣;乙腈(色譜純);醋酸鈉(分析純);醋酸(分析純);三乙胺(TEA);苯異硫氰酸酯(PITC);葡萄糖及乳酸測定試劑盒(南京建成)等。主要儀器:細胞分析儀(德國INNOVATIS公司);氨離子測定儀(美國Thermo公司);顯微鏡(日本Olympus);LC600高效液相色譜儀(北京Labtech公司)。Uv1700紫外分光光度計(日本島津),5L生物反應器(美國NBS),500L生物反應器(中農威特現有生物反應器)。2BHK-21細胞代謝需求水平的確定通過細胞代謝流的研究,觀察BHK21細胞特有的反應性變化,測知細胞與外界環境的關系,了解細胞生存條件,BHK21細胞對基礎培養基的代謝情況,檢測BHK21細胞培養性能,為流加培養的研究奠定基礎。2.1BHK21細胞對氨基酸的代謝需求通過檢測BHK-21細胞在調整后的ZN-MEM基礎培養基批式培養過程中對谷氨酰胺等各種氨基酸的消耗量,結合細胞生長情況,確定生產單位細胞量的各種氨基酸消耗率。氨基酸采用HPLC進行檢測。2.2BHK-21細胞對葡萄糖的代謝需求收集處于對數生長期的細胞,調整密度至0.4×106個/ml,分別接種于6個5L生物反應器中,培養參數:溫度37℃、DO值為68%、pH值為7.0、轉速120r/min。分別加入2.0mmol/L、4.0mmol/L、6.0mmol/L、8.0mmol/L、12.0mmol/L、24.0mmol/L的葡萄糖濃縮液,培養參數均自動控制,每12h取樣,統計活細胞密度與活率,分析葡萄糖的消耗情況。葡萄糖濃度采用葡萄糖氧化酶法試劑盒測定。2.3代謝副產物氨對BHK-21細胞增殖的影響收集處于對數生長期的細胞,調整密度至0.4×106個/ml,分別接種至6個5L生物反應器中,培養參數:溫度37℃、DO值為68%、pH值為7.0、轉速120r/min。分別加入0.0mmol/L、1.8mmol/L、2.5mmol/L、4.0mmol/L、6.5mmol/L、10.5mmol/L的氨濃縮液,培養參數均自動控制,每12h取樣,分析氨離子濃度對細胞生長代謝的影響,確定了BHK21細胞對氨離子最大耐受濃度為6.5mmol/L。氨濃度采用氨離子測定儀測定。2.4代謝副產物乳酸對BHK-21細胞增殖的影響收集處于對數生長期的細胞,調整密度至0.4×106個/ml,分別接種至6個5L生物反應器中,培養參數:溫度37℃、DO值為68%、pH值為7.0、轉速120r/min。分別加入2.0mmol/L、5.6mmol/L、9.4mmol/L、25.5mmol/L、45mmol/L和70mmol/L的乳酸濃縮液,培養參數均自動控制,每12h取樣一次,分析乳酸濃度對細胞生長代謝的影響,確定了BHK21細胞對乳酸最大耐受濃度為25.5mmol/L。乳酸濃度采用乳酸脫氫酶法測定試劑盒測定。3結果3.1BHK-21細胞營養代謝流分析3.1.1氨基酸對細胞增殖的影響結果如下表1和表2所示:表1BHK21批式培養過程中各種氨基酸的消耗情況(mM)AA/cell(*10-6)12h24h36h48h60h天冬氨酸0.0620810.0552960.0134650.0186580.040111谷氨酸0.3394780.216380.1015380.0903460.359461天冬酰胺0.0465680.0814410.0267580.0144040絲氨酸0.0544430.0919610.0085370.020020.057325谷氨酰胺1.9569114.2882731.0688160.2628780.061508甘氨酸0.2597330.3680040.1790140.0750810.080595組氨酸0.1441590.1040170.0277370.0206110.021832精氨酸0.3204330.3618770.063070.0447490.066662蘇氨酸0.6029890.611540.0832610.076770.191953丙氨酸0.4348430.5317350.3487010.4626180.846247脯氨酸0.0744960.0492530.0124060.0178510.036927絡氨酸0.4394220.1664050.0817840.0358070.069667纈氨酸0.6618890.4467440.1225380.1316650.209746蛋氨酸0.15590.14170.0315030.023420.026142胱氨酸0.1382120.2370220.0226440.0440370.181174異亮氨酸0.5601110.5122670.0602150.1594920.448084亮氨酸0.5896330.6584340.0552940.1843620.29804苯丙氨酸0.3371440.2533070.033990.0564450.111219色氨酸0.0751580.0639330.0056960.0096340.015861賴氨酸0.5151420.5116630.0401610.0685190.286571表2BHK21細胞對氨基酸的基礎代謝水平3.1.2不同葡萄糖濃度對BHK-21細胞增殖的影響不同葡萄糖濃度對細胞增殖的影響如圖1所示。由圖1可知,葡萄糖濃度低于6mmol/L時,細胞增殖明顯變緩,葡萄糖濃度在8mmol/L~12mmol/L時,細胞倍增數目最大且具有明顯的穩定期,葡萄糖濃度達24mmol/L時,細胞沒有明顯的生長周期,表現為持續的延遲期。可見BHK-21細胞在葡萄糖代謝過程中最適范圍在8mmol/L~12mmol/L。3.1.3代謝副產物氨和乳酸對BHK21細胞生長代謝的影響不同氨濃度對BHK-21細胞生長的影響如圖2所示,不同乳酸濃度對細胞增殖的影響如圖3所示。由圖2和圖3可知,BHK21細胞對代謝副產物乳酸的最大耐受濃度為25.5mM,對氨離子的最大耐受濃度為6.5mM。4BHK-21細胞流加濃縮培養液配方的確定通過上述檢測BHK-21細胞對葡萄糖、谷氨酰胺、氨基酸等營養物質的代謝需求量,應用化學計量的方法確定生產單位細胞所需的關鍵營養物質的比例,按營養物質的消耗速率設計一種適合BHK-21細胞增殖的流加培養基濃縮液配方和流加策略。流加培養基濃縮液配方命名為LP,包括蒸餾水、氨基酸、葡萄糖、維生素和其它添加物成份,各原料物質的濃度為:優選的,各原料物質的終濃度為:實施例二BHK21懸浮細胞流加培養工藝的優化與建立1.材料1.1BHK-21細胞懸浮培養BHK-21細胞工作細胞庫,批號為BHK-21/W/S-201201。1.2培養基調整后的ZN-MEM基礎培養基,同實施例一,委托宜興賽爾公司加工;流加濃縮培養液按照實施例一所述的優選配方制備。1.3血清新生牛血清,購自合格供應商,按照中農威特生物科技股份有限公司新生牛血清內控質量標準檢驗合格后使用。1.4試劑與設備主要試劑:Labtech氨基酸色譜柱(5μm,250×4.6mmol);20種氨基酸標樣;乙腈(色譜純);醋酸鈉(分析純);醋酸(分析純);三乙胺(TEA);苯異硫氰酸酯(PITC);葡萄糖及乳酸測定試劑盒(南京建成)等。主要儀器:細胞分析儀(德國INNOVATIS公司);氨離子測定儀(美國Thermo公司);顯微鏡(日本Olympus);LC600高效液相色譜儀(北京Labtech公司)。500L生物反應器(美國NBS),3000L生物反應器(自主設計委托生物反應器廠家生產),微泡通氣,自動控制pH值、DO值、攪拌轉速、溫度等參數,安裝和使用按說明書進行。2.方法2.1細胞復蘇與培養從懸浮培養BHK-21細胞工作細胞庫復蘇細胞一支,靜置培養于T100細胞方瓶內,傳2~3代,待細胞長滿單層后,用胰蛋白酶消化,補加適量細胞培養液轉移至1000ml三角瓶中(培養量約200ml),37℃恒溫搖床振蕩(120r/min)培養約48h,轉入3000ml三角瓶中,待細胞培養體積達到一定數量后,收集細胞,逐級放大,轉入5L生物反應器培養。2.2BHK-21細胞流加培養工藝策略的優化2.2.15L生物反應器BHK21細胞基礎培養利用5L生物反應器進行批式培養,所用培養基為調整后的ZN-MEM培養基;以初始接種密度0.5×106個/ml接種復蘇后的BHK-21細胞,培養參數:溫度37℃、DO值為68%、pH值為7.0、轉速120r/min。作為試驗組1。2.2.2流加培養策略的設計在5L生物反應器進行流加培養,在2.2.1所述的基礎培養的基礎上,根據培養體積,在不同時間流加濃縮營養液,分別作為試驗組2-5,流加方式如下表3所示:表3BHK21細胞流加培養方案流加培養過程中,每隔24h無菌在線取樣,進行細胞密度、活率和主要營養物質氨基酸、葡萄糖和維生素含量的測定,考察流加培養效果。2.3BHK-21細胞流加培養生物反應器關鍵參數的確定與優化以調整后的ZN-MEM為基礎培養基,按照試驗組5的方法進行流加培養,采用L16(45)正交實驗設計,選取溫度(T)、pH值、溶解氧(DO值)、攪拌速度(Agit)、滲透壓(mOsm)作為考察因素,以細胞密度和細胞活率為評價指標,以4.0×105個/ml為細胞接種密度,確定培養過程中關鍵參數控制對細胞增殖的影響。水平及正交實驗方案見表4以及表5。表4工藝參數優化水平及因素水平T(A)pH(B)DO(C)Agit(D)mOsm(E)136.06.805060320236.56.956080300337.07.1070100280437.57.2080120260表5L16(45)正交試驗設計注:T1、T2、T3、T4分別為各因素同一水平的均值。2.4工藝放大試驗取生長良好的細胞種子,以5L生物反應器確定的工藝最佳參數組合為標準,將細胞接種于500L和3000L生物反應器中,對其細胞活率、密度及比生長率等參數進行分析,進行放大效果驗證。3.結果3.1BHK-21細胞流加培養工藝策略的優化為了避免細胞培養過程中的營養物質限制和有毒代謝產物的積累,有效增加細胞密度和提高產物濃度,我們根據BHK-21細胞在基礎培養基中各種營養物質的代謝流和代謝產物的產量,結合細胞生長速率、細胞產量等情況,進行了流加策略的研究,流加方式如表3所示,不同流加培養方案對BHK21細胞生長狀態的影響如表6所示。表6不同流加培養方案對BHK21細胞生長狀態的影響由表6可知,不同試驗組都表現出典型的細胞生長周期,其中試驗組5培養效果最優,細胞經對數生長期,培養至72h,細胞在維持較高活率的條件下細胞密度達到了6.4×106cells/ml,較批式培養最大細胞密度提高近2倍。因此,在BHK21細胞的流加培養過程中,結合基礎培養基,我們選擇在培養24-36h,細胞密度1.5×106cells/ml以上,補加3%濃縮培養液,繼續培養至48h-72h流加2%濃縮培養液,培養72h收獲細胞,為流加培養策略,最佳的,選擇在細胞培養至24h,細胞生長密度達到1.5×106個/ml以上時,開始補加濃縮培養液,補加體積為原培養基體積的3%;培養至48h,再補加原培養基體積2%的濃縮培養液;培養至72h,收獲細胞。3.2細胞培養過程中生物反應器關鍵參數控制以調整后的MEM為基礎培養基(其中葡萄糖和谷氨酰胺濃度分別為11mM和1.6mM),按照試驗組5的方法進行流加培養,采用L16(45)正交實驗設計,選取溫度、pH值、DO值、攪拌轉速(Agit)、滲透壓(mOsm)作為考察因素,培養過程中,每隔24h無菌在線取樣,進行細胞密度、活率和主要營養物質氨基酸、葡萄糖和維生素含量的測定。以細胞密度、活率為評價指標,確定培養過程中關鍵參數控制對細胞增殖的影響。結果如表7所示。表7L16(45)正交試驗結果分析注:T1、T2、T3、T4分別為各因素同一水平的均值。從表7結果可以看出,10號試驗組細胞密度最大,即溫度、攪拌轉速在3水平、pH值在2水平、DO值在4水平、滲透壓在1水平時細胞增殖最快,各因子的最佳水平組合為A3B2C4D3E1,該組合可有效提高細胞的密度。但10、14、16組對細胞增殖能力的影響差異不顯著。因此在大規模懸浮培養生產工藝中,宜選擇如下工藝控制參數:溫度37.0~37.5℃、pH值為6.95~7.20、DO值為50.0%~80.0%、攪拌轉速為60~100r/min、滲透壓值為260~320mOsm/L,優選的,工藝控制參數:溫度37.0、pH值為6.95、DO值為80.0%、攪拌轉速為100r/min、滲透壓值為320mOsm/L。3.2BHK21細胞流加培養和批式培養的比較應用上述優化的培養條件,在5L生物反應器分別進行流加培養和批式培養的比較。流加培養條件:溫度37.0℃、pH值為6.95、DO值為80.0%、攪拌轉速為100r/min,滲透壓值為320mOsm/L;批式培養條件:接種密度0.45×106個/ml,溫度37℃、DO值為68%、pH值為7.0、轉速120r/min。由于流加培養具有更加優化的培養環境,細胞代謝旺盛,在保持高活率的條件下,培養細胞密度可達6.0×106個/ml,較批式培養密度提高近2倍,大大提高了目標產物的產量。BHK21細胞流加培養和批式培養的生長曲線如圖4所示。3.3工藝放大及驗證應用上述優化的流加培養基及流加培養工藝進行500L和3000L規模培養應用驗證。3.3.1BHK-21細胞流加培養過程中細胞增殖狀態分析表8BHK-21細胞生長情況將優化的流加培養關鍵參數組合進行500L和3000L不同規模細胞懸浮培養的應用驗證,如表8所示,按本發明確定的工藝,細胞主要增殖時間在24~72h之間,培養過程中活率達到95%以上,在培養72h細胞密度達到最大值,倍增比率高達15倍,活率96%以上,可見建立的細胞培養技術平臺能夠滿足規模化病毒生產要求。3.3.2BHK-21細胞流加培養過程中乳酸和氨濃度的變化應用流加培養基代謝產物的積累如圖5所示,從圖5結果可以看出,乳酸濃度低于9.4mM,氨濃度小于4.5mM時對細胞生長沒有影響。由此可見,BHK-21細胞在流加批培養過程中,代謝副產物氨和乳酸的積累并未達到對細胞增長的抑制濃度。4結論4.1以前期研究的基礎代謝水平實驗結果為依據,根據BHK-21細胞的生長和代謝特性,設計了營養物均衡供給的流加培養基,采用流加培養基和基礎培養基進行流加培養,設計不同的流加策略,獲得了適宜于口蹄疫病毒生產的BHK-21細胞流加培養工藝參數,為口蹄疫疫苗高效大規模工業化生產奠定了基礎。4.2進行規模化流加培養,生物反應器的過程控制參數對流加培養效果有著直接影響。本發明確定了流加工藝參數,即溫溫度37.0~37.5℃、pH值為6.95~7.20、DO值為50.0%~80.0%、攪拌轉速為60~100r/min、滲透壓值為260~320mOsm/L,優選的,工藝控制參數:溫度37.0、pH值為6.95、DO值為80.0%、攪拌轉速為100r/min、滲透壓值為320mOsm/L。通過控制細胞及環境因素的變化,可確保生產過程的一致性和穩定性,確保細胞產品產量和質量在可控范圍內,從而有效實施流加培養工藝。4.3應用上述確定的流加培養工藝關鍵過程控制參數組合,通過3000L生物反應器規模化流加培養的驗證,使細胞在培養過程中處于能夠滿足其生長代謝需要的營養供給環境,提高了BHK-21細胞流加培養的倍增數量,培養細胞終密度能達到6.5×106cells/ml,細胞活率可達94%以上,且避免了代謝副產物的積累。因此,本研究確定的用于口蹄疫病毒生產的BHK-21細胞流加培養工藝參數,能夠滿足工業化生產的需求。實施例三FMDV規模化生產過程中生物反應器參數控制對病毒增殖的影響1材料1.1BHK-21細胞批號為BHK-21/W/S。1.2培養基MD611,購自清大天一。1.3新生牛血清購自合格供應商,按照中農威特生物科技股份有限公司新生牛血清內控質量標準檢驗合格后使用。1.4毒種O/MYA98/BY/2010、FMD/Asia1JSL/06、Re-A/WH/09懸浮細胞毒由中農威特生物科技股份有限公司保存并提供。1.5主要設備5L生物反應器,購自美國NBS公司;500L生物反應器(中農威特生物科技股份有限公司提供),細胞分析儀,購自德國INNOVATIS公司;生物安全柜等。1.6小鼠及乳鼠蘭州獸醫研究所實驗動物中心引進繁殖的昆明種小鼠,體重18~22g,乳鼠系2~3日齡小鼠。2方法2.1試驗設計試驗采用L9(34)正交實驗設計,選取溫度(T)、pH值、DO值和Agit作為考察因素,分別命名為A、B、C、D4個因素,以146S含量為評價指標,確定病毒培養過程中參數控制對病毒增殖的影響,從而進行差異顯著性分析,對3個最優組病毒液TCID50、LD50進行檢測,試驗重復3次。水平及正交實驗方案見表9和表10。表9因子水平表水平T(A)pH值(B)DO(C)Agit(D)136.07.45050236.57.66060337.07.87070表10L9(34)正交試驗設計試驗號T(A)pH值(B)DO(C)Agit(D)111112122231333421235223162312731328321393321T12.162.262.522.48T22.592.902.402.65T32.952.452.602.59極差R0.430.230.180.10注:T1、T2、T3分別為各因素同一水平的均值。2.2病毒培養將5L生物反應器中按照實施例二方法培養好的對數生長期的BHK-21細胞4℃~8℃靜置,待細胞沉降后棄掉上清,加入病毒維持液,終體積為500mL,按病毒維持液體積的5%加入O/MYA98/BY/2010、FMD/Asia1JSL/06或Re-AWH/09型種毒,其生物反應器主要控制參數設定見表10,生物反應器均自動控制,測定146S含量,對3個最優組病毒液TCID50、LD50進行檢測,試驗重復3次。2.3培養工藝放大效果驗證采用前期在5L生物反應器所獲得的生物反應器工藝,對3個毒種的病毒在500L生物反應器進行擴大培養,檢測病毒液TCID50、LD50和146S含量,試驗重復3次。2.4檢測方法2.4.1146S含量檢測按《口蹄疫滅活疫苗中間品及成品146S抗原含量檢測方法》進行檢測。2.4.2LD50和TCID50檢測按常規方法進行。3結果3.1過程參數控制對病毒效價的影響確定細胞密度及病毒的接種量后,對過程參數控制進行優化,可實現生產工藝的最大優化策略,L9(34)正交試驗結果如表11所示。表11L9(34)正交試驗結果分析注:T1、T2、T3分別為各因素同一水平的均值.同列中相同字母表示差異不顯著,不同字母表示差異顯著(p>0.05)。如表11所示,8號試驗組146S含量最高,由此可見當溫度、攪拌在3水平、pH值在2水平、DO在1水平時146S含量最高,各因子的最佳水平組合為:A3B2C1D3,即溫度37.0℃,pH值7.6、DO為50.0%、攪拌為70r/min時,該組合可有效提高146S含量;極差分析表明:RA>RB>RC>RD,可見溫度和pH值對病毒增殖的影響最大。對最優的三組進行差異顯著性分析,結果表明,第5組、第7組和第8組差異不顯著,然后對此三組進行病毒效價的檢測,分別命名為Ⅰ、Ⅱ、Ⅲ組,結果如下圖6。3.2不同毒型的病毒工藝放大驗證如表12所示,用該工藝生產O/MYA98/BY/2010株病毒,每0.2ml的病毒液病毒含量為107.50LD50~108.50LD50,每1.0ml的病毒液病毒含量為107.50TCID50~108.17TCID50,每1.0ml病毒液146S含量為6.88~7.01μg;Re-A/WH/09株病毒,每0.2ml的病毒液病毒含量為107.50LD50~108.00LD50,每1.0ml的病毒液病毒含量107.50TCID50~107.83TCID50,每1.0ml病毒液146S含量為5.75~6.32μg;FMD/Asia1JSL/06,每0.2ml的病毒液病毒含量為107.00LD50~107.67LD50,每1.0ml的病毒液病毒含量107.50TCID50~107.83TCID50,每1.0ml病毒液146S含量為5.19~5.66μg。表12不同毒種病毒含量及146S含量結果4小結4.1確定了流加培養的BHK-21細胞生產O/MYA98/BY/2010、FMD/Asia1JSL/06和Re-A/WH/09口蹄疫病毒時生物反應器培養關鍵控制參數:溫度36.5~37.0℃,pH值7.4~7.6,DO值為50.0%~70.0%,攪拌轉速為50~70r/min。4.2用該流加培養工藝生產3種病毒,O/MYA98/BY/2010病毒,每0.2ml的病毒液病毒含量為107.50LD50~108.50LD50,每1.0ml的病毒液病毒含量為107.50TCID50~108.17TCID50,每1.0ml病毒液146S含量為6.88~7.01μg;Re-A/WH/09病毒,每0.2ml的病毒液病毒含量為107.50LD50~108.00LD50,每1.0ml的病毒液病毒含量107.50TCID50~107.83TCID50、每1.0ml病毒液146S含量為5.75~6.32μg;FMD/Asia1JSL/06,每0.2ml的病毒液病毒含量為107.00LD50~107.67LD50,每1.0ml的病毒液病毒含量107.50TCID50~107.83TCID50,每1.0ml病毒液146S含量為5.19~5.66μg。4.3采用本發明所述的流加培養工藝可進行規模化FMDV生產。實施例四ZN-MEM培養與流加培養得到的細胞培養病毒的對比結果為了說明采用ZN-MEM培養(按照申請號為201510980603.7,發明名稱為“一種用于BHK-21細胞高密度懸浮培養的低血清培養基及其在口蹄疫病毒增殖中的應用”專利申請所公開的方法制備)與本發明實施例二流加培養得到的BHK-21細胞在病毒培養中的差異,本發明分別采用ZN-MEM培養基與流加培養得到的BHK-21細胞按照實施例三的方法進行病毒增殖實驗,結果如下13所示:表13ZN-MEM培養與流加培養得到的細胞培養病毒的對比結果注:A:ZN-MEM培養;B:流加培養。從該表結果可以看出,用流加培養獲得的BHK-21懸浮細胞生產得口蹄疫病毒液,其效價為107.50LD50~108.00LD50,107.50TCID50~108.00TCID50,具有較強的感染性,均可達到生物制品規程規定的要求。而應用本發明研究的流加培養策略生產的不同型口蹄疫病毒液,較ZN-MEM培養試驗組,其有效抗原146S含量提升達80%,這為口蹄疫疫苗產業化生產產品品質的提升、生產效率的提高奠定了基礎。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1