稻瘟病菌的突變體菌株K2e12及其用途的制作方法
本發明涉及一種稻瘟病菌的突變體K2e12,以及其在使植物不致病上的用途,屬于微生物及微生物應用領域。
背景技術:
藥物靶標是藥物作用的對象,通常是具有重要生理或者病理功能,能夠與藥物相結合并產生藥理作用的生物大分子。藥物靶標的篩選和功能研究是發現特異、高效、低毒性藥物的前提。在病害真菌中,藥物靶標應該該具備以下特征:首先它們應該是菌體生長所必需的基因或基因產物并且具有高度保守和特異的序列,這樣才能篩選出對菌體高度特異而對人體或其他宿主無害的藥物;其次,藥物靶標應該是病原真菌生長和生存必不可少的,至少在侵染宿主的過程中至關重要;最后藥物靶標的生化功能要確認,必須有結合小分子化合物的化學特性。目前應用的抗真菌藥物按其靶點大致可分為三類:作用于真菌細胞膜的抗真菌藥物、作用于核酸合成的抗真菌藥物和作用于細胞壁合成的抗真菌藥物。第一類藥物靶標的代表是真菌細胞膜合成中的關鍵酶羊毛甾醇14α-去甲基化酶,使用氮唑類抗真菌藥物可以抑制該酶的活性,從而阻斷真菌細胞膜合成,導致真菌破裂死亡。第二類藥物的代表5-氟胞嘧啶(5-FC)進入真菌細胞后可以被轉化5-氟脫氧鳥嘧啶單磷酸從而抑制胸苷酸合成酶活性進而影響DNA的合成。第三類靶標的代表為β-1,3-葡聚糖合成酶,作為真菌細胞壁特有多糖的合成酶是一類比較理想的靶點。
近年來,隨著基因組學、蛋白質組學、生物信息學的快速發展,新的藥物靶標篩選技術不斷出現,如DNA芯片技術、蛋白質芯片技術、計算機輔助藥物設計技術、組合化學技術、化學遺傳學技術。這些技術大大提高了藥物靶標篩選的效率,加快了新藥研發的速度。從篩選出的潛在藥物靶標到最終成為藥物靶標還需要進一步的確認。目前藥物靶標的確認主要采用基因敲除、RNAi和抗體捕獲技術等技術,其中基因敲除具有其它方法難以比擬的直接性和有效性,仍是目前確認藥物靶標最有力的手段。高通量基因敲除技術在植物病原真菌中的使用使得通過直接敲除基因篩選藥物靶標成為可能。
蛋白激酶是一類催化蛋白質磷酸化反應的酶,它通過把ATP或GTP的γ-磷酸基團轉移到底物蛋白的氨基酸殘基上來活化底物。在真核細胞中,大約有30%蛋白質都有共價連接的磷酸基團,由此可見蛋白激酶在生命活動中扮演的重要角色。事實上蛋白激酶參與幾乎所有的細胞過程,如細胞代謝、轉錄、細胞循環、細胞的骨架構建、凋亡、分化、信號傳導、細胞間互作、細胞與細胞外基質相互作用等。蛋白激酶廣泛存在于真核生物中,從低等的原生動物到高等的哺乳動物,從低等藻類到高等植物以及真菌中都有蛋白激酶。由于蛋白激酶的成員眾多,Hanks和Hunter把它們歸類為蛋白激酶超家族。
真核生物蛋白激酶的催化結構域由250-300個氨基酸殘基組成,其氨基酸序列保守,又可分為12個功能亞域。Hanks和Hunter對人類370種蛋白激酶的氨基酸序列進行比對,以依賴cAMP蛋白激酶α催化亞基(PKA-Cα)作對照,發現亞域Ⅰ的Gly50和Gly52,亞域Ⅱ的Lys72,亞域Ⅲ的Glu91,亞域ⅥB的Asp171,亞域Ⅶ的Asp184和Gly186,亞域Ⅷ的Clu208,亞域Ⅸ的Asp220和Gly225,亞域Ⅺ的Ary280在95%的序列中保守。其中VIB、VIII和IX在整個蛋白激酶超家族中非常保守,而不同類型蛋白激酶的區別主要集中在Ⅵ、Ⅷ和Ⅸ亞域。蛋白激酶催化核心的功能包括:結合和定向ATP或GTP,該過程有二價陽離子(Mg2+或Mn2+)參與;結合和定向蛋白質或多肽;催化ATP或GTPγ-磷酸基團轉移到受體蛋白氨基酸殘基上。
蛋白激酶可以磷酸化底物蛋白的9種氨基酸殘基,分別是絲氨酸(serine)、蘇氨酸(threonine)、酪氨酸(tyrosine)、半胱氨酸(cysteine)、精氨酸(arginine)、賴氨酸(lysine)、天冬氨酸(aspartate)、谷氨酸(glutamate)和組氨酸(histidine)。根據其催化底物殘基的不同可以將其分成5類,其中絲氨酸和蘇氨酸蛋白激酶與酪氨酸蛋白激酶是最主要的兩類。在人類激酶組學研究中,對2244個蛋白質上6600個磷酸化位點進行分析,發現磷酸化的絲氨酸(pSer)、蘇氨酸(pThr)和酪氨酸(pTyr)位點分別占86.4%,11.8%,和1.8%也表明了這一點。
Hanks和Hunter在蛋白激酶的研究中做出了突出貢獻,他們第一次在分子系統發生層面描述了人類蛋白激酶超家族,奠定了后人研究蛋白激酶分類的基礎。Manning在Hanks和Hunter研究的基礎上,將所有的激酶按組,家族,亞家族三種層次分類并將人類的蛋白激酶分類擴展到9個組,134個家族,201個亞家族,這為研究人類與模式生物相關激酶的功能和進化關系提供了便利。蛋白激酶的分類主要依據是催化結構域的序列相似程度,催化結構域以外的序列和結構的相似度以及生化功能也是分類的重要依據。按照Manning的分類,人類的518種蛋白激酶分成“傳統”的蛋白激酶(ePK)和“非典型”的蛋白激酶(aPK)兩大類。ePK含478種蛋白激酶,又被分成9個組:AGC,CAMK,CK1,CMGC,RGC,STE,TK,TKL,Other;aPK含40種蛋白激酶,被分為8個組:Alpha,PIKK,PDHK,RIO,A6,ABC1,BRD,Other。由于aPK在序列上與ePK并沒有明確的相似性,但aPK具有蛋白激酶的功能,因此單獨分為一類。
技術實現要素:
本發明要解決的技術問題是提供一種稻瘟病菌的突變體菌株K2e12及其用途。
為了解決上述技術問題,本發明提供一種稻瘟病菌的突變體菌株K2e12,為Magnaporthe oryzae K2e12(稻瘟病菌Magnaporthe oryzae K2e12);其保藏號為:CCTCC NO:M 2016107。
作為本發明的稻瘟病菌的突變體菌株K2e12的改進:該稻瘟病菌的突變體菌株K2e12是MGG_07012基因缺失菌株。
本發明還同時提供了上述稻瘟病菌的突變體菌株K2e12的用途:用于侵染植物,使植物不致病;所述病為稻瘟病。
作為本發明的稻瘟病菌的突變體菌株K2e12的用途的改進:所述植物為水稻或大麥;水稻例如為Oryzae sativa cv.CO-39;大麥例如為Hordeum vulgare cv.Golden promise。
本發明還同時提供了上述稻瘟病菌的突變體菌株K2e12的另一種用途:利用K2e12蛋白的表達或修飾作為靶標,篩選抗真菌的藥物。
本發明的菌株Magnaporthe oryzae K2e12,其保藏信息具體如下:
保藏單位:中國典型培養物保藏中心;保藏地址:中國武漢武漢大學;保藏日期:2016年3月14日,保藏名稱:Magnaporthe oryzae K2e12;保藏號:CCTCC NO:M 2016107。
本發明所涉及的稻瘟病菌突變體菌株K2e12,確切的說是MGG_07012基因缺失突變體,更確切的說與稻瘟病菌野生型菌株Guy11相比,K2e12在基因組DNA水平上的差異在于K2e12不含MGG_07012基因,即稻瘟病菌突變體菌株K2e12是MGG_07012基因缺失菌株。在蛋白水平上的差異在于K2e12不含MGG_07012蛋白,在表達水平上的差異在于MGG_07012基因在K2e12中不表達。
綜上所述,菌株Magnaporthe oryzae K2e12來源于稻瘟病菌的突變體,屬于真菌界,子囊菌門,該菌株的致病作用喪失。
附圖說明
下面結合附圖對本發明的具體實施方式作進一步詳細說明。
圖1為雙重PCR驗證突變體結果圖;
圖1中的A代表第一輪PCR結果:將驗證目的基因的引物K2e12innerF/innerR和內參基因β-tubulin驗證引物tubulinF+tubulinR加入到同一反應體系里進行PCR,經瓊脂糖電泳后會出現如圖1A所示的結果,K2e12突變體中僅有一條條帶,而野生型Guy11中有兩條條帶;圖1中的B代表第二輪PCR結果,電泳后條帶如圖1B所示,K2e12突變體中有一條同源置換的條帶,而野生型Guy11中沒有條帶。兩輪PCR的結果顯示,稻瘟病菌MGG_07012基因在K2e12中已經缺失。
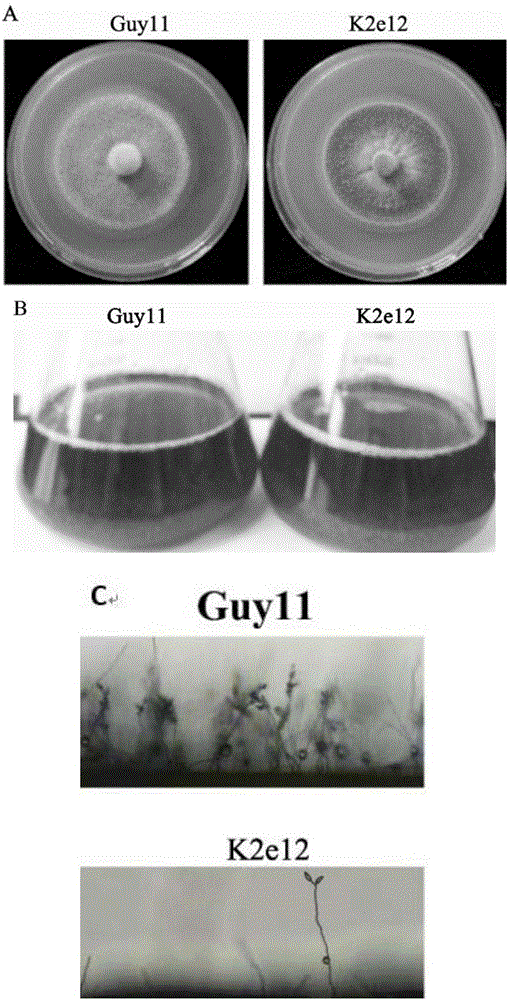
圖2為K2e12與野生型菌株Guy11的對比圖,
A為2種菌株在CM培養基上25℃暗培養7d后的菌落形態;
B為2種菌株的液體CM培養,K2e12與野生型Guy11無差別;
C為2種菌株在CM固體培養基上菌絲和孢子的形態比較;與野生型Guy11相比,K2e12氣生菌絲稀疏,幾乎不產生分生孢子。
圖3為稻瘟病菌突變體菌株和野生型菌株在大麥離體葉片上的致病性測試試驗,圖3的下圖為K2e12對大麥葉片致病性喪失,沒有可見病斑;相比之下,圖3的上圖接種了野生型菌株的在接種處產生面積較大的擴散性黑色病斑,而且病斑會快速沿著葉脈擴散至周圍的健康區域,病斑中央區域逐漸腐爛,并存在著大量的菌絲;因此得知:菌株K2e12對大麥的致病性喪失。
圖4為稻瘟病菌突變體菌株和野生型菌株在水稻苗上的致病性測試試驗,圖4的下圖為K2e12對水稻喪失致病性,沒有產生任何病斑;相比之下,圖4的上圖為野生型菌株在水稻上產生典型的梭形病斑;因此得知:菌株K2e12對水稻的致病性喪失。
具體實施方式
下面結合具體實施例對本發明進行進一步描述,但本發明的保護范圍并不僅限于此。
參照上述附圖,對本發明的具體實施方式進行詳細說明。
備注說明:下述所有的培養基使用前均需要按照常規方式進行高溫高壓的滅菌處理(121℃、0.24MPa、20分鐘)。
實施例1、敲除載體pKO1B-K2e12的構建
使用ClonExpressTM MultiSOne Step Cloning Kit(諾維贊公司)進行敲除載體的構建:首先利用引物K2e12upF+upR和K2e12downF+downR分別擴增目的基因的上游和下游片段,長度約為1.5k;然后用引物BarF+BarR擴增草銨膦抗性基因(引物序列如下)。隨后利用該試劑盒將PCR得到三個片段和經XbaI和HindIII雙酶切得到的pKO1B線性載體重組成目地載體pKO1B-K2e12。
引物序列:
K2e12upF:5’-GGTACCCGGGGATCCTCTAGACCGTAAGTTCAGGGTCATCATC-3’
K2e12upR:5’-CTCCTTCAATATCATCTTCTAGATGCGGCGATGTCTCC-3’
K2e12downF:5’-TGCCCGTCACCGAGATTTAGTCGTCTGCGGAGTCTGTC-3’
K2e12downR:5’-ACGACGGCCAGTGCCAAGCTTATGAAGAGTTGGTGGGATGAC-3’
BarF:5’-AGAAGATGATATTGAAGGAG-3’
BarR:5’-CTAAATCTCGGTGACGGGCA-3’。
實施例2、稻瘟病菌突變體菌株的獲得
農桿菌(Agrobacterium tumefaciens)菌株AGL1及質粒pCAMBIA1300等常規物均能通過常規方式獲得。農桿菌一般在28℃黑暗培養,生長的基本培養基為LB液體培養基,在4%的甘油中-70℃下保存。
CM(Complete Medium)培養基:20×Nitrate salts 50ml,1000×Trace Elements 1ml,D-glucose(葡萄糖)10g,Peptone(蛋白胨)2g,Yeast extract(酵母提取物)1g,Casamino acid(酪蛋白氨基酸)1g,1000×Vitamin solution 1ml,用1mol/L NaOH調pH值至6.5,加蒸餾水至1L。
CM固體培養基為上述CM(Complete Medium)培養基的基礎上加入瓊脂粉12g。
20×Nitrate salts(1000ml)的配置:NaNO3 120g,KCl 10.4g,MgSO4.7H2O 10.4g,KH2PO4 30.4g,水定容至1L。
1000×Trace Elements(100ml)的配置:ZnSO4.7H2O 2.2g,H3BO3 1.1g,MnCl2.4H2O 0.5g,FeSO4.7H2O 0.5g,CoCl2.6H2O 0.17g,CuSO4.5H2O 0.16g,Na2MoO4.5H2O 0.15g,Na4EDTA5g,水定容至100ml。
1000×Vitamin solution(100ml)的配置:Biotin 0.01g,Pyridoxin 0.01g,Thiamine 0.01g,Riboflavin 0.01g,PABA(p-aminobenzonic acid)0.01g,Nicotinic acid 0.01g,水定容至100ml。
水瓊脂培養基:蒸餾水加1.5%瓊脂粉(即瓊脂粉與蒸餾水的質量比為1.5:98.5),高壓滅菌,用于單孢分離。
LB液體培養基(Luria-Bertani):Tryptone(胰蛋白胨)10g、Yeast extract(酵母提取物)5g、NaCl(氯化鈉)10g,加去離子水至1000ml,用NaOH溶液調至pH7.5,高壓滅菌。
LB固體培養基:Tryptone(胰蛋白胨)10g、Yeast extract(酵母提取物)5g、NaCl(氯化鈉)10g、瓊脂粉12g,加去離子水至1000ml,用NaOH溶液調至pH7.5,高壓滅菌。
農桿菌誘導培養基AIM配方:0.8ml 1.25K-Phosphate-buffer pH 4.8(用KH2PO4和K2HPO4配制),20ml MN-buffer(30g/l MgSO4·7H2O,15g/l NaCl,1L H2O2),1ml 1%CaCl2·2H2O(w/v),10ml 0.01%FeSO4(w/v),5ml spore elements(100mg/l ZnSO4·7H2O,100mg/l CuSO4·5H2O,100mg/l H3BO3,100mg/l Na2MoO4·2H2O,1L H2O2)(過濾滅菌),2.5ml 20%NH4NO3(w/v),10ml 50%glycerol(v/v),40ml 1M MES pH 5.5(用NaOH溶液調pH值),20%glucose(w/v):液體培養基中加10ml,固體培養基加5ml,加水至1L,固體培養基加1.5%瓊脂粉,(200mM AS-用二甲基亞砜DMSO配制)。
上述所有的培養基均需要進行高溫高壓的滅菌處理(121℃、0.24MPa、20分鐘)。
在實驗室條件下,按照農桿菌介導的轉化方法即可獲得本發明的稻瘟病菌突變體菌株。具體如下:
首先,農桿菌感受態制備:將構建好的敲除載體pKO1B-K2e12通過凍融法轉化到農桿菌菌株AGL1。
將農桿菌菌株在LB平板上活化,然后轉到5mL LB液體培養基中28℃振蕩過夜培養;轉移2mL此培養液到裝有50mL LB液體培養基的三角瓶中28℃振蕩培養至OD600 0.5~1.0;冰上放置停止生長,4℃3000g離心5min;沉淀用1mL預冷的20mM CaCl2溶液懸浮,分裝到預冷卻的Eppendorf離心管中,每管0.1mL;
加1μg的載體(敲除載體pKO1B-K2e12)質粒DNA到上述離心管中,液氮中冷凍;37℃水浴5min解凍;加入1mLLB液體培養基,28℃輕搖培養2-4h;將培養好的菌液涂于含有卡那霉素(含50μg/ml)的LB平板上,正面放置30min,待菌液完全被培養基吸收后,倒置培養皿,28℃培養2-4d。
其次,稻瘟病菌的T-DNA轉化:從上述培養的LB平板(含50μg/ml卡那霉素)上挑選農桿菌單菌落接種于5ml LB液體培養基(含50μg/ml卡那霉素),200rpm/min,28℃過夜培養;第二天將200-400μl培養液轉移到5ml含50μg/ml卡那霉素的誘導液體培養基(AIM)中,OD值約0.15,28℃培養5~6個小時使OD600達到0.5~0.6;用10ml滅菌蒸餾水從培養大約10天的CM平板上洗下稻瘟病菌野生型分生孢子,三層擦鏡紙過濾后用血球計數板計數,并用無菌水稀釋孢子濃度為106個/ml;取100μl培養好的農桿菌AGL-1(含載體)菌液和100μl稀釋好的稻瘟病菌分生孢子懸浮液混合,混合液(200μl)均勻涂于AIM平板上的硝酸纖維素膜表面,AIM平板含200μM乙酰丁香酮(AS,acetosyringone)或不含AS作為對照,22℃共培養48小時;然后將硝酸纖維素膜轉移到含草銨膦與抗生素的DCM選擇平板上,選擇性培養基中含300μg/ml草銨膦、400μg/ml頭孢霉素(cefotaxime)、60μg/ml鏈霉素(streptomycin),將平皿置于28℃下培養到轉化子出現。
敲除載體pKO1B-K2e12被轉入農桿菌,隨后進行農桿菌介導的轉化。農桿菌介導的轉化得到的轉化子提取基因組后需進行兩輪PCR驗證:第一輪為雙重PCR,將驗證目的基因的引物K2e12innerF/innerR和內參基因β-tubulin驗證引物tubulinF+tubulinR加入到同一反應體系里進行PCR,經瓊脂糖電泳后會出現如圖1A所示的結果,K2e12突變體中僅有一條條帶,而野生型Guy11中有兩條條帶;然后進行第二輪PCR,該輪PCR的引物為K2e12longF+LbarR,電泳后條帶如圖1B所示,K2e12突變體中有一條同源置換的條帶,而野生型Guy11中沒有條帶。兩輪PCR的結果顯示,稻瘟病菌MGG_07012基因在K2e12中已經缺失。
稻瘟病菌MGG_07012基因,編碼548個氨基酸,含有蛋白激酶結構域,屬于AGC組,改組包括依賴環核苷酸的家族(PKA和PKG)、蛋白激酶C家族、β-腎上腺素受體激酶(βARK)、核糖體S6家族,這些激酶的催化位點是底物堿性氨基酸(Lys和Arg)附近的絲氨酸和蘇氨酸殘基。PKA,PKG,S6的底物從N端到磷酸結合位點間有特定堿性氨基酸殘基。PKC和RAC的底物磷酸化位點兩邊都有堿性氨基酸殘基。而G蛋白偶聯的受體激酶(βARK)卻相反,它的底物催化位點附近是酸性環境。稻瘟病菌突變體K2e12,是在稻瘟病菌野生型菌株Guy11中,利用草銨膦抗性基因置換MGG_07012基因所得,因此在突變體K2e12中,缺失MGG_07012基因,沒有該基因的表達,同時沒有該基因的蛋白存在。突變體K2e12與稻瘟病菌野生型菌株Guy11有顯著差異,突變體K2e12的菌絲稀薄,幾乎不產生分生孢子,對水稻和大麥的致病性喪失。相比較之下,稻瘟病菌野生型菌株Guy11中,MGG_07012基因正常表達,菌株Guy11的氣生菌絲濃密,能夠產生大量的分生孢子,對水稻和大麥有很強致病能力。
本發明獲得基因敲除突變體3個,將其中1個(K2e12)進行保藏,保藏信息具體如下:
保藏單位:中國典型培養物保藏中心;保藏地址:中國武漢武漢大學;保藏日期:2016年3月14日,保藏名稱:Magnaporthe oryzae K2e12;保藏號:CCTCC NO:M 2016107。
引物序列:
K2e12innerF:5’-CACACTGCTAAATGCCGAGA-3’
K2e12innerR:5’-GCACAGTGTTGCTGTGGACT-3’
tubulinF:5’-AGCCCTACAACGCTACCC-3’
tubulinR:5’-CGAGCACAGACAGCGAGT-3’
K2e12longF:5’-GAACAAGTGGCGTACAGACG-3’
K2e12LbarR:5’-GTCCTCGTTCCTGTCTGCTAAT-3。
實施例3、稻瘟病菌突變體菌株K2e12的形態觀察:
在CM培養基上觀察該突變體菌株的菌落形態、顏色、生長速率和產孢量。
觀察結果(圖2)顯示:突變體菌株K2e12在CM培養基上25℃光/暗培養7d后,與野生型菌株相比,氣生菌絲稀疏,菌落深灰色(圖2A)。突變體菌株K2e12在液體CM培養基中培養,與野生型菌株類似,菌絲蓬松,液體呈黃綠色(圖2B)。突變體K2e12與野生型菌株Guy11產孢能力有顯著差異,突變體K2e12幾乎不產生分生孢子,而野生型菌株Guy11產生大量的分生孢子(圖2C)。
備注說明:光/暗培養為12小時光培養(光線強度3000lux),12小時暗培養,以下同。
實施例4、稻瘟病菌突變體菌株K2e12對大麥葉片的侵染致病性喪失:
大麥(ZJ-8)光/暗育苗6d,剪取表面無損的第一片葉,用于接種試驗。25℃,在CM固體培養基上光/暗培養稻瘟病菌野生型Guy11及突變體菌株K2e12,7天后用0.5cm口徑的打孔器打取菌餅,將菌餅接種于離體的大麥葉片上,每片葉3個菌餅,3個重復,25℃,12/12h光/暗保濕培養,4d后觀察并記錄發病情況,試驗重復3次。
觀察結果(圖3)顯示:稻瘟病菌突變體菌株K2e12對大麥葉片致病性喪失,沒有可見病斑;相比之下,野生型菌株在接種處產生面積較大的擴散性黑色病斑,而且病斑會快速沿著葉脈擴散至周圍的健康區域,病斑中央區域逐漸腐爛,并存在著大量的菌絲。
實施例5、稻瘟病菌突變體菌株K2e12對水稻的致病性喪失:
水稻(CO-39)光/暗育苗14d;CM平板培養10天的稻瘟病菌,水洗孢子并用三層滅菌擦鏡紙過濾,用0.2%明膠稀釋孢子懸浮液至濃度1×105個/ml;用小型噴霧器將2-3ml孢子液均勻噴布于水稻苗上,每盆水稻用等量孢子液,每處理3個重復;22℃,黑暗保濕48h,然后將接種苗置于26℃光照條件下培養;5-7天后,觀察并記錄發病情況,實驗重復3次。
觀察結果(圖4)顯示:稻瘟病菌突變體菌株K2e12對水稻喪失致病性,沒有產生任何病斑;相比之下,野生型菌株在水稻上產生典型的梭形病斑。
實施例6、利用MoK2e12蛋白的表達或修飾作為靶標,篩選抗真菌的藥物:
把受MoK2e12基因調控的下游基因的啟動子與熒光蛋白GFP構建成融合蛋白載體,通過實施例2的方法轉入到稻瘟病菌中,然后把在下游基因的啟動子調控下的GFP表達的稻瘟病菌轉化子菌株在液體完全培養基中大量培養,收集菌絲后分成若干小份,每一份中加入待篩選的化合物或候選藥物繼續在完全培養基培養數小時至數天,取菌絲在熒光顯微鏡下觀察菌絲的GFP的綠色熒光表達情況。如果MoK2e12蛋白被候選藥物抑制而失去活性,則失去對下游基因的啟動子表達的調控能力,GFP蛋白不表達從而菌絲失去綠色熒光,說明該侯選藥物具有抑制MoK2e12蛋白的作用。獲得的具有抑制MoK2e12蛋白功能的候選藥物再利用實施例3的方法,在接種的孢子液中加入侯選藥物,測定野生型稻瘟病菌在這種侯選藥物存在的條件下對水稻的致病性有沒有減弱,進一步確定化合物的抗真菌效果。當測定結果為野生型稻瘟病菌株對水稻的致病性減弱時,說明候選藥物具有明顯的抗真菌效果,可以作為抗真菌藥物的來源;當測定結果為野生型稻瘟病菌株對水稻的致病性沒有變化或增強時,說明侯選藥物沒有抗真菌效果,不能用作抗真菌藥物。
綜上所述,稻瘟病菌突變體K2e12由于滿足缺失了致病基因,通過設計和篩選能夠破壞該基因的表達、剪切及其編碼蛋白的表達的化合物,或設計和篩選能對該蛋白的氨基酸序列進行修飾的化合物,從而開發出新的抗真菌藥物,或該突變體可以作為生防菌株在防治稻瘟病菌上進行開發應用,因此,其基因有望作為藥物靶標,其菌株有望作為生防菌劑。
最后,還需要注意的是,以上列舉的僅是本發明的若干個具體實施例。顯然,本發明不限于以上實施例,還可以有許多變形。本領域的普通技術人員能從本發明公開的內容直接導出或聯想到的所有變形,均應認為是本發明的保護范圍。
<110> 浙江大學
<120> 稻瘟病菌的突變體菌株K2e12及其用途
<160> 6
<210> 1
<211> 43
<212> DNA
<213>人工序列
<220>
<223> 引物K2e12upF
<400> 1
ggtacccggg gatcctctag accgtaagtt cagggtcatc atc 43
<210> 2
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> 引物K2e12upR
<400> 2
ctccttcaat atcatcttct agatgcggcg atgtctcc 38
<210> 3
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> 引物K2e12downF
<400> 3
tgcccgtcac cgagatttag tcgtctgcgg agtctgtc 38
<210> 4
<211> 42
<212> DNA
<213> 人工序列
<220>
<223> 引物K2e12downR
<400> 4
acgacggcca gtgccaagct tatgaagagt tggtgggatg ac 42
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物BarF
<400> 5
agaagatgat attgaaggag 20
<210> 6
<211> 20
<212> DN A
<213> 人工序列
<220>
<223> 引物BarR
<400> 6
ctaaatctcg gtgacgggca 20
- 還沒有人留言評論。精彩留言會獲得點贊!