一種胎盤源性干細胞的分離方法及其應用與流程
本發明涉及胎盤源性干細胞的分離、基因修飾方法以及治療缺血性疾病的領域。具體而言,本發明涉及一種新的胎盤源性干細胞分離方法及其基因修飾細胞在缺血性疾病治療中的應用。
技術背景
缺血性疾病包括冠心病、下肢動脈缺血、糖尿病動脈硬化等。缺血性疾病較大動脈病變可采用血管搭橋和血管腔內介入等治療,但末梢血管閉塞和不能耐受手術的患者,單純藥物治療效果不佳。利用干細胞和基因治療的方法相結合能夠有效改善機體缺血組織。
干細胞移植為肢體缺血性疾病提供了新的治療方法。胎盤中含有造血干細胞、間充質干細胞以及內皮祖細胞等多種細胞成分。胎盤源性干細胞(placenta-derived stem cells,PSCs)以取材方便、數量多、對供者無不利影響而成為研究重點。各種不同分離及培養方法獲得的細胞數量和生物學特性各不相同。如利用分離采集胎盤血單個核干細胞的方法可以富集造血細胞,從而通過造血干細胞移植用于治療白血病、各種免疫性疾病等。而通過切碎消化及培養等方法獲得的細胞多為間充質干細胞,可以用于成骨及免疫性疾病的治療。
胎盤源性干細胞PSCs有望成為骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)的替代來源。目前研究表明PSCs具有分泌促血管生長因子及向其他組織細胞誘導分化的能力[Lu GH,Yong WS,Xu ZM,et al.Human placental decidua basalis-derived mesenchymal stem cells differentiate into dopamine neuron-like cells with no response to long-term culture in vitro.Neuroreport.2012,23(8):512-518]。因此,PSCs也在治療缺血性疾病中具有很好的應用前景。
肝細胞生長因子(hepatocyte growth factor,HGF)是一種具有促血管生成活性的多功能生長因子。HGF基因治療在缺血性疾病的前期動物實驗及臨床研究中取得了很好的效果。
HGF基因修飾的干細胞是促進血管新生的一種極具有臨床應用前景的再生醫學手段,與單純的干細胞或基因治療相比更有優越性。本發明在兔肢體缺血模型中評價了Ad-HGF修飾的胎盤源性干細胞(PSCs)移植的治療作用,為將來其應用與臨床提供實驗依據。
技術實現要素:
本發明提供一種分離胎盤源性干細胞的方法,以及經HGF修飾的胎盤源性干細胞在治療缺血性疾病中的應用。具體而言,在本發明中,利用一種新的復合酶液體組合物,有效地分離胎盤源性干細胞。胎盤源性干細胞經過體外基因修飾后,能夠在動物模型中誘導血管新生,通過改善側枝循環,起到治療缺血的效果。
為了實現上述發明目的,本發明涉及如下技術方案。
在第一個方面,本發明涉及一種用于分離胎盤源性干細胞的復合酶液體組合物,其包含胰蛋白酶、膠原酶和分散酶。
在本發明的一個實施方案中,所述的復合酶液體組合物,胰蛋白酶0.01-0.1mg/mL、膠原酶0.1-5mg/mL和分散酶0.1-5mg/mL;優選地,其包含:胰蛋白酶0.03-0.1mg/mL、膠原酶0.5-3mg/mL和分散酶0.5-3mg/mL;優選地,其包含胰蛋白酶0.05mg/mL、膠原酶1mg/mL和分散酶1mg/mL.
在本發明的一個實施方案中,所述的復合酶液體組合物,其包含0.5-3重量%胰蛋白酶、0.5-3重量%膠原酶和0.5-3重量%分散酶;優選地,所述復合酶液體組合物包含1-3重量%胰蛋白酶、1-3重量%膠原酶和1-3重量%分散酶。
在本發明的一個實施方案中,所述膠原酶為I型膠原酶;
在本發明的一個實施方案中,所述分散酶為中性蛋白酶例如中性蛋白酶I。
在一個優選的實施方案中,所述胎盤源性干細胞為胎盤間充質干細胞。
在第二個方面,本發明涉及一種胎盤源性干細胞的分離方法,其包括將本發明的復合酶液體組合物通過泵入胎盤,以分離胎盤源性干細胞的步驟。
在一個優選的實施方案中,通過臍靜脈和動脈密閉來將復合酶液體組合物通過泵入胎盤。
在一個優選的實施方案中,所述胎盤源性干細胞為胎盤間充質干細胞。
本發明的第三個方面涉及一種胎盤源性干細胞,其由本發明中任一權利要求所述的分離方法制得。在本發明的一個實施方案中,所述的胎盤源性干細胞,其為HGF修飾的胎盤源性干細胞。
在第四個方面,本發明涉及一種提高血管生長因子表達水平的方法,其包括用Ad-HGF感染胎盤源性干細胞。
在一個優選的實施方案中,所述血管生長因子包括HGF、VEGF和bFGF。在進一步優選的實施方案中,所述血管生長因子為HGF。
在第五個方面,本發明涉及HGF修飾的胎盤源性干細胞在制備用于治療缺血性疾病的藥物中的應用。優選地,所述缺血性疾病選自冠心病、下肢動脈缺血和糖尿病動脈硬化中的任意一種或多種;優選地,所述HGF修飾的胎盤源性干細胞為前面所述的HGF修飾的胎盤源性干細胞。
在一個優選的實施方案中,所述胎盤源性干細胞為胎盤間充質干細胞。
在第六個方面,本發明涉及一種治療缺血性疾病的方法,其包括向受試者施用治療有效量的HGF修飾的胎盤源性干細胞的步驟。優選地,所述缺血性疾病選自冠心病、下肢動脈缺血和糖尿病動脈硬化中的任意一種或多種;優選地,所述HGF修飾的胎盤源性干細胞為前面所述的HGF修飾的胎盤源性干細胞。
在一個優選的實施方案中,所述胎盤源性干細胞為胎盤間充質干細胞。
給藥劑量取決于許多因素,例如所治療病況的嚴重程度,患者或動物的性別、年齡、體重及個體反應,以及待治療患者的病況和既往病史來選定。本領域通常的做法是,劑量從低于為得到所需治療效果而要求的水平開始,逐漸增加劑量,直到得到所需的效果。
在第七個方面,本發明涉及分離的經基因修飾的胎盤源性干細胞,其用于治療缺血性疾病。
在一個優選的實施方案中,所述胎盤源性干細胞為胎盤間充質干細胞。
本發明中,
術語“有效量”是指可在受試者中實現治療、預防、減輕和/或緩解本發明所述疾病和/或病癥的劑量。
術語“疾病和/或病癥”是指所述受試者的一種身體狀態,該身體狀態與本發明所述疾病和/或病癥有關。
術語“受試者”可以指患者或者其它接受本發明藥物組合物以治療、預防、減輕和/或緩解本發明所述疾病或病癥的動物,特別是哺乳動物,例如人、狗、猴、牛、馬等。
附圖說明
圖1胎盤干細胞經過分離和培養后的細胞形態。
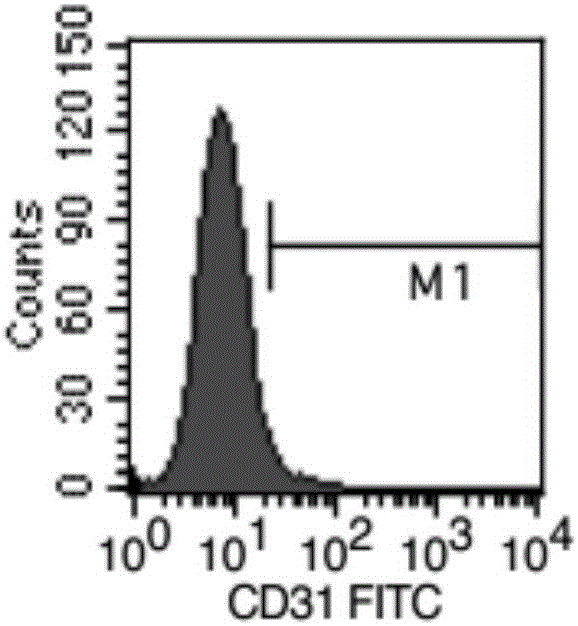
圖2通過流式細胞儀檢測細胞表面標志的表達。其中,
2A,流式細胞儀檢測細胞表面標志CD31的表達。
2B,流式細胞儀檢測細胞表面標志HLA-DR的表達。
2C,流式細胞儀檢測細胞表面標志CD34的表達。
2D,流式細胞儀檢測細胞表面標志CD45的表達。
2E,流式細胞儀檢測細胞表面標志CD11b的表達。
2F,流式細胞儀檢測細胞表面標志CD90的表達。
2G,流式細胞儀檢測細胞表面標志CD105的表達。
2H,流式細胞儀檢測細胞表面標志CD44的表達。
2I流式細胞儀檢測細胞表面標志CD73的表達。
圖3顯示HGF基因修飾PMSC移植缺血組織促血管生長因子表達。其中,
3A,Q-PCR測定細胞內HGF的表達。
3B,Q-PCR測定缺血組織局部VEGF,bFGF和HGF的表達。
圖4評價血管新生和血液循環改善。其中,
4A,動脈造影法評價血管新生和血液循環改善的情況。
4B,HE染色法評價左側治療組血管新生和血液循環改善的情況。
4C,HE染色法評價右側對照組血管新生和血液循環改善的情況。
具體實施方式
為進一步理解本發明,下面結合實施例對上述的技術方案做進一步的闡述和說明。以下實施例僅用于說明本發明而不用于限制本發明的范圍。
實施例1:胎盤間充質干細胞的分離培養
利用新的復合酶培養體系,包含0.05mg/mL胰蛋白酶、1mg/mL膠原酶和1mg/mL分散酶(中性酶),將消化酶組合液通過臍靜脈和動脈密閉泵入胎盤,速度為50mL/小時,達到消化和分離細胞的作用。在37℃消化2小時。收集沖出細胞,并洗滌后培養。培養條件為DMEM含15%FBS分離并培養胎盤間充質干細胞PSCs呈成纖維細胞狀,細胞狀態良好(圖1)。
1.試劑配制
a)分散酶(中性蛋白酶Ⅰ)儲存液(5mg/mL)
用超純水溶解分散酶,凍干酶可以在2-8度儲存至保質期,水溶液保存在-15到-25度,打開蓋子是注意別把粉末彈出(如果在真空中保存),盡量溶解已得到正確的濃度(包括附加在帽子上的)。
b)Ⅰ型膠原酶的儲存液(5mg/mL)
100mL PBS加入0.5g膠原酶粉末,0.2μm濾膜過濾并分到50mL管中。不要反復凍融在-20度可保存數個月。
c)DNase儲存液1:100(0.1mg/mL)
用1mL超純水溶解DNaseⅠ,轉移到50mL管中,加20mL超純水并混勻。保存在-20度。
d)胰酶原液(2.5%w/v,約為2.5mg/mL)
在500mL無菌磷酸鹽緩沖液中加入2.5g PVP粉制備PVP溶液。在用力搖動管完全溶解粉末獲得清亮的溶液。在200mL 0.5%PVP溶液中加入5g胰酶粉,加一個無菌的電磁攪拌器,4度攪拌30min。30min后,溶液依然渾濁。分裝1.5mL溶液到1.5mLEP管中,4度,15000g離心30min。收集上清到50mL管中,丟掉沉淀。水溶液保存在-20度。
e)PBS
NaCl 8g,KCl 0.2g,,Na2HPO4.12H2O 1.44g,KH2PO4 0.24g,加蒸餾水800mL,用鹽酸調PH至7.4,加水定容至1000mL。0.22μm微孔濾膜過濾除菌。
f)PBS/EDTA
PBS中加入EDTA,青霉素(100U/mL),鏈霉素(100mg/mL),4度保存1個月。每mL臍帶血或胎盤細胞懸液添加1.5mgEDTA。該溶液用于胎盤和血液收集和清洗介質。
g)HBSS(withCa2+、Mg2+)
NaCl 8g,KCl 0.4g,Na2HPO4.12H2O 1.26g,KH2PO4 0.06g,MgSO4 0.098g,CaCl20.14g,D-Glucose 1g,NaHCO3 0.35g,定容至1000mL,0.22μm微孔濾膜過濾除菌。
h)PBS/FBS
PBS加2%FBS,青霉素(100U/mL),鏈霉素(100mg/mL),4度保存1個月。該溶液用于胎盤和血液收集和清洗介質。
i)白蛋白(0.3%w/v,約為0.3mg/mL)
j)雙抗
10萬單位的青霉素粉末與10萬單位的鏈霉素粉末共同溶于1mL PBS緩沖液中,使用時1:1000稀釋。
k)RPMI1640培養基
RPMI1640干粉(Gibco)1袋,NaHCO3 2g,HEPES 2.38g/1L,pH 7.2,0.45μm,0.22μm微孔濾膜兩次過濾。
l)Mix消化液
中性酶(又譯為分散酶),購買自羅氏公司。分散酶1mg/mL,Ⅰ型膠原酶1mg/mL,胰酶0.05mg/mL,白蛋白0.3mg/mL。
2.方法與步驟
2.1.Ad-HGF修飾的胎盤間充質干細胞的獲取、體外培養、細胞懸液制備。
間充質干細胞分離與培養臨床上取足月產婦的胎盤組織(經產婦及其家人同意),準備胎盤收集儲存器:無菌消毒或用一次性無菌罐。準備含25000萬單位的肝素鈉PBS溶液,50mL,注入胎盤內后結扎臍帶,防止胎盤凝血。胎盤保護液:RPMI1640中加1%人血清白蛋白,1%雙抗和慶大霉素以及兩性霉素B,1%肝素鈉。4℃保存備用。無菌收集胎盤,置于含胎盤保護液的儲存器中。及時運送到實驗室進行分離。
2.1.1.胎盤血沖洗
松開臍帶,保持胎盤向下,將兩根靜脈導管分別插入兩根臍動脈中,縫線固定,靜脈插入另一根導管,同樣縫合固定。將一根臍動脈連接蠕動泵,另一根臍動脈斷流,通過臍動脈管緩慢沖入FBS/PBS,沖洗1000mL,通過靜脈管收集胎盤血。同樣沖洗另一根臍動脈,通過靜脈口收集胎盤血。沖洗約4000mL,直到胎盤脈管系統出現白色。
2.1.2胎盤干細胞收集
將蠕動泵連接臍動脈,通過蠕動將mix消化液泵入臍動脈,灌注200mL后斷流靜置消化2小時,將蠕動泵連接PBS,將PBS泵入臍動脈,沖洗約500mL,以徹底收集附著在胎盤血管內的干細胞。注入的體積要充滿整個血管。濾網過濾收集單細胞,將收集的細胞懸浮于MSC培養基中,置37℃、5%CO2濕度培養箱培養。
實驗結果:顯微鏡下觀察胎盤間充質干細胞,PMSCs呈成纖維細胞狀,細胞形態及生長狀態良好,見圖1。
2.2流式檢測細胞表面標志
材料與方法:
CD34/FITC,CD73/PE,CD105/PE,CD90/PE,HLA-DR/PE,CD44/PE,CD11b/PE,CD45/PE,CD31/FITC單克隆抗體均購自BD公司,FACS流式細胞儀(BD Calibur美國),
方法與步驟
1)PSC經培養4代后,用胰酶消化收集細胞后用PBS洗滌2遍后(預熱到室溫)制成5x105/0.1mL的細胞懸液;
2)加入1μl不同的抗體,小鼠FITC和PE標記的同型抗體標記細胞作為陰性對照,抗體包括CD105、CD90、CD73,CD44、CD45、CD11b、CD34、CD31、HLA-DR避光37℃孵育20min;
3)加4到5倍體積的低溫含2%FBS的DMEM培養基重懸洗滌細胞;
4)400μlPBS重懸細胞,用流式細胞儀收集、分析數據。
流式細胞儀測定結果:PSCs陽性細胞表面分子包括CD105、CD90、CD73,CD44其陽性率大于95%。而造血細胞相關的分子CD45、CD11b、CD34、CD31、HLA-DR等均<1%,符合間充質干細胞(MSCs)的鑒定標準,見圖2(2A-2I)。
實施例2:Ad-HGF修飾的PSC促進HGF表達
利用感染復數(multiplicity of infection,MOI)的Ad-HGF感染PSCs,感染48H后,收集細胞,然后通過QPCR的方法測定HGF的表達水平。并且,造影結束后,取兔缺血后肢肌組織,然后通過QPCR的方法測定肢肌肉組織中VEGF、bFGF、HGF的表達。
材料:DMEM培養基和Ad-HGF由本室生產制備,VEGF、bFGF、HGF引物由奧科公司合成。QPCR儀7500(ABI公司,美國),Green Real-time PCR Master Mix(TAKARA公司,日本)。
方法與步驟
1).組織RNA的提取:造影結束后,取兔缺血后肢肌組織加入液氮冷凍研磨后加入TRIZOL裂解提取組織總RNA,步驟如下:
①刀片切取0.3*0.3*0.3cm大小-80度冰箱凍存的大鼠股四頭肌組織塊,加入液氮在研缽內研碎,加入0.5mLTrizol裂解液裂解后將溶液吸入EP管內4度靜置10min。
②加入200μL三氯甲烷,混勻,4度靜置2-3min。
③12000rpm,4度離心15分鐘后取上清加入另一EP管內。
④EP管內加入等體積(約500μL)異丙醇,4度靜置10min,12000rpm,4度離心15分鐘后吸棄上清。
⑤沉淀加1mL預冷的75%的乙醇(用1‰DEPC水配)1mL,10000rpm,4度離心10分鐘。小心吸棄上清,晾干約10min,直至乙醇完全揮發完畢。
⑥小心倒掉上清,將管在空氣中干燥5-10分鐘,注意不能讓RNA沉淀完全干燥(否則會極大地降低它的可溶性)。再在管中加30μL的DEPC水溶解。每管抽提的RNA樣品各取1μL用核酸測定儀測定其RNA含量。
2).cDNA第一鏈的合成:
①取2μgRNA,加DEPC水定容至11μL,在無核酸EP管中加入、oligo(dT)primer 1μL
②65℃加熱5分鐘后迅速放置在冰上操作,并在無核酸EP管中加入如下個成分:5×reaction buffer 4μL、RiboockRnase Inhibitor(20u/μL)1μL、dNTP mix 2μL、Revert Aid M-MuLV Reverse Transcription(200u/μL)1μL。總反應體積為20μL;
③將以上混合物輕輕混勻;
④42℃溫浴60分鐘后終止反應。
Q-PCR
引物由北京奧科生物技術有限公司設計合成。
引物序列如下:
VEGF基因
正義引物:5'TAT TCA AGC CTT CCT GCG TG 3'(SEQ ID NO:1)
反義引物:5'TCA TCT CCC CTA TGT GCT GG 3'(SEQ ID NO:2)
bFGF基因
上游引物為5'CAA ACC GTT ACC TTG CTA TG 3'(SEQ ID NO:3)
下游引物為5'TTC GTT TCA GTG CCA CAT AC 3'(SEQ ID NO:4)
肝細胞生長因子(HGF)引物
上游引物5'GGA ACC AGA TGC TAG TAA GC 3'(SEQ ID NO:5)
下游引物5'CGA GCA AGA GGA CAA TAA TC 3'(SEQ ID NO:6)
內參照β-actin:
上游引物為:5’TGTTGTCCCTGTATGCCTCTG3’(SEQ ID NO:7)
下游引物為:5’ACCGCTCATTGCCGATAGTG3’(SEQ ID NO:8)
PCR擴增:
①PCR反應體系:
②PCR反應循環設置:Real-time PCR在ABI prism 7500系統上進行
反應參數均為:95℃5分鐘(預變性),94℃1分鐘(變性),55℃1分鐘(退火),72℃1分鐘(延伸),30個循環,最后72℃延伸10分鐘。反應完成后進行溶解曲線的檢測,以確保PCR反應的特異性。根據最后得出CT值結果進行數據分析。統計學處理采用SPSS 19.0統計軟件進行t檢驗分析,P<0.05為差異有統計學意義。
實驗結果:利用感染復數(multiplicity of infection,MOI)的Ad-HGF感染PSCs,然后通過Q-PCR的方法測定HGF的表達水平。如圖3A所示,Ad-HGF基因修飾后明顯提高了細胞內HGF的表達水平。Q-PCR檢測后肢肌肉組織中VEGF、bFGF、HGF的表達,結果顯示,在兔動物模型中也明顯提高了各種血管生長因子的水平。治療組VEGF\bFGF\HGF的表達明顯高于對照組,見圖3B。
實施例3:HGF基因修飾PSC移植促進血管新生
3.1動物模型的制作及干細胞移植術:
材料:新西蘭大白兔10只,軍事醫學科學院實驗動物中心訂購(動物許可證號:SCXK(京)2015-0005),體重在2-3kg,雌雄各半,年齡6周。
方法與步驟
3.1.1給兔經耳緣靜脈注射3%戊巴比妥鈉(50mg/kg)全身麻醉,實驗兔取左、右下肢造模。
3.1.2左、右后肢脫毛、消毒后自腹股溝韌帶中點至膝上做長切口,自兩側腹股溝韌帶至膝關節上下行一縱行切口行股動脈及其分支分離術,分別結扎并離斷股動脈及分支,左側下肢用1mL注射器將Ad-HGF修飾干細胞懸液1mL分10點注射于股動脈周圍的大腿肌肉群內,右側對照組則對照注射生理鹽水。
3.2腹主動脈造影移植注射后14d,取兔自耳緣靜脈注射戊巴比妥鈉(50mg/kg)全身麻醉,打開腹腔,顯露腹主動脈,行腹主動脈穿刺術后注入70%泛影葡胺連續攝片,進行雙下肢動脈造影,觀察側支循環的形成情況。攝影速度為4幀/s。
3.3 HE染色
方法與步驟
3.3.1實驗動物造影結束后取雙側下肢大腿中段肌肉,置于10%的中性甲醛固定24h。
3.3.2染色,整個染色過程包括五個內容:脫蠟,染色,脫水,透明和封固。
(1)脫蠟:
1.組織蠟塊進行連續切片,厚度3μm;
2.將切片在溫箱中烤干后,立即投入二甲苯中脫蠟10min;
3.移入無水酒精中,約2minx2次;
4.移入90%酒精中,約2minx2次;
5.移入80%酒精中,約2minx2次;
6.移入70%酒精中,約2min;
7.移入水中,洗去酒精,約2~3min;
8.移入蒸餾水中,約2min。
(2)染色:
1.移入蘇木素中,浸染10min,以稍深染為宜;
2.移入水中,洗去蘇木素和浮色,約1~2min;
3.移入分化液(1%鹽酸酒精)中,分化幾秒至30秒鐘,使切片褪色至淡藍紅色即可;
4.移入流水中,洗滌30~60min,使組織呈鮮藍色或天藍色;
5.移入伊紅液中,浸染2~5min;
6.移入水中,洗去伊紅浮液,并用紗布擦凈玻片上的多余染料。
(3)脫水:
1.吸去玻片上的水分后多入80%酒精中脫水約2minx2次;
2.移入90%酒精中脫水,約4minx2次;
3.移入無水酒精(100%酒精)徹底脫水,約5minx2次。
(4)透明
1.移入二甲苯Ⅰ中透明3-5min;
2.移入二甲苯Ⅱ中透明5-10min;
(5)封固
用樹膠封固,先從二甲苯Ⅱ中取出切片,將組織外圍的二甲苯迅速擦去,在滴上一滴樹膠于組織片上,然后取干凈的蓋玻片,仔細加在封固劑上,慢慢壓平,使蓋片位置適中。切片封固后,放在溫箱中烤干后觀察。
實驗結果:通過結扎方法建立了兔肢體缺血的動物模型,在結扎處移植經過Ad-HGF修飾的PSCs。治療后第14天腹主動脈穿刺行DSA造影檢查,可見左側肢體缺血治療后微血管生成數明顯多于未治療右側肢體缺血的微血管數,血管形成能力明顯增強。結果表明:Ad-HGF-PSCs治療組側支血管形成數明顯高于對照組可見兔左側下肢血管(標示1)較右側肢體(標示2)明顯代償性增粗,周圍分支明顯增多(圖4A)。常規HE染色,觀察雙側下肢血管分布密度。隨機選取400倍下10個視野,統計股直肌的毛細血管數和肌纖維數,以兩者比值計算毛細血管密度。結果顯示左側治療組(圖4B)的股直肌的毛細血管數和肌纖維數明顯多于右側對照組(圖4C),差異統有計學意義(P<0.05)。
以上僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
SEQUENCE LISTING
<110> 中國人民解放軍軍事醫學科學院放射與輻射醫學研究所
青島奧克生物開發有限公司
<120> 一種胎盤源性干細胞的分離方法及其應用
<130> IDC150239
<150> 201511021411.X
<151> 2015-12-31
<160> 8
<170> PatentIn version 3.2
<210> 1
<211> 20
<212> DNA
<213> Artificial
<220>
<223> VEGF基因正義引物
<400> 1
tattcaagcc ttcctgcgtg 20
<210> 2
<211> 20
<212> DNA
<213> Artificial
<220>
<223> VEGF基因反義引物
<400> 2
tcatctcccc tatgtgctgg 20
<210> 3
<211> 20
<212> DNA
<213> Artificial
<220>
<223> bFGF基因上游引物
<400> 3
caaaccgtta ccttgctatg 20
<210> 4
<211> 20
<212> DNA
<213> Artificial
<220>
<223> bFGF基因下游引物
<400> 4
ttcgtttcag tgccacatac 20
<210> 5
<211> 20
<212> DNA
<213> Artificial
<220>
<223> HGF上游引物
<400> 5
ggaaccagat gctagtaagc 20
<210> 6
<211> 20
<212> DNA
<213> Artificial
<220>
<223> HGF下游引物
<400> 6
cgagcaagag gacaataatc 20
<210> 7
<211> 21
<212> DNA
<213> Artificial
<220>
<223> β-actin上游引物
<400> 7
tgttgtccct gtatgcctct g 21
<210> 8
<211> 20
<212> DNA
<213> Artificial
<220>
<223> β-actin下游引物
<400> 8
accgctcatt gccgatagtg 20
- 還沒有人留言評論。精彩留言會獲得點贊!