從人胎盤羊膜制備羊膜間充質干細胞的方法及其應用與流程
本發明屬于干細胞治療技術領域,涉及從人胎盤羊膜制備羊膜間充質干細胞的方法,還涉及由該方法制備獲得的羊膜間充質干細胞,以及它們的治療用途。
背景技術:
干細胞是再生醫學發展的基礎,其有效的應用是實現人類健康長壽、防癌抗衰、永保年輕狀態、持續提高生活質量等終極夢想的有效方法。近年來,胚胎干細胞與成體干細胞在細胞生物學以及再生醫學研究領域倍受重視。然而,盡管胚胎干細胞具有其他細胞無法企及的全能性,但致瘤性、同種異體移植后的免疫排斥性以及無法避免的倫理爭議等因素在很大程度上限制了其在臨床的應用,而成體干細胞在組織中含量較少,缺乏特異性的表面標志的特點也成為其臨床應用的桎梏。
由于干細胞的多項分化潛能及其分泌多種細胞因子的功能,備受研究者的青睞。近年來,干細胞在組織損傷與修復中的應用越來越廣泛,而干細胞的來源一直是人們關注的焦點。骨髓間充質干細胞是較早被認識的成體干細胞之一。但由于抽取骨髓給患者帶來痛苦,而且骨髓干細胞的含量極少,使大量獲得受到限制。其他來源如脂肪組織,皮膚組織等都需取材于人體自體或異體組織,也不易取材或可能涉及倫理問題。
人羊膜來源于人胎盤組織,無血管、神經及淋巴,具有一定的彈性,厚0.02-0.5mm,在電鏡下,其分為5層:上皮層、基底膜、致密層、纖維母細胞層和海綿層。羊膜屬于孕婦生產后的廢棄物,一個胎盤的羊膜面積大約有600cm2,而且羊膜易于從胎盤上剝離,所以因羊膜具有取材方便,原料充足的特點而被認為是目前間充質干細胞的最佳來源。
人羊膜為半透明的薄膜,有多種促進細胞增殖的營養成分。羊膜基底膜和羊膜基質層含有大量不同的膠元,主要為I、Ⅲ、Ⅳ、Ⅴ、Ⅶ型膠原和纖維粘連蛋白、層粘連蛋白等成分。新鮮羊膜能產生一些生長因子,如:堿性成纖維細胞生長因子、肝細胞生長因子和轉化生長因子β等。目前,正在研究利用羊膜干細胞治療多種疾病,包括神經系統疾病、心肌梗死、肌萎縮癥、糖尿病及肝纖維化等。有研究表明羊膜間充質干細胞通過有高的血管生成能力和移植成活力,能促進糖尿病大鼠傷口的愈合。
人羊膜來源的干細胞包括人羊膜上皮細胞(humanamnioticepithelialcells,hAEC)和人羊膜間充質干細胞(humanamnioticmes-enchymalstromalcells,hAMSC),它們均能夠表達多種胚胎干細胞標記物,并且均具有較全面的多向分化潛能。
已有研究發現,培養的人羊膜間充質干細胞除表達神經干細胞的特異性標志蛋白nestin外,還表達干細胞特異性轉錄因子八聚體連接蛋白4(octamer-binding protein4,Oct-4),且表達能力比骨髓間充質干細胞更強。近來報道證實了其有向三胚層細胞分化的潛能:外胚層(神經)、中胚層(骨骼肌、心肌、內皮等)、內胚層(胰腺、肝)。有研究表明,培養3~4周后得到大量的貼壁間充質干細胞,形態學類似于骨髓間充質干細胞,且其比骨髓來源的MSCs具有更強的增殖能力。試驗中流式細胞儀檢測的結果符合以上結論,說明羊膜細胞具有與間充質干細胞相似的表面標志。在體外至少可以傳到第15代而保持其形態不變。大量的試驗研究也證實了hMSCs比骨髓間充質干細胞有更強的增殖能力及干細胞特性。
已經有諸多關于羊膜上取細胞的制備方法的報道。例如
CN102191218A(中國專利申請號201110080968.6,遵義)公開了一種完全培養基及人羊膜間充質干細胞(hAMSCs)的培養方法。完全培養基是按體積比向低糖-Dulbecco極限必須培養基溶液中加入3%-10%的人自體臍帶血血清配制而成;培養方法包括:(1)分離;(2)原代培養;(3)傳代培養。本發明采用前述完全培養基用于hAMSCs培養的優點為:回避了使用胎牛血清的風險,且無需添加L-谷氨酰胺、非必需氨基酸、2-巰基乙醇和丙酮酸等,仍可保持hAMSCs較好的增殖特性和表型特征及一些干細胞多向分化潛能標志基因和蛋白表達;傳代培養中hAMSCs貼壁的牢固程度明顯低于FBS培養條件,消化時間明顯縮短,減少了胰酶消化對細胞的損傷和細胞數量的損失。
CN101914490A(中國專利申請號201010252201.2)涉及一種人羊膜間充質干細胞無血清培養基及其培養方法。該培養基為DMEM/F12基礎培養基中添加人血清白蛋白、人轉鐵蛋白、人胰島素和亞硒酸鈉;其培養方法是將人羊膜先用胰蛋白酶消化,然后用膠原酶IV及脫氧核糖核酸酶I消化,過濾制成單細胞懸液;再通過VDMEM∶VF12=1∶1DMEM/F12基礎培養基中添加人血清白蛋白、轉鐵蛋白、胰島素和亞硒酸鈉,使人羊膜間充質干細胞在無血清條件下,置于37℃、飽和濕度、體積分數為5%的CO2培養箱中,通過換液和傳代,實現體外培養和擴增,并維持多向分化的潛能,擴增后的細胞能夠在體外誘導成軟骨細胞、成骨細胞和脂肪細胞。具有無其他動物源性、來源廣泛、不受倫理限制的特點。
CN102559586A(中國專利申請號201110404587.9,遵義)公開了一種人羊膜間充質干細胞的分離純化方法,包括以下步驟:第一,無菌采集人足月剖宮產胎盤,機械法將羊膜從胎盤組織上剝離,用D-Hank’s液沖洗數次以清除殘留血跡,將羊膜剪成碎片;第二,羊膜碎片加入含0.02%EDTA的0.05%胰蛋白酶消化溶液,于37℃,旋轉消化棄上清;重新加入消化液,于37℃旋轉消化棄上清,留取未消化的羊膜碎片;第三,D-Hank’s液沖洗未消化的羊膜碎片,加入含有0.075mg/ml DNase I的0.75mg/ml 的膠原酶,于37℃,旋轉消化約2h至組織完全消化,300目鋼網過濾,收集細胞濾液,離心得到原始的人羊膜間充質干細胞;第四,將分離的原始的人羊膜間充質干細胞重新懸浮于LG-DMEM培養基中,將細胞密度接種于6孔培養板,置于CO2培養箱培養,在倒置顯微鏡下除去完全未貼壁生長的羊膜上皮細胞,第3天更換新的培養基;待細胞匯合度達80~90%后,用胰蛋白酶—EDTA溶液消化,加入培養基終止胰蛋白酶作用,離心棄上清,細胞沉淀用培養基重新懸浮,以1×107/L的細胞密度傳代。
CN104450610A(中國專利申請號201410715000.X,賽萊拉)公開了一種人羊膜間充質干細胞傳代培養方法,其特征在于包括以下步驟:(1)原料清洗:待原代培養分離后的人羊膜間充質干細胞融合度達到80~90%后,吸去培養皿中的培養液,加入PBS清洗,然后吸去培養皿中的PBS;(2)消化:往培養皿中加入tryplE,轉移至CO2培養箱孵育1~2min后,加入完全培養基,用巴氏吸管反復吹打,至80~90%的細胞不再貼壁,終止消化;(3)離心:將步驟(2)得到細胞懸液離心管中,1000rpm/min離心5min;(4)計數:離心結束后,棄去上清液,用完全培養基重懸細胞沉淀,吹打混勻,得到的細胞懸液用細胞計數儀計數;(5)鋪板及培養:將步驟(4)的細胞懸液接種培養皿中,調整細胞密度為1.3×104/cm2,然后加入含有10ng/ml的EGF的完全培養基,將培養基轉至CO2細胞培養箱中進行培養。
CN103789258A(中國專利申請號201210506430.1,陸華)公開了一種人羊膜間充質干細胞的分離方法,其應用于酶消化法聯合EGF培養人羊膜間充質干細胞的過程,所述培養過程包括如下步驟:hAMSCs的分離,hAMSCs的原代培養,hAMSCs的傳代培養與擴增,hAMSCs的凍存和復蘇,以及hAMSCs細胞免疫表型的檢測;其特征在于,所述hAMSCs的分離步驟包括:無菌條件下取產后棄置的新鮮胎盤,采用機械法將羊膜從胎盤組織上剝離,用D-Hanks液沖洗數次以清除殘留血跡,將漂洗后的羊膜用眼科剪剪成約1mm3碎塊,加入胰蛋白酶37℃消化10分鐘;加入含小牛血清的DMEM終止消化,并輕柔吹打混勻后200目細胞篩過濾;過濾后的羊膜組織中加入II型膠原酶消化液,37℃消化30分鐘;加入含小牛血清的DMEM終止消化,輕柔吹打混勻后200目細胞篩過濾,收集細胞;1000轉/分鐘離心5分鐘;臺盼蘭染色計數活細胞,調整細胞密度為1×106/ml,接種至培養瓶,加入含bFGF和FBS的DMEM培養基;置37℃、飽和濕度、體積分數5%的CO2培養箱內培養;倒置相差顯微鏡下每日觀察原代和傳代細胞的生長情況和形態特征,隔天換液1次,并攝片記錄;待細胞匯合度達80%后,用0.25%胰蛋白酶-0.02%EDTA溶液于37℃消化2-3分鐘,加入培養基終止胰蛋白酶作用,1000轉/分鐘離心5分鐘,棄上清,細胞沉淀用培養基重新懸浮后,以1×107/ml的細胞密度傳代;以及傳代過程中,隔日換液1次,待細胞長滿70%瓶底重復以上步驟。
CN1810959A(中國專利申請號200610033007.9,北科)公開了一種人羊膜間充質干細胞的分離及培養方法及醫用組合物,分離及培養方法是將人羊膜用胰蛋白酶、膠原酶、脫氧核糖核酸酶相繼消化,然后過濾制成單細胞懸液,再采用加有體積百分含量為10%-20%的胎牛血清和終濃度為10-20ng/ml 的堿性成纖維生長因子的VDMEM∶VF12=1∶1的DMEM/F12培養基,置于37℃、飽和濕度、體積分數為5%的CO2培養箱中進行培養,通過換液和傳代,使人羊膜間充質干細胞逐漸得到擴增和純化。據信該發明方法具有來源廣泛,不受倫理限制等優越性,具有廣闊的應用前景,本發明的醫用組合物可用于神經替代治療、用于心肌梗塞的治療、用于糖尿病的治療、用于骨組織工程、應用于整形外科等。
CN105420179A(中國專利申請號201510963676.5,斯坦姆)公開了一種從臍帶和胎盤羊膜組織同時提取上皮細胞和間充質干細胞的方法,其特征在于:步驟如下:⑴臍帶和胎盤羊膜取材和接種:①高溫消毒手術器械和大玻璃皿,同時紫外線消毒超凈工作臺;②配制培養基:完全培養基的組成是:DMEM/F12加完全培養基總體積5%的胎牛血清、完全培養基總體積1%的胰島素、鐵傳遞蛋白和硒的混合添加物,完全培養基中終濃度為20毫微克/毫升的表皮生長因子和完全培養基中終濃度為20毫微克/毫升的堿性纖維母細胞生長因子,無菌過濾,4℃保存;所述DMEM/F12中DMEM:F12的體積比為1:1;所述混合添加物及在混合添加物中的終濃度為胰島素5微克/毫升、鐵傳遞蛋白10微克/毫升和亞硒酸鈉5毫微克/毫升;③嚴格篩選供者,血液化驗排除傳染病;④低溫冰盒中運送臍帶和胎盤:機械剝離胎盤羊膜之后,將臍帶和胎盤羊膜分別置于大玻璃皿中,以下步驟都在無菌條件下進行,將臍帶剪成1cm長的小段,將胎盤羊膜剪成約5X5cm長的方塊,用磷酸緩沖鹽水+總體積1%的青霉素+總體積1%的鏈霉素清洗組織兩次,洗干凈臍帶的血液;⑤將臍帶和胎盤羊膜組織放在4℃的磷酸緩沖鹽水中,以防止組織在機械剪碎時過熱而影響到細胞存活,使用組織剪碎機來分別破碎成1-3mm的碎塊,使用低速破碎組織,同時保持細胞活性,得到破碎的臍帶和羊膜組織;⑥將破碎的臍帶和羊膜組織分別轉移到T175細胞培養瓶中,并用組織刮取器將其平鋪于培養瓶底,小心加入少量完全培養基,使培養液既能覆蓋破碎的臍帶和羊膜組織塊,又不至于使其漂浮起來,置于37℃、飽和濕度5%CO2培養箱中培養;⑵間充質干細胞和羊膜上皮細胞在培養瓶中擴增和傳代:①培養過程中觀察可見細胞從組織塊逐漸游移出來,并進一步實現貼壁生長和增殖,在培養的第3-4天、當細胞生長融合成片時,用無菌磷酸緩沖鹽水洗去殘存的組織,全部換為新鮮完全培養基繼續培養;②此后每4天換一次培養液直到細胞長滿90-100%培養瓶底面積,便進行胰酶消化傳代;③胰酶消化傳代:倒棄培養液,用PBS洗細胞2次,每T175用10毫升質量百分數為0.25%的胰酶-EDTA在37℃消化10分鐘,待細胞懸浮后每個T175加入1毫升胎牛血清以中和胰酶反應,1000轉/分離心10分鐘,再懸浮于完全培養基中,按1∶4細胞數比例傳代到新T175培養瓶中;⑶間充質干細胞和羊膜上皮細胞的鑒定:①胰酶消化傳到第三代時,用流式細胞儀鑒定培養細胞的純度:羊膜上皮細胞的標記物包括:角蛋白CK19,CD29,和CD34;胎盤和臍帶間充質干細胞的標記物包括:CD73,CD90,和CD105;②流式細胞儀驗證細胞純度達到90%以上,化驗排除常見的傳染病,并排除細菌,支原體污染,即是符合標準,即得上皮細胞和間充質干細胞的混合物。據信該發明的方法成本低、簡單快速,使用組織剪碎機來將臍帶和胎盤羊膜剪碎成極小的碎塊,極為利于直接接種到培養瓶之后細胞向組織外游移;不使用任何蛋白酶試劑,從而大幅度地降低成本,減少制備時間,使得短時間大規模細胞制備成為現實;該方法使用添加生長因子及其它營養物的細胞培養基,節省了血清。
CN 103013913A(中國專利申請號201210505486.5,陸華)公開了供一種酶消化法聯合表皮生長因子(EGF)培養人羊膜間充質干細胞(hAMSCs)的方法,其包括如下步驟:hAMSCs的分離,hAMSCs的原代培養,hAMSCs的傳代培養與擴增,hAMSCs的凍存和復蘇,以及hAMSCs細胞免疫表型的檢測。本發明采用胰蛋白酶和膠原酶分步多次消化來收集羊膜細胞,通過加入4ng/mlEGF,將貼壁培養和消化時間控制相結合,獲得純度和活性較高人羊膜間充質干細胞(hAMSCs)。本發明的酶消化法聯合聯合EGF具有操作簡單,快速實用等優點,是一種較為有效的分離純化hAMSCs的方法。
CN 104450612A(中國專利申請號201410741509.1,敖云霞)公開了一種人羊膜間充質干細胞的分離與鑒定方法,采用組織塊貼壁法分離出羊膜間充質干細胞并傳代培養,對P1-P3代細胞進行細胞形態的觀察,用流式細胞儀檢測細胞膜表面陽性分子和陰性分子并采用六孔板法檢測細胞增殖情況,本實驗從胎盤羊膜組織中分離出細胞是hAMSCs,為進一步研究hAMSCs的生物學和免疫學特性、分化能力、核型穩定性,以及將其作為臨床應用的種子細胞等提供了基礎。
CN103555663A(中國專利申請號,道培)公開了一種培養人羊膜間充質干細胞的方法。它包括如下步驟:取新鮮采集的人羊膜,清洗,放入羊膜保護液中2-8℃保存備用;取浸泡在羊膜保護液中不超過48小時的人羊膜,清洗,再依次置臨用新配的青霉素鈉和硫酸鏈霉素含量分別為2500-3500U/mL和3500-4500U/mL的氯化鈉溶液和每毫升含30-50U注射用兩性霉素B的甲硝唑注射液中進行浸洗,最后再清洗后置于一次性無菌培養皿中進行備用,然后分離,培養至細胞融合度達80-90%即得。據信該發明能避免動物血清及動物來源的試劑帶來的潛在的危險性;48小時內均可用于羊膜間充質干細胞的培養,可操作性強;可大大減少因霉菌、厭氧菌污染造成的間充質干細胞分離培養不合格的幾率。
CN103422176A(中國專利申請號201310323661.3,龐希寧)公開了一種人羊膜間充質干細胞庫的構建方法。其方法是取人羊膜進行檢測,用磷酸緩沖液沖洗滌后粉碎,加磷酸緩沖液稀釋,用胰蛋白酶消化后,用膠原酶Ⅳ及脫氧核糖核酸酶I消化,過濾制成單細胞懸液;再通過VDMEM:VF12=1:1DMEM/F12基礎培養基中添加人血清白蛋白、轉鐵蛋白、胰島素和亞硒酸鈉,使人羊膜間充質干細胞在無血清條件下,置于培養箱中,換液和傳代。將體外培養和擴增獲得間充質干細胞置液氮冷凍,按新生兒性別和ABO/Rh分型及HLA分型保存,建立細胞信息檔案,構建出人羊膜間充質干細胞庫。據信該發明具有無其他動物源性、來源廣泛、不受倫理限制的特點。可提供間充質干細胞進行細胞治療及其他應用。
CN104450611A(中國專利申請號201410715077.7,賽萊拉)公開了一種人羊膜間充質干細胞原代分離及培養方法,包括以下步驟:提供人類羊膜組織、用PBS緩沖液沖洗然后剪碎、加入質量濃度為0.1~0.3%的胰蛋白酶進行消化、加入I型膠原酶及高糖DMEM基本培養基至I型膠原酶終濃度為0.1~0.2%消化、離心分離,取沉淀物、沉淀物用PBS溶液重懸,過濾后離心分離,棄去上清液,獲得人羊膜間充質干細胞。與現有技術相比,據信該發明利用少量胰蛋白酶預處理羊膜組織,使羊膜組織疏松,進而利用組織特異性更好的I型膠原酶處理羊膜,大大縮短了消化的時間,簡化了原代分離的步驟,而且能夠獲得較高的干細胞產量,獲得的干細胞活力也相比現有技術大大提高。
CN103642751A(中國專利申請號201310650384.7,同澤)公開一種從人羊膜中制取干細胞的方法,具體指一種羊膜中分離上皮細胞和間充質干細胞方法,涉及細胞分離技術領域。通過自制的無菌、高效、穩定的胎盤保護液對胎盤進行采集,利用消化法和爬片法的組合,將羊膜上皮細胞與羊膜間充質干細胞分離開來,分別得到高純度的羊膜上皮細胞和羊膜間充質干細胞。本發明解決了現有技術中存在人羊膜采集污染率高、采集后的細胞活性差,直接影響了后續的細胞分離及培養的問題。是對從人羊膜中分離干細胞的方法進行改良和創新,形成了一套標準化的分離方案,能夠更穩定,充分利用羊膜的干細胞資源,無污染,純度高,細胞數量更多,在保持細胞活性的同時,保證了干細胞的原始特性。
CN105062959A(中國專利申請號201510597698.4,領航)公開了一種人羊膜間充質干細胞的分離培養方法,經過人胎盤羊膜組織的采集、羊膜組織消毒、洗滌、剪碎、混合膠原酶消化、獲得間充質干細胞,再進行間充質干細胞體外培養。本發明能夠從人羊膜組織中獲得大量表型均一穩定,增殖能力強,并有多向分化潛能的間充質干細胞,通過培養基體外擴增,純化細胞,滿足凍存或臨床使用的數量。細胞培養周期短,重復性強。此方法獲得的干細胞具有CD105+,CD90+,CD73+的表型。
然而,本領域仍然期待有新的方法來制備人羊膜間充質干細胞,并且期待這種方法呈現出一種或者多種有益的技術效果。
技術實現要素:
本發明的目的在于提供一種從胎盤羊膜制備人羊膜間充質干細胞的方法,期待該方法呈現出一種或者多種有益的技術效果。
本發明第一方面提供了一種從胎盤羊膜制備人羊膜間充質干細胞的方法,該方法包括以下步驟:
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml 離心管;
(3)組織消化:在37℃恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液以100rpm振蕩消化30~60min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率;以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
根據本發明第一方面任一實施方案的方法,其中所述基礎平衡鹽溶液中包括鏈霉素和青霉素兩種抗生素。
根據本發明第一方面任一實施方案的方法,其中所述基礎平衡鹽溶液是通過如下方式配制得到的:將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根據本發明第一方面任一實施方案的方法,其中所述混合酶消化液中包含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶。
根據本發明第一方面任一實施方案的方法,其中所述完全培養基包括:DMEM-F12培養基、FBS、青霉素、鏈霉素。
根據本發明第一方面任一實施方案的方法,其中所述DMEM-F12培養基是DMEM-F12以體積比1:1配制的培養基。
根據本發明第一方面任一實施方案的方法,其中所述完全培養基包括:DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素。在一個實施方案中,所述的完全培養基中還添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%) 麥芽糖。已經出人意料地發現,向培養基中添加微量的硝酸硫胺和麥芽糖兩者后,可以顯著地提高人羊膜間充質干細胞的產量,而不使用它們二者或者僅增添其中之一時無法獲得這種效果。
根據本發明第一方面任一實施方案的方法,其中步驟(4)中,通常是培養10~15天(通常可以是12天左右)后傳代至P1代。
根據本發明第一方面任一實施方案的方法,其中步驟(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
進一步的,本發明第二方面提供了一種人羊膜間充質干細胞,其是通過本發明第一方面所述方法制備得到的。
根據本發明第二方面的人羊膜間充質干細胞,其是通過包括如下步驟的方法制備得到的:
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37℃恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液以100rpm振蕩消化30~60min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
根據本發明第二方面的人羊膜間充質干細胞,其中所述基礎平衡鹽溶液中包括鏈霉素和青霉素兩種抗生素。
根據本發明第二方面的人羊膜間充質干細胞,其中所述基礎平衡鹽溶液是通過如下方式配制得到的:將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根據本發明第二方面的人羊膜間充質干細胞,其中所述混合酶消化液中包含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶。
根據本發明第二方面的人羊膜間充質干細胞,其中所述完全培養基包括:DMEM-F12培養基、FBS、青霉素、鏈霉素。
根據本發明第二方面的人羊膜間充質干細胞,其中所述DMEM-F12培養基是DMEM-F12以體積比1:1配制的培養基。
根據本發明第二方面的人羊膜間充質干細胞,其中所述完全培養基包括:DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素。在一個實施方案中,所述的完全培養基中還添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%)麥芽糖。
根據本發明第二方面的人羊膜間充質干細胞,其中步驟(4)中,通常是培養10~15天(通常可以是12天左右)后傳代至P1代。
根據本發明第二方面的人羊膜間充質干細胞,其中步驟(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
進一步的,本發明第三方面提供了本發明第二方面任一實施方案所述人羊膜間充質干細胞在制備作為細胞治療劑的藥物中的用途。
根據本發明第三方面任一實施方案的用途,其中所述人羊膜間充質干細胞是通過包括如下步驟的方法制備得到的:
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37℃恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液以100rpm振蕩消化30~60min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養10~15天(通常可以是12天左右)后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
根據本發明第三方面任一實施方案的用途,其中所述基礎平衡鹽溶液中包括鏈霉素和青霉素兩種抗生素。
根據本發明第三方面任一實施方案的用途,其中所述基礎平衡鹽溶液是通過如下方式配制得到的:將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液。
根據本發明第三方面任一實施方案的用途,其中所述混合酶消化液中包含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶。
根據本發明第三方面任一實施方案的用途,其中所述完全培養基包括:DMEM-F12培養基、FBS、青霉素、鏈霉素。
根據本發明第三方面任一實施方案的用途,其中所述DMEM-F12培養基是DMEM-F12以體積比1:1配制的培養基。
根據本發明第三方面任一實施方案的用途,其中所述完全培養基包括:DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素。在一個實施方案中,所述的完全培養基中還添加了0.01~0.05%(例如0.01~0.04%、例如0.01~0.03%)硝酸硫胺和0.05~0.1%(例如0.06~0.1%、例如0.07~0.1%)麥芽糖。
根據本發明第三方面任一實施方案的用途,其中步驟(4)中,通常是培養10~15天(通常可以是12天左右)后傳代至P1代。
根據本發明第三方面任一實施方案的用途,其中步驟(5)中,胰酶消化液是包括0.25%的胰蛋白酶和0.02%的EDTA的消化液。
本發明任一方面或該任一方面的任一實施方案所具有的任一技術特征同樣適用其它任一實施方案或其它任一方面的任一實施方案,只要它們不會相互矛盾,當然在相互之間適用時,必要的話可對相應特征作適當修飾。下面對本發明的各個方面和特點作進一步的描述。
本發明所引述的所有文獻,它們的全部內容通過引用并入本文,并且如果這些文獻所表達的含義與本發明不一致時,以本發明的表述為準。此外,本發明使用的各種術語和短語具有本領域技術人員公知的一般含義,即便如此,本發明仍然希望在此對這些術語和短語作更詳盡的說明和解釋,提及的術語和短語如有與公知含義不一致的,以本發明所表述的含義為準。
通常地講,一個胎盤羊膜的面積約600平方厘米,本發明羊膜干細胞即取材于胎盤上的羊膜。
本發明方法的整個流程操作簡單,可控,P1代即可收獲大量細胞,為臨床應用和研究提供了可能。
已以發現,本發明所得人羊膜間充質干細胞經免疫細胞化學和免疫熒光染色檢測,結果均顯示,這些細胞均呈現人羊膜間充質干細胞的典型特征。例如,針對本發明獲得的流式檢測顯示:CD73、CD90、CD105陽性為陽性,CD34、CD45、HLADR、CD11b、CD19陰性;誘導分化結果顯示其:成軟骨、成脂、成骨為陽性。此外,已經發現,通過使用本發明方法,每400平方厘米羊膜可以得到108個以上的人羊膜間充質干細胞。
附圖說明
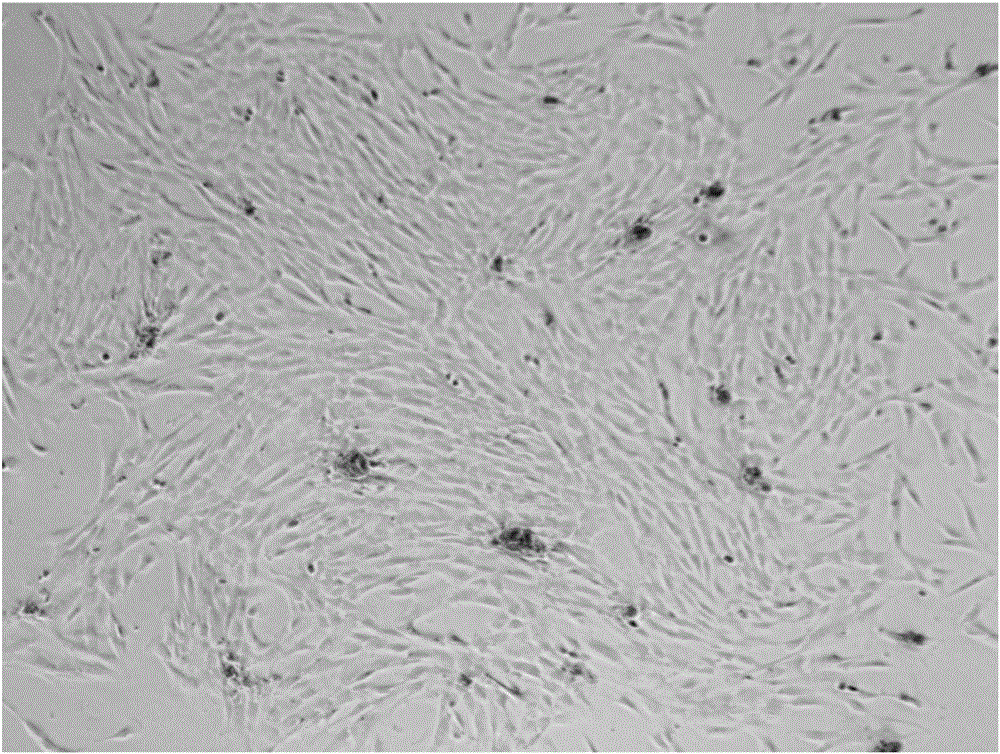
圖1顯示了本發明人羊膜間充質干細胞細胞顯微圖(培養3天,100倍放大);
圖2顯示了本發明人羊膜間充質干細胞細胞顯微圖(培養10天,40倍放大);
圖3顯示了本發明人羊膜間充質干細胞細胞顯微圖(培養10天,100倍放大);
圖4顯示了本發明人羊膜間充質干細胞細胞誘導分化的成骨測試結果;
圖5顯示了本發明人羊膜間充質干細胞細胞誘導分化的成軟骨測試結果;
圖6顯示了本發明人羊膜間充質干細胞細胞誘導分化的成脂測試結果。
具體實施方式
通過下面的實施例可以對本發明進行進一步的描述,然而,本發明的范圍并不限于下述實施例。本領域的專業人員能夠理解,在不背離本發明的精神和范圍的前提下,可以對本發明進行各種變化和修飾。本發明對試驗中所使用到的材料以及試驗方法進行一般性和/或具體的描述。雖然為實現本發明目的所使用的許多材料和操作方法是本領域公知的,但是本發明仍然在此作盡可能詳細的描述。
本發明下文試驗中所使用的材料例如其中所使用的試劑是本領域已知的,其可以采用公知方法配制或者直接從市場購得。
實施例1:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化40min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1∶1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養12天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養12天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
實施例2:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化30min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養10天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養15天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
實施例3:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化60min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養15天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養10天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
經本發明實施例1~3的方法制備P1代的人羊膜間充質干細胞,針對不同胎盤樣本,平均地講,每400平方厘米羊膜可以得到(1.51~2.07)×108個人羊膜間充質干細胞。但是經本發明實施例4~6的方法制備P1代的人羊膜間充質干細胞,針對不同胎盤樣本,平均地講,每400平方厘米羊膜可以得到(8.83~10.77)×108個人羊膜間充質干細胞,顯著地高于實施例1~3方法。本發明在參照實施例4~6的補充試驗中,發現如果在完全培養基中硝酸硫胺和麥芽糖二者只添加其中的一種,則此時制備P1代的人羊膜間充質干細胞,針對不同胎盤樣本,平均地講,每400平方厘米羊膜可以得到(1.58~1.91)×108個人羊膜間充質干細胞,這表明將硝酸硫胺和麥芽糖之一增補到完全培養基中無法有效地提高人羊膜間充質干細胞的產量。此外,本發明人參考其它現有技術文獻,例如本發明已經引用的專利文獻中的方法制備P1代(以P1代為比較參數,更具可比性)的人羊膜間充質干細胞時,其平均每400平方厘米羊膜可以得到的人羊膜間充質干細胞小于1.5×108個。
實施例4:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化40min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1∶1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素、0.02%硝酸硫胺、0.085%麥芽糖)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養12天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養12天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
圖1顯示了本實施例人羊膜間充質干細胞細胞顯微圖(培養3天,100倍放大);圖2顯示了本實施例人羊膜間充質干細胞細胞顯微圖(培養10天,40倍放大);圖3顯示了本實施例人羊膜間充質干細胞細胞顯微圖(培養10天,100倍放大);圖4顯示了本實施例人羊膜間充質干細胞細胞誘導分化的成骨測試結果;圖5顯示了本實施例人羊膜間充質干細胞細胞誘導分化的成軟骨測試結果;圖6顯示了本實施例人羊膜間充質干細胞細胞誘導分化的成脂測試結果。
實施例5:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化30min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素、0.01%硝酸硫胺、0.1%麥芽糖)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養10天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養15天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
實施例6:從胎盤羊膜制備人羊膜間充質干細胞
(1)從胎盤樣品采集盒中取出胎盤,置于白瓷盤中,使用基礎平衡鹽溶液(將0.4g的KCl、0.06g的KH2PO4、0.132g的Na2HPO4.12H2O、8g的NaCl、0.35g的NaHCO3、1.0g的D-葡萄糖、0.10g的鏈霉素、0.06g的青霉素用水溶解并定容成1L的溶液,即得)反復沖洗表面,對胎盤進行消毒處理;
(2)用手術鑷慢慢撕取胎膜外層羊膜置于150mm玻璃皿中,使用基礎平衡鹽溶液反復清洗表面污血,剪碎成直徑為5mm的羊膜組織小塊;用300目濾網過濾,生理鹽水沖洗殘血,組織塊轉移至50ml離心管;
(3)組織消化:在37度恒溫搖床中,將組織塊用1倍組織體積的混合酶消化液(內含:0.1mg/ml的I型膠原酶,0.3mg/ml的II型膠原酶,0.1mg/ml的透明質酸酶和0.05mg/ml的中性蛋白酶)以100rpm振蕩消化60min;消化結束后,加2ml胎牛血清混勻終止;用200目濾網過濾并用大量生理鹽水清洗,收集濾液;
(4)分別對濾液部分和組織塊部分進行細胞培養:
濾液部分:收集的濾液以1500rpm離心5min,去上清,用生理鹽水重懸清洗細胞沉淀;以1500rpm離心5min,去上清,將細胞沉淀用完全培養基(DMEM-F12(1:1)培養基、10%FBS、100μg/mL青霉素、50μg/mL鏈霉素、0.03%硝酸硫胺、0.07%麥芽糖)重懸;計數儀計取有核細胞數并用臺盼蘭染色測定細胞活率(通常可得大于1×107細胞,細胞活率大于95%);以每瓶2×106個細胞接種于75cm2培養瓶中,添加20ml完全培養基,晃勻后在5%CO2、37℃培養箱中培養;定期換液;培養15天后傳代至P1代,繼續用完全培養基培養;
組織塊部分:將收集的組織塊置于75cm2培養瓶中,使組織塊能夠覆蓋培養瓶中一半的培養面積,添加完全培養基沒過組織,晃勻后于5%CO2、37℃培養箱中培養;2d后補液10ml完全培養基,繼續培養;較多間充質干細胞爬出后去組織,定期換液;培養10天后傳代至P1代,繼續用完全培養基培養;
(5)P1代細胞收獲:用胰酶消化液(包含0.25%的胰蛋白酶和0.02%的EDTA的消化液)將上一步驟中的兩部分合并后的P1代細胞消化后,收集細胞,計數并測定細胞活率,凍存,即得P1代的羊膜間充質干細胞,必要時對其進行傳代培養。
試驗例1:羊膜間充質干細胞的驗證:
使用流式細胞儀檢測下列項目
CD73檢測:準備兩支流式管,編號,其中一支為質控管一支為樣品管,將CD73的control試劑搖勻,向質控管中加入20ul,再將CD73試劑搖勻,向樣品管中加入20ul CD73試劑,然后將樣品震蕩搖勻向兩支流式管中各加入600ul樣品,然后混勻,置于4℃左右避光孵育30分鐘,然后向質控管和流式管中分別加入1毫升PBS,混勻后1500轉/分鐘離心5分鐘,后棄去上清,加入240ul的PBS后混勻上機,檢測陽性結果≧95%則為合格,出具細胞表面標記物檢測合格報告。
CD90檢測:準備兩支流式管,編號,其中一支為質控管一支為樣品管,將CD90的control試劑搖勻,向質控管中加入20ul,再將CD90試劑搖勻,向樣品管中加入10ul CD90試劑,然后將樣品震蕩搖勻向兩支流式管中各加入600ul樣品,然后混勻,置于4℃左右避光孵育30分鐘,然后向質控管和流式管中分別加入1毫升PBS,混勻后1500轉/分鐘離心5分鐘,后棄去上清,加入240ul的PBS后混勻上機,檢測陽性結果≧95%則為合格,出具細胞表面標記物檢測合格報告。
CD105檢測:準備兩支流式管,編號,其中一支為質控管一支為樣品管,將CD105的control試劑搖勻,向質控管中加入10ul,再將CD105試劑搖勻,向樣品管中加入5ulCD105試劑,然后將樣品震蕩搖勻向兩支流式管中各加入600ul樣品,然后混勻,置于4℃左右避光孵育30分鐘,然后向質控管和流式管中分別加入1毫升PBS,混勻后1500轉/分鐘離心5分鐘,后棄去上清,加入240ul的PBS后混勻上機,檢測陽性結果≧95%則為合格,出具細胞表面標記物檢測合格報告。
備注:所有細胞表型檢測所用試劑的量均為經過實驗可行后確定的使用量。
CD45檢測:準備兩支流式管,編號,其中一支為質控管一支為樣品管,將CD45的control試劑搖勻,向質控管中加入20ul,再將CD45試劑搖勻,向樣品管中加入20ul CD45試劑,然后將樣品震蕩搖勻向兩支流式管中各加入600ul樣品,然后混勻,置于4℃左右避光孵育30分鐘,然后向質控管和流式管中分別加入1毫升PBS,混勻后1500轉/分鐘離心5分鐘,后棄去上清,加入240ul的PBS后混勻上機,檢測陽性結果≦2%則為合格,出具細胞表面標記物檢測合格報告。
HLA-DR檢測:準備兩支流式管,編號,其中一支為質控管一支為樣品管,將HLA-DR的control試劑搖勻,向質控管中加入20ul,再將HLA-DR試劑搖勻,向樣品管中加入20ulHLA-DR試劑,然后將樣品震蕩搖勻向兩支流式管中各加入600ul樣品,然后混勻,置于4℃左右避光孵育30分鐘,然后向質控管和流式管中分別加入1毫升PBS,混勻后1500轉/分鐘離心5分鐘,后棄去上清,加入240ul的PBS后混勻上機,檢測陽性結果≦2%則為合格,出具細胞表面標記物檢測合格報告。
羊膜間充質干細胞向成骨細胞的誘導分化:1)堿性磷酸酶染色:成骨細胞會產生大量堿性磷酸酶,藍紫色染色為堿性磷酸酶陽性。2)鈣鹽沉積染色:成骨細胞會產生鈣鹽的沉積,橙紅色著色為陽性。這樣的結果是典型的向成骨細胞的誘導分化的陽性結果。
其它檢測項目亦可使用本領域公知的方法進行。
通過本試驗例1的測試方法測試本發明實施例1~6所得人羊膜間充質干細胞,經檢測,結果顯示各參數均與人羊膜間充質干細胞典型特征相符。例如,經流式檢測,實施例1~6所得人羊膜間充質干細胞其CD73、CD90、CD105陽性為陽性,CD34、CD45、HLADR、CD11b、CD19陰性;這些羊膜間充質干細胞的誘導分化結果顯示其:成軟骨、成脂、成骨為陽性。結果顯示這些標志物或誘導分化性能均與人羊膜間充質干細胞符合。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 從人胎盤羊膜制備羊膜間充質干細胞的方法及其應用與流程
- 一種臍療貼的制備方法及應用與流程
- 一種干細胞制劑及其在制備治療慢性腎炎的藥物中的應用的制作方法與工藝
- 臍帶間充質干細胞在制備治療角膜損傷的干細胞制劑中的應用的制作方法與工藝
- 臍帶間充質干細胞聯合黃芪多糖在制備治療高血糖和糖尿病腎病藥物中的應用的制作方法與工藝
- 由臍帶間充質干細胞制備CD34陽性細胞的方法與流程
- 基因重組干細胞制劑的制備方法及其在皮膚損傷修復、瘢痕抑制中的應用與流程
- 一種大規模制備人臍帶間充質干細胞因子用誘導分泌培養基的制作方法與工藝
- 一種人母乳干細胞的制備方法及其應用與流程
- 間充質干細胞聯合維生素E在制備腎臟組織細胞修復藥物中的應用的制作方法與工藝