釕配合物在DNA和酸性pH雙功能磷光傳感中的應用的制作方法
本發明涉及水溶液中的DNA和pH傳感領域,具體涉及一個釕配合物在水溶液中的DNA和pH磷光傳感中的應用。
背景技術:
1990年,Barton等人通過研究發現配合物[Ru(bpy)2(dppz)]2+的水溶液幾乎不能發出熒光,向其中逐漸加入DNA之后,溶液的熒光大幅增強,當配合物與DNA達到鍵合飽和時,熒光增強的倍數可達104[Friedman,A.E.;Chambron,J.C.;Sauvage,J.P.;Turro,N.J.;Barton,J.K.J.Am.Chem.Soc.1990,112,4960.]。在DNA加入前后,配合物都經歷了熒光從無到有的大幅變化,于是人們形象地把它們叫作“DNA的光開關”。后來,Barton和Barbara等人對上述配合物的DNA光開關性質的機理進行了探究,他們發現配合物的激發態3MLCT直接指向配體dppz的吩嗪環,在沒有DNA存在時,雜環吩嗪上的N原子易與周圍溶劑水分子形成氫鍵導致配合物產生非輻射躍遷,因而沒有熒光被觀察到;配合物與DNA分子發生鍵合作用后,位于嵌入配體上的吩嗪環的N原子得到疏水的DNA堿基區的保護,溶劑水分子難以對其產生影響,從而出現熒光增強的現象[Turro,C.;Bossmann,S.H.;Jenkins,Y.;Barton,J.K.;Turro,N.J.J.Am.Chem.Soc.1995,117,9026.]。Ru(II)配合物作為DNA光開關的發現是一個令科研工作者興奮的結果,配合物分子的DNA光開關性質為DNA分子的定性或定量檢測開辟了新的途徑,也為不同類型、不同堿基含量的DNA的識別和DNA的特定序列識別開拓了新思路,這類配合物也因此成為公認的“明星分子”。自此以后,出現了不少致力于在這兩種配合物的基礎上通過改變或修飾配體來開發新的DNA分子光開關的研究,形成了DPPZ系列的光開關化合物。對原型分子[Ru(bpy)2(dppz)]2+的修飾工作主要通過以下幾種途徑實現:延長dppz配體的共軛體系、在dppz上引入新的取代基、引入電負性強的雜原子如N原子和改變輔助配體。但是該方面的工作卻沒有得到人們期待的更好的DNA分子光開關,由于dppz系列的Ru(II)配合物的DNA光開關性能均不及原型配合物,研究人員逐漸開始從其他體系的Ru(II)配合物著手探索DNA光開關。我們課題組曾報道了一個含有羧基的釕配合物[Ru(phen)2(Hcdpq)]2+[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.],表現出較好的DNA光開關性能,且能從含有小牛胸腺DNA和酵母RNA的溶液中選擇性性磷光傳感DNA。但該配合物與DNA的鍵合能力較弱,檢測DNA的靈敏度較差,限制了其實際應用。本專利通過改變其輔助配體,成功實現了高選擇性、高靈敏度檢測DNA。
技術實現要素:
本發明的目的是公開一個釕配合物的DNA磷光傳感中應用。
本發明的技術方案如下:
本實驗中所用的雙核釕配合物細胞pH傳感器為[(bath)2Ru(Hcdpq)](ClO4)2,配陽離子結構式如下圖所示:
與現有DNA磷光傳感器相比,本發明的傳感器的有益效果在于:在小牛胸腺DNA和酵母RNA共存的溶液中磷光傳感DNA的選擇性性優于明星配合物[Ru(bpy)2(dppz)]2+,其鍵合的選擇性和靈敏度明顯優于[Ru(phen)2(Hcdpq)]2+。
附圖說明
圖1在Tris-HCl緩沖溶液(5mM Tris,pH=7.1,50mM NaCl)中[Ru(DIP)2(Hcdpq)]+(4μM)的紫外-可見光譜隨DNA濃度增加(0-8.5μM)的變化(插圖為隨著DNA濃度增加[DNA]/(εa-εf)的變化及線性擬合)。
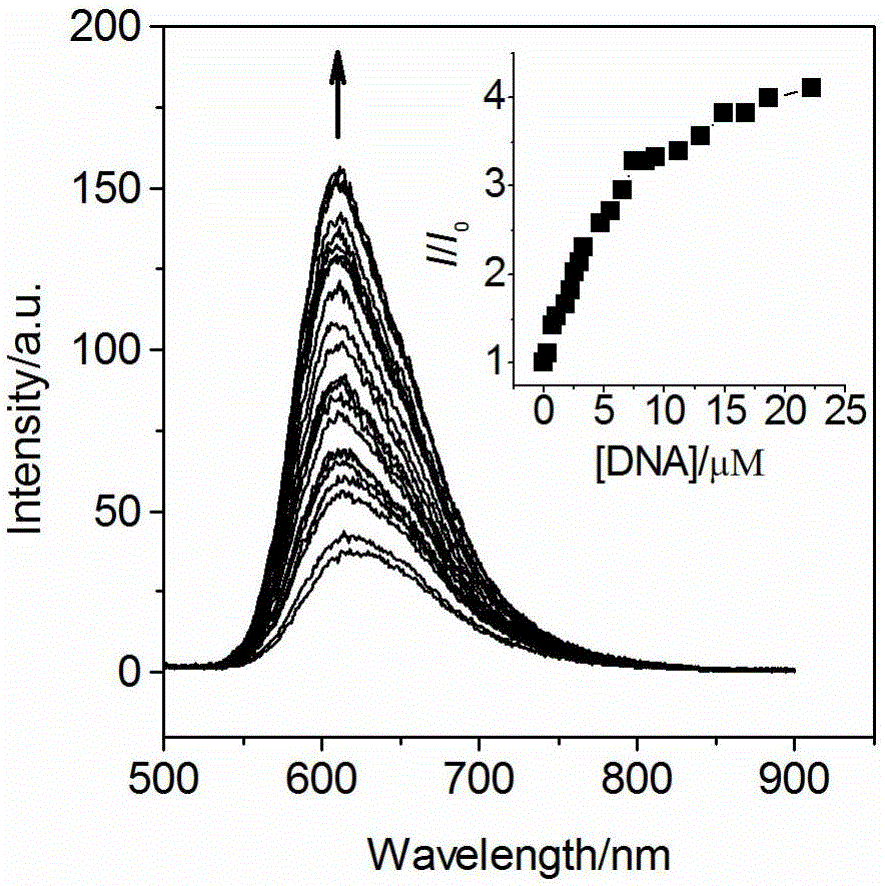
圖2在Tris-HCl緩沖溶液(5mM Tris,pH=7.1,50mM NaCl)中[Ru(DIP)2(Hcdpq)]+(4μM)的發射光譜隨DNA濃度增加(0-22.3μM)的變化(λex=471nm)(插圖為隨著DNA濃度增加I/I0的變化圖)。
圖3(a)[Ru(DIP)2(Hcdpq)]+(4μM)對DNA(0-7.5μM)的熒光響應的工作曲線;圖3(b)[Ru(phen)2(Hcdpq)]+(2.69μM)對DNA(0-86μM)的熒光響應的工作曲線。
圖4隨RNA濃度增加(0-23μM)[Ru(DIP)2(Hcdpq)]+(4μM)在5mM Tris-HCl緩沖溶液(50mM NaCl,pH=7.1)中的熒光光譜變化圖,插圖為I/I0值隨RNA或DNA濃度增大的變化。
圖5[Ru(DIP)2(Hcdpq)](ClO4)2(4μM)在Britton-Robinson緩沖溶液中隨pH變化(0.2-11.6)的熒光光譜圖(λex=457nm)的變化;插圖為615nm處熒光強度隨pH變化的Sigmoidal擬合)。
具體實施方式
實施例1:配合物[Ru(DIP)2(Hcdpq)](ClO4)2的合成
將Ru(DIP)2Cl2(0.0836g,0.1mmol),吡嗪并[2,3-f][1,10]鄰菲咯啉-2-羧酸(0.0295g,0.107mmol)和乙二醇4mL加入25mL圓底燒瓶中,N2保護下在110℃反應10h。反應結束后,冷卻至室溫,得到橙紅色澄清溶液,然后向溶液中加入含0.05M HClO4的飽和NaClO4溶液,得到紅色沉淀,常壓過濾并用0.05M HClO4水溶液洗滌,真空干燥,得粗產品。用乙腈/水/KNO3(體積比0:5:1)的展開劑對粗產品進行硅膠柱色譜分離,接收色譜柱上的紅色熒光帶。然后將接收到的液體旋蒸濃縮,向濃縮液中加入含有0.05M HClO4的飽和NaClO4溶液,有部分白色的鹽析出,過濾將其除去,繼續向濾液中加入含有0.05M HClO4的飽和NaClO4溶液,有紅色沉淀析出,同時也有白色的鹽析出,過濾沉淀,真空干燥,再用盡量少的乙腈溶解產品中的紅色配合物,大部分鹽由于不溶于乙腈被除去,將乙腈溶液旋蒸濃縮,若仍有鹽析出則過濾除去,向除鹽后的溶液中加入含有0.05M HClO4的飽和NaClO4溶液,析出紅色沉淀,于70℃真空干燥后得到產品0.076g(0.061mmol),產率為61%。氫核磁共振譜(400MHz,Me2SO-d6)δ/ppm:9.82(s,1H),9.61(d,J=8.3Hz,2H),8.40(dd,J=7.1,2.7Hz,2H),8.33(t,J=6.3Hz,4H),8.28(s,4H),8.04(m,2H),7.84(d,J=5.5Hz,2H),7.79(dd,J=5.5,1.3Hz,2H),7.66(m,20H)。元素分析[C63H40Cl2N8O2Ru·H2O(F.W.=1259.01)]:計算值:C 60.10;N 8.90;H 3.36%;測量值:C 60.96;N 8.83;H 3.37%。基體輔助激光解吸電離飛行質譜:計算值:m/z521.0563([M-2ClO4]2+);測量值:521.1280([M-2ClO4]2+)。
本發明采用硅膠柱色譜分離技術,提純目標配合物,較文獻[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]報道的[Ru(phen)2(Hcdpq)](ClO4)2的重結晶純化方法,產率(65%)和純度穩定,耗時少。而文獻純化時使用乙腈和二氧六環進行重結晶,產物析出很慢,需要數周的時間,且產物的產率純度難以控制。
實施例2:DNA或RNA鍵合實驗紫外-可見光譜和熒光光譜的測定
將1.3mg[Ru(DIP)2(Hcdpq)](ClO4)2溶于1mL乙腈中配成濃溶液(約1mM),配制500mL5mM Tris-HCl緩沖溶液(pH=7.1,50mM NaCl),再將8.5mg小牛胸腺DNA(ct-DNA)加入10mLTris-HCl緩沖液中,在冰水中超聲半個小時將纏結在一起的DNA打碎,測試前將DNA溶液于4℃冰箱中靜置一夜。配置RNA溶液是取8mg干粉狀的酵母RNA,將其溶于10mLTris-HCl緩沖溶液中,測試前放于4℃冰箱中靜置一夜。測試時取兩個小燒杯,分別記為a和b(a裝待測液,b裝參比液),向兩個燒杯中分別加入10mLTris-HCl緩沖溶液,然后從兩個燒杯中各取3mL溶液分別加入兩個比色皿中,將加入a中溶液的比色皿置于外槽,加入b中的溶液的比色皿置于內槽(整個測試過程中兩個比色皿與燒杯a、b及內、外槽的對應關系始終保持不變),在波長200-700nm范圍內作紫外-可見光譜的基線,然后將比色皿中的溶液分別倒回相應的燒杯中。向燒杯a中加入一定量的配合物的乙腈溶液,為了消除溶劑乙腈的影響,向燒杯b中加入相同體積的乙腈溶液,攪勻后取溶液測定未加DNA時配合物溶液的吸收光譜,為了保證配合物溶液濃度適宜,其光譜中可見光區460nm處的吸收值應在0.1左右。然后測定未加DNA的配合物溶液的熒光發射光譜,先以460nm為激發波長測定發射光譜,再固定發射波長測定激發光譜,如此反復,直至激發波長和發射波長對應不再變化,此時的激發波長即為最佳激發波長。隨后將比色皿中的溶液倒回對應燒杯中,向燒杯a,b中分別逐漸加入等量的DNA溶液,每次加入后攪拌5min,然后測定配合物溶液的紫外-可見光譜和熒光發射光譜,直至光譜不再變化為止。紫外-可見光譜和熒光光譜RNA滴定實驗也是按照與上述同樣的過程進行的。
如圖1所示,DNA的加入引起配合物紫外可見光譜明顯的變化,表明二者具有較強的相互作用。配合物在276nm處的尖銳的吸收峰主要是由配體內和配體間的π→π*躍遷的共同作用引起的,350nm-500nm之間的寬帶吸收則屬于1MLCT躍遷峰,是由電子從中心金屬原子Ru的d軌道向主配體Hcdpq的π*軌道躍遷引起的。當向配合物溶液中逐漸加入DNA后,這兩個吸收峰處的吸光度均明顯減小,但吸收峰位基本不變。當達到鍵合飽和時([DNA]/[Ru]=2.125),276nm和460nm處的減色率H%(H%=(Abound-Afree)/Abound)×100%)分別為57.6%和52%。值得一提的是,[Ru(DIP)2(cdpq)]+與DNA發生相互作用后紫外-可見光譜的減色效應明顯,而同系列的配合物[Ru(bpy)2(cdpq)]+和[Ru(phen)2(cdpq)]+的紫外-可見光譜隨DNA濃度增加均不發生明顯的變化[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]。對比配合物的研究結果表明,表明配合物均可能以溝面鍵合模式與DNA相互作用的。[Ru(DIP)2(cdpq)]+所表現出的明顯的減色效應甚至大于一些以嵌入模式鍵合DNA的配合物。以嵌入方式與DNA作用的配合物,嵌入配體與DNA堿基對之間產生π─π堆積作用,配體的π*軌道和堿基對的π軌道存在偶合作用,偶合后π*軌道還會部分填充電子,使以配體為中心的π→π*躍遷和金屬中心向配體的電荷轉移躍遷(MLCT)的能級差和躍遷幾率都有所減小,容易表現出紫外-可見光譜吸收峰的紅移和減色。但是也有一些以溝面模式或部分嵌入模式與DNA鍵合的配合物表現出明顯的吸收光譜的減色現象,所以[Ru(DIP)2(cdpq)]+的減色效應僅能說明其不是以靜電模式與DNA鍵合,可能以溝面或嵌入模式鍵合DNA。為進一步求得配合物與DNA的鍵合強度,可下式計算配合物與DNA作用的鍵合常數。
上式中,[DNA]表示溶液中加入的DNA的溶度,εa,εf,εb,分別表示滴定過程中每次加入DNA后測定紫外-可見光譜得到的同一波長下的摩爾消光系數(ε=A/(bc)),未與DNA鍵合的Ru(II)配合物的摩爾消光系數,Ru(II)配合物完全與DNA鍵合后的摩爾消光系數,Kb為鍵合常數。如圖1的內插圖所示以[DNA]為橫坐標、[DNA]/(εa-εf)為縱坐標作圖,擬合一條直線,直線的斜率和截距的比值即為鍵合常數Kb。用直線方法擬合得到[Ru(DIP)2(cdpq)]+與DNA的表觀鍵合常數Kb=(2.39±0.20)×105M-1,比[Ru(phen)2(cdpq)]+的DNA鍵合常數都大。
圖2所示為[Ru(DIP)2(cdpq)]+在水溶液中與DNA作用前后的熒光光譜變化。[Ru(DIP)2(cdpq)]+的水溶液在618nm處出現熒光發射峰,該峰是由處于激發態3MLCT的配合物向基態的輻射躍遷產生的。隨著DNA溶液的加入,配合物的熒光發射強度逐漸增加,當[Ru]/[DNA]=5.6時,配合物的熒光增長基本趨于穩定,因此,[Ru(DIP)2(cdpq)]+對DNA有熒光開關響應。圖2中的插圖是熒光強度隨[Ru(DIP)2(cdpq)]+濃度增加的變化,當配合物與DNA達到鍵合飽和時,配合物的熒光強度約是未加DNA時的4倍,發射峰位藍移了7nm。Ru(II)配合物對DNA的熒光增強響應可應用于DNA的定量熒光檢測,由圖3(a)得到[Ru(DIP)2(cdpq)]+對DNA的熒光響應的工作曲線方程為I=43.7996+1.1096×107[DNA],斜率為1.1096×107M-1,根據3σ/K法計算得到[Ru(DIP)2(cdpq)]+對DNA的熒光檢出限為0.6μM。由圖3(b)得到[Ru(phen)2(cdpq)]+對DNA的熒光響應的工作曲線方程為I=5.7624+6.1055×105[DNA],斜率為6.1055×105M-1,根據3σ/K法計算得到[Ru(phen)2(cdpq)]+對DNA的熒光檢出限為1.3μM。可見盡管[Ru(DIP)2(cdpq)]+鍵合DNA后的熒光增強幅度比[Ru(phen)2(cdpq)]+小很多,但其在DNA的定量熒光檢測方面比[Ru(phen)2(cdpq)]+更有優勢,靈敏度更高,這得益于[Ru(DIP)2(cdpq)]+與DNA的鍵合強度大。
圖4所示為[Ru(DIP)2(cdpq)]+的熒光光譜隨RNA濃度增加的變化。熒光光譜RNA滴定的結果與DNA有著很大的不同,配合物溶液的熒光隨著DNA的加入有明顯的增強,但隨著RNA的加入卻無明顯變化,圖5中的插圖將配合物的熒光強度隨DNA或RNA濃度增加的變化進行了對比。可見配合物僅對DNA有熒光開關的響應,表明配合物對DNA和RNA的不同熒光響應可用于DNA和RNA的選擇性識別。而而經典的DNA光開關[Ru(phen)2(dppz)]2+與RNA鍵合后的熒光增強因子可高達16.8。
實施例3:pH滴定實驗
配制Britton-Robinson緩沖溶液(0.04M H3BO3,0.04M H3PO3,0.04M CH3COOH),為保持一定的離子強度,向緩沖溶液中加入NaCl使其濃度為0.1M。向20mLBritton-Robinson緩沖溶液中加入一定量的1mM的[Ru(DIP)2(Hcdpq)](ClO4)2的乙腈溶液,使溶液的吸光度處于測量紫外-可見光譜的合適范圍內。參比溶液根據待測配合物溶液中乙腈和Britton-Robinson溶液的體積比配置。將待測配合物溶液平均分為兩份,一份用封口毛細管點蘸濃硫酸調節pH從2到0.2,另一份用飽和氫氧化鈉溶液調節pH從2-12,調節過程中每隔0.2個pH測定一次溶液的紫外-可見吸收光譜和熒光光譜。
圖5為隨著pH的改變配合物[Ru(DIP)2(Hcdpq)](ClO4)2的熒光光譜圖的變化。當配合物處于pH<2的強酸性溶液環境時,溶液幾乎沒有明顯的發光現象,當溶液的pH>2時,溶液的熒光開始隨著pH的增大出現大幅度的增長,約到pH=6.8時,熒光增長趨于穩定,此后pH的增大不再引起熒光的明顯變化,溶液在熒光增長的過程中沒有出現明顯的發射峰位變化。這種熒光從無到有的變化是配體Hcdpq上的羧基的去質子化過程引起的,同時說明dpq雜環上的氮原子在實驗pH范圍內并沒有發生質子化或去質子化作用。當溶液的熒光增長到幾乎不再變化時,熒光強度約為最初的27倍,可見配合物表現出較好的off-on型pH光開關性能。通過對610nm處熒光強度隨pH變化(見圖5的插圖)進行Sigmoidal曲線擬合,得到[Ru(DIP)2(Hcdpq)](ClO4)2的表觀電離常數pKa=3.12±0.05。由圖5的插圖可知,在pH2.0-5.0間,配合物的發光強度隨pH的增大而線性增大,根據此工作曲線,可測定水溶液的pH,較配合物[Ru(phen)2(Hcdpq)](ClO4)2測定的pH范圍(pH 2.0-4.0)寬和敏感[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]。根據上述工作曲線,測定的調制的小月河水樣中的pH4.55,與pHS3型酸度計測量值4.61吻合很好。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種荔枝多糖鐵配合物的制備方法
- 一種含4,4’-二溴-2,2’-聯吡啶的新型釕配合物的制備方法及其抗腫瘤活性的制作方法
- 一種羰基锝-99m標記的美法侖配合物及其制備方法與用圖
- 一種锝-99m標記的美法侖配合物及其制備方法與用圖
- Ru配合物Ru(bpy)<sub>3</sub>(NH<sub>2</sub>)<sub>2</sub>與石墨烯量子相結合的方法
- 1,4-二甲基-2,5-二-1h-1,2,4-雙三唑二維銅配合物單晶與應用
- 1,4-二甲基-2,5-二-1h-雙三唑均苯四酸鈷配合物單晶與應用
- 一種含雙氮配體低價金屬銠(Ⅰ)的環辛二烯配合物及其制備方法
- 1,4-二甲基-2,5-二-1h-雙三唑三維銅配合物單晶與應用
- 一種2-羰基-3-苯基丙酸苯甲酰腙二(2,4-二氯芐基)錫配合物及其制備方法和應用