G蛋白信號調節因子6及其抑制劑在治療脂肪肝和Ⅱ型糖尿病中的功能和應用的制作方法
本發明屬于基因的功能與應用領域,特別涉及一種G蛋白信號調節因子6(Regulator of G protein signaling 6,RGS6)作為藥物靶標在篩選預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物中應用。
背景技術:
隨著老齡人口的增加,都市化的生活以及生活方式的改變,肥胖、非酒精性脂肪肝病、代謝綜合征和糖尿病等代謝異常人群劇增,現已經成為全球性的公眾健康的重要危害。
糖尿病是由遺傳因素、免疫功能紊亂、微生物感染和精神因素等多種因素引發的機體胰島功能減退、胰島素抵抗,最終導致糖、蛋白質、脂肪、水和電解質等一系列代謝紊亂綜合征。據統計,全球糖尿病患者已超過3億人,其中Ⅱ型糖尿病(type 2diabetes mellitus,T2DM)占90%以上,到2030年,患病人數將超過4億,這意味著在全球20-79歲成年人中將會有7.7%是糖尿病患者。隨著發病人群的擴大,防治難度將會不斷增加。糖尿病慢性并發癥是導致糖尿病患者致死致殘的主要原因,不僅累及心腦血管、腎臟、視網膜、神經等重要臟器和組織,肝臟也是其重要的靶器官之一。
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其他明確的損傷肝因素造成的以肝細胞內脂肪過度沉積為主要特征的臨床病例綜合征,對人群的健康造成巨大的威脅,成為西方國家最常見的肝臟疾病。亞洲國家中NAFLD的發病率也在逐年攀升,在城鎮地區的發生率甚至高達60%。非酒精性脂肪肝進一步發展成為非酒精性脂肪肝炎,約20%的非酒精性脂肪肝炎最終發展為肝硬化甚至肝臟衰竭[1]。
現階段,T2DM合并NAFLD的患病率正逐年增加。研究結果顯示,在糖尿病人群中,NAFLD患病率可高達80%[2]。在有些患者中肝臟脂肪沉積可能是影響其T2DM發展的主要因素[3]。另一方面,如果T2DM控制不佳或充分發展,不僅促進脂肪肝生成,而且使肝損傷加重,甚至形成非酒精性脂肪性肝炎、肝纖維變性、肝硬化及肝細胞癌。T2DM合并NAFLD將大大增加由于肝硬化、肝細胞癌和心血管并發癥導致的死亡風險[4]。目前,雖然控制高脂血癥在T2DM伴NAFLD患者中的治療作用仍有待探究,但是NAFLD的治療主要包括針對糖尿病和心血管風險因子的積極控制。研究表明,在合并T2DM和NAFLD的患者中,只有噻唑烷二酮類藥物吡格列酮顯示出肝臟組織學的明顯改善。因此未來我們應該制定特異的篩選標準以及治療方案以期應用于臨床T2DM和NAFLD患者,尤其是T2DM和NAFLD合并的患者。
RGS6(Regulator of G protein signaling 6)是一種調節G蛋白信號的蛋白,屬于RGS家族中的R7亞家族,能夠調控包括神經系統、心血管系統及淋巴細胞活性在內的多種信號通路[5],RGS6基因位于人的14號染色體上,RGS6蛋白具有GTP酶活性,能夠結合Gα亞單位抑制通過G蛋白偶聯受體依賴的信號通路[6]。研究發現,RGS6蛋白能夠抑制細胞分化和增殖,使細胞從細胞分裂周期暫停,從而產生抑制癌癥的作用,RGS6與膀胱癌的發病風險相關[5],能夠抑制乳腺癌的發生及進展[7],并與胰腺癌的預后相關[8]。另外有研究發現RGS6能夠通過促進Nox酶的活性增加活性氧的產生,加重酒精誘導的心臟病及酒精性脂肪肝的發生發展[9]。
參考文獻
[1]Perry R J,Samuel V T,Petersen K F,et al.The role of hepatic lipids in hepatic insulin resistance and type 2diabetes[J].Nature,2014,510(7503):84-91.
[2]Fan JG,Farrell GC.Epidemiology of non-alcoholic fatty liver disease in china.J Hepatol.2009;50:204-210
[3]Loria P,Lonardo A,Anania F.Liver and diabetes.A vicious circle.Hepatol Res.2013;43:51-64
[4]Cusi K.Treatment of patients with type 2diabetes and non-alcoholic fatty liver disease:Current approaches and future directions.Diabetologia.2016;59:1112-1120
[5]Berman D M,Wang Y,Liu Z,et al.A functional polymorphism in RGS6modulates the risk of bladder cancer[J].Cancer Res,2004,64(18):6820-6826.
[6]Seki N,Hattori A,Hayashi A,et al.The human regulator of G-protein signaling protein 6gene(RGS6)maps between markers WI-5202and D14S277on chromosome 14q24.3[J].J Hum Genet,1999,44(2):138-140.
[7]Maity B,Stewart A,O'Malley Y,et al.Regulator of G protein signaling 6is a novel suppressor of breast tumor initiation and progression[J].Carcinogenesis,2013,34(8):1747-1755.
[8]Jiang N,Xue R,Bu F,et al.Decreased RGS6expression is associated with poor prognosis in pancreatic cancer patients[J].International Journal of Clinical&;Experiment...,2014.
[9]Stewart A,Maity B,Anderegg S P,et al.Regulator of G protein signaling 6is a critical mediator of both reward-related behavioral and pathological responses to alcohol[J].Proceedings of the National Academy of Sciences,2015,112(7):E786-E795.
技術實現要素:
為解決上述現有技術的缺陷和不足,本發明的目的在于提供一種RGS6基因的表達與脂肪肝、Ⅱ型糖尿病之間的相互關系,提供一種RGS6作為藥物靶標在篩選預防、緩解和/或治療脂肪肝、Ⅱ型糖尿病的藥物中的應用,進而提供一種RGS6的抑制劑在制備預防、緩解和/或治療脂肪肝、Ⅱ型糖尿病的藥物中的應用。
本發明的目的通過以下技術方案實現
本發明以野生型C57小鼠與RGS6基因敲除小鼠為實驗對象,通過高脂飲食誘導的肥胖小鼠模型(diet induced obesity,DIO)研究RGS6基因的功能,結果發現與野生型WT小鼠對比,RGS6基因敲除小鼠表現出體重減輕,其體重明顯低于同種飼料飼養的WT小鼠,并且RGS6基因敲除小鼠的空腹血糖水平低于對照組WT小鼠,RGS6基因敲除小鼠的肝功能明顯優于WT小鼠。進一步通過腹腔注射葡萄糖耐量實驗發現RGS6基因敲除小鼠對葡萄糖的耐受能力明顯改善。從小鼠肝臟大體外觀,肝臟重量及肝臟/體重比以及肝功能相關酶活性測定結果等均說明HFD組(High fat diet,高脂飲食)RGS6-KO小鼠脂肪肝病變明顯減輕,脂質蓄積顯著減少。這表明RGS6基因敲除會緩解脂肪肝、Ⅱ型糖尿病的發生,RGS6基因能夠促進脂肪肝、Ⅱ型糖尿病的發生。
因此,RGS6基因可作為藥物靶點,構建RGS6基因過表達的體外細胞模型或動物模型,用于篩選預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物;RGS6基因也可作為基因治療中的靶基因,設計并制備預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物和/或生物學試劑,通過基因工程技術達到預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的目的。例如以RGS6為靶基因,設計可干擾RGS6表達的雙鏈siRNA,通過化學方法合成以后,注射入人體通過RNA干擾的方法使XX基因沉默來治療脂肪肝和/或Ⅱ型糖尿病;還可以設計并構建RGS6的突變體,注射后進入細胞,競爭RGS6原形的作用底物,從而抑制RGS6的功能,起到治療目的;此外,還可以以RGS6為靶點設計小分子化合物抑制劑,利用RGS6基因過表達的體外細胞模型或動物模型,通過篩選,發現其中能夠特異性抑制RGS6的分子,從而為脂肪肝和/或Ⅱ型糖尿病的治療提供新的治療性分子。
針對RGS6的上述功能,提供RGS6作為藥物靶標在篩選保護肝臟及糖代謝的藥物中的應用。
針對RGS6的上述功能,提供RGS6作為藥物靶標在篩選預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物中的應用。
針對RGS6的上述功能,提供RGS6的抑制劑在制備預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物中的應用。
一種預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物,包含RGS6的抑制劑。
所述的RGS6的抑制劑優選為RGS6基因的siRNA、RGS6基因的RNA干擾載體,RGS6的抗體及其他能夠抑制RGS6表達的抑制劑。
本發明相對于現有技術具有如下的優點及效果:
(1)本發明發現RGS6的新功能,即RGS6具有惡化脂肪肝和Ⅱ型糖尿病的作用。
(2)基于RGS6在惡化脂肪肝和Ⅱ型糖尿病疾病中的功能,其為研制預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物提供靶標。
(3)RGS6的抑制劑可用于制備預防、緩解和/或治療脂肪肝和/或Ⅱ型糖尿病的藥物。
附圖說明
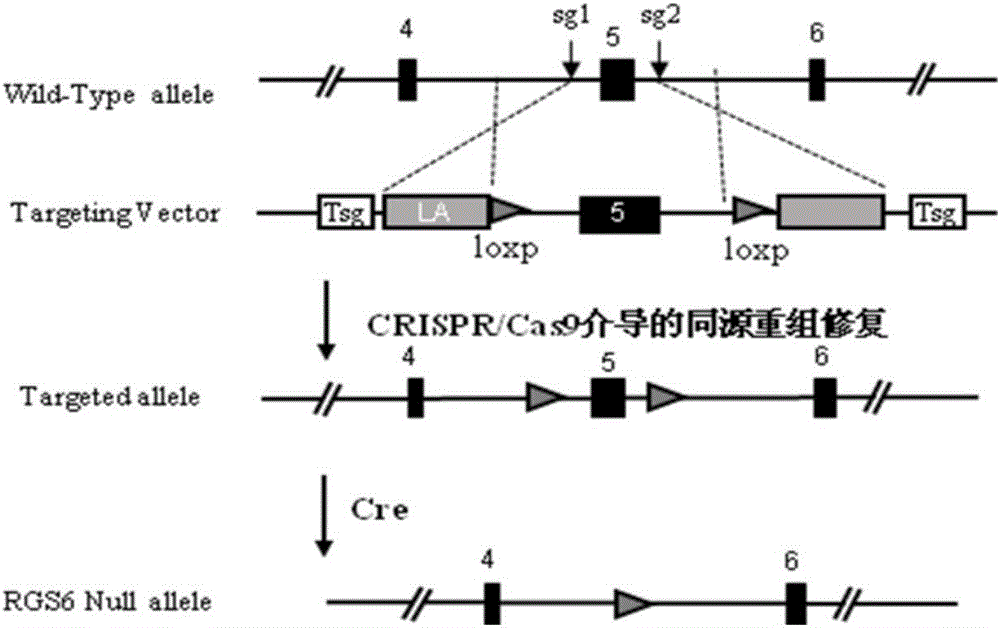
圖1是構建RGS6條件性敲除小鼠的打靶策略圖。
圖2是WT和RGS6-KO小鼠的體重、空腹血糖結果圖;
A為小鼠體重結果圖,B為空腹血糖水平統計圖(*:p<0.05vs WT NC組,**:p<0.01vs WT NC組,#:p<0.05vs WT HFD組,##:p<0.01vs WT HFD組)。
圖3是WT和RGS6-KO小鼠通過腹腔注射葡萄糖耐量結果圖;
A為通過腹腔注射葡萄糖后不同時間點小鼠血糖水平統計圖,B為各組小鼠糖耐量曲線下面積(area under the curve,AUC)比較圖(**:p<0.01vs WT NC組,##:p<0.01vs WT HFD組)。
圖4是RGS6-KO和WT小鼠的肝臟重量結果圖;
A為肝臟重量統計柱狀圖,B為肝臟重量與小鼠本身體重比值統計柱狀圖(##:p<0.01vs WT HFD組)。
圖5是WT和RGS6-KO小鼠的肝功測量結果圖;
分別采取AST、ALT和ALP對小鼠肝功進行檢測。(##:p<0.01vs WT HFD組)。
具體實施方式
通過以下詳細說明結合附圖可以進一步理解本發明的特點和優點。所提供的實施例僅是對本發明方法的說明,而不以任何方式限制本發明揭示的其余內容。
實驗用動物及飼養:
實驗動物種屬,性別,周齡及來源:C57BL/6小鼠(WT)和RGS6肝臟特異性基因敲除(RGS6-KO)小鼠,雄性,8周齡。C57BL/6小鼠購自北京華阜康生物科技有限公司,RGS6肝臟特異性基因敲除小鼠(RGS6-KO)由RGS6-floxed小鼠與受蛋白啟動子控制、肝細胞特異性表達的Cre轉基因小鼠Albumin-Cre(購自The Jackson Laboratory,貨號003574)雜交得到。
肝臟特異性RGS6基因敲除小鼠的構建:
根據基因信息,利用CRISPR Design(網址:http://crispr.mit.edu/)分別在內含子4和5中各設計一個CRISPR的打靶位點。靶序列分別為:
RGS6-sRNA 1:GGTCACAGCATCATGCTGTAGGCGA TGG
RGS6-sRNA 2:ggAGTGGACACCACCCGTCTTACAA AGG
此外還設計了一個用于同源修復的供體質粒(Donor Vector),它包括兩側同源臂、中間的外顯子5、以及兩個同向的loxp序列,構建策略見圖1。
①打靶載體的構建:分別將sgRNA1和sgRNA2對應的兩條引物融合成雙鏈DNA,然后用T4DNA連接酶連入經過限制性內切酶BsaI處理過的pUC57-sgRNA載體中。該載體上游有一個T7啟動子,可以用于后續的體外轉錄實驗。
②供體載體(Donor Vector)的構建:根據引物設計原則,設計如下引物(表1)用于擴增供體載體的左右同源臂(LA和RA)以及中間的外顯子部分(M)。擴增得到的產物經表1中所示限制性內切酶酶切后得到3個片段,將其分別連入條件性敲除骨架載體pBluescript SK(+)-2loxp中,得到Donor Vector。
表1構建供體載體所需引物序列及對應酶切位點
③打靶載體的轉錄:對CRIPR/Cas9系統包含的兩個部分(負責切割作用的Cas9蛋白和引導Cas9蛋白定位到靶位點的gRNA)分別進行轉錄。對于Cas9蛋白,將其表達載體(pST1374-Cas9)用PmeI進行酶切,以純化后回收線性化質粒為轉錄模板,用T7mMESSAGE mMACHINE試劑盒(AM1345,Ambion)進行體外轉錄,獲得加帽的mRNA產物。并用Poly(A)Tailing試劑盒(Ambion)對上述產物加尾,獲得成熟的mRNA產物;對于sgRNA,使用MEGAshortscriptTMKit(AM1354,Ambion公司)進行體外轉錄。將轉錄得到的Cas9和sgRNA的mRNA使用miRNeasy Micro Kit(Qiagen,217084)進行純化。
④RGS6-floxed條件性敲除小鼠的制作
將上述成熟的mRNA產物與供體質粒一同注入小鼠受精卵中,移植到代孕母鼠體內進行培育。得到的小鼠進行鑒定。取出生一周后的小鼠腳趾或尾部組織,提取基因組,并通過PCR方法篩選陽性首建鼠。從確定發生同源重組的小鼠中隨機挑選一只作為F0代進行后續的繁殖,最終獲得RGS6-floxed純合小鼠。
⑤肝臟特異性RGS6基因敲除小鼠的制作
將上述RGS6-floxed小鼠與肝臟特異性Albumin-Cre轉基因小鼠交配,篩選得到RGS6floxed/floxed/Albumin-Cre小鼠,待該小鼠長至6周齡左右后,腹腔注射Tamoxifen,誘導Cre酶的表達,Cre酶特異性的識別兩個同向的loxp,并切除兩者之間的序列及其中的一個loxp,最后得到肝臟細胞特異性RGS6基因敲除小鼠。
實驗動物飼料配方:高脂飼料(HFD)(購自北京華阜康生物科技有限公司,貨號D12942):熱量百分比:蛋白質:20%;碳水化合物:20%;脂肪:60%,總的熱量質量比:5.24kcal/g。低脂飼料(NC)(購自北京華阜康生物科技有限公司,貨號D12450B):熱量百分比:蛋白質:20%;碳水化合物:70%;脂肪:10%,總的熱量質量比:3.85kcal/g。
飼養環境及條件:SPF級實驗動物中心,室溫在22-24℃之間,濕度在40-70%之間,明暗交替照明時間為12h,自由飲水攝食。
【實施例1】小鼠脂肪肝、Ⅱ型糖尿病模型(diet induced obesity,DIO)獲得
(1)實驗動物分組:選用8周齡,雄性,WT小鼠和RGS6-KO小鼠,分別給與兩種特殊飼料D12942高脂飼料(High fat diet,HFD)和D12450B低脂飼料(Normal chow,NC)飼養,即WT NC組,KO NC組,WT HFD組,KO HFD組共4個組別。
(2)模型通過高脂飼料誘導操作流程:
采用WT和KO小鼠,建立DIO模型,進行表型相關分析,明確RGS6基因對脂肪肝、Ⅱ型糖尿病發揮的作用。選用8周齡,雄性,WT小鼠和RGS6-KO小鼠,分別給與兩種特殊飼料D12942高脂飼料(Highfat diet,HFD)和D12450B低脂飼料(Normal chow,NC)飼養,即WT NC組,KO NC組,WT HFD組,KO HFD組共4個組別。每周均詳細記錄小鼠攝食量,小鼠空腹體重和空腹血糖每隔4周檢測1次。實驗第14周,進行腹腔注射葡萄糖實驗(IPGTT),以評價小鼠機體對葡萄糖耐受能力。第16周終末取材。
【實施例2】小鼠體重、血糖水平測定
(1)小鼠空腹體重,食量檢測
1)體重檢測。
①禁食:上午8:00將待實驗小鼠禁食(不禁水),下午2:00開始實驗操作。
②稱重:分別在第0周、4周、8周、12周稱重,將一塑料小桶放在動態電子天平上,抓起小鼠,放入稱量小桶中,測量體重記錄數據。飼料量檢測:待稱體重操作完成后,給小鼠加飼料,并在動態電子天平上記錄小鼠的飼料量。
(2)空腹血糖水平檢測實驗
將所有待實驗的小鼠從上午8:00至下午2:00間禁食(不禁水),即禁食6小時后開始實驗操作。
①血糖儀準備:檢查血糖儀(美國強生公司,ONETOUCH)電池,按右側開關,將試紙正確放入左側插槽,屏幕顯示與血糖試紙條相應代碼的數字,隨后顯示滴血圖案,提示血糖儀進入待測狀態。
②固定小鼠:右手抓鼠尾,左手持一塊毛巾,將毛巾對折,用拇指和食指捏住毛巾對折處,將鼠頭部和身體包入手掌內的毛巾,拇指和食指在將鼠尾根部固定。
③剪尾:眼科剪迅速在距鼠尾末端0.1-0.2cm處剪下鼠尾,待血滴自行流出。
④血糖檢測:將血糖儀試紙邊緣輕觸血滴,血液浸入試紙,血糖儀倒計時5秒顯示讀數。
Ⅱ型糖尿病損傷嚴重程度的評估指標主要包括體重、血糖等水平,體重、血糖變化結果如圖1所示,給與RGS6-KO小鼠12周的HFD飼料和NC飼料飼養后,從第2周開始HFD組的RGS6-KO小鼠體重明顯低于HFD組的WT小鼠體重,一直持續到第12周(見圖2A);經空腹血糖檢測發現在HFD組的小鼠從第4周的空腹血糖水平明顯較相應NC對照組升高,HFD組的RGS6-KO小鼠空腹血糖水平也明顯低于WT組小鼠空腹血糖水平(見圖2B)。表明RGS6基因敲除后顯著影響了小鼠在HFD飼養狀態下的糖代謝穩態,RGS6基因能顯著降低小鼠的糖代謝能力,表明RGS6基因在高脂誘導引起的Ⅱ型糖尿病中起到重要作用。
【實施例3】葡萄糖耐量實驗(intraperitoneal glucose tolerance test,IPGTT)
實驗第12周,進行腹腔注射葡萄糖實驗(IPGTT),以評價小鼠機體對糖耐受能力。
(1)在測血糖之前,先測量小鼠的空腹體重,根據10μL/g計算葡萄糖的注射體積。
(2)先檢測葡糖糖注射前即0分鐘時空腹血糖,在檢測完畢后迅速經腹腔注射葡萄糖液。
(3)腹腔注射操作方法:①固定小鼠;抓起小鼠,左手的小指和無名指抓小鼠的尾巴,另三手指抓住小鼠的頸部,使小鼠的頭部向下,將小鼠腹部充分暴露。②進針定位及注射:從腹部一側進針右手持注射器,將尖端與小鼠腹部成45°的夾角,進針,回抽,注射時針頭在腹部皮下穿行一小段距離,穿過腹中線后在腹部另一側進入腹腔,注射完藥物后,緩緩拔出針頭,并輕微旋轉針頭,防止漏液。
(4)分別于腹腔注射后15分、30分、60分、120分鐘時間點剪尾測小鼠血糖值,并記錄血糖數值和檢測時間。
進一步通過腹腔注射葡萄糖耐量實驗(intraperitoneal glucose tolerancetests,IPGTT)來評估各組小鼠對葡萄糖的處理能力,在實驗第12周,通過注射1.0g/kg體重的葡萄糖后,HFD組的WT小鼠和RGS6-KO小鼠血糖水平在15分鐘時間點劇增達到峰值,隨著時間推移至注射后30分鐘,KO組小鼠血糖水平稍微下降,60分鐘后WT組小鼠血糖水平開始下降,但二者仍處于高于空腹血糖水平(0分鐘時血糖),在2小時時恢復至空腹血糖水平,且RGS6-KO小鼠血糖水平從0分鐘至2小時一直處于低于WT小鼠的血糖水平(圖3A)。比較各組小鼠血糖曲線下面積(area under the curve,AUC),發現WT小鼠HFD組的AUC顯著高于NC組,RGS6-KO HFD組的AUC顯著小于WT HFD組的AUC(圖3B),表明RGS6對維持糖代謝穩態具有強大的調控能力。
【實施例4】肝臟大體外觀及肝臟組織脂質成分測定
(1)終末肝臟組織取材
1)小鼠稱重后,迅速脫頸處死。仰臥固定小鼠,用蒸餾水將小鼠胸部,腹部毛發潤濕。
2)用一鑷子鉗夾小鼠腹部正中皮膚,沿腹部正中向頭部剪開皮膚至劍突下,向尾端剪開皮膚,逐層暴露皮下筋膜,肌肉等,打開腹腔,充分暴露各臟器。
3)迅速找到并取下小鼠的肝臟,將取下的肝臟標本置于滅菌紗布上,拭干肝臟表面上殘留血液,將肝臟置于無菌培養皿中,迅速拍照,稱重。
(2)肝功能測定
1)開啟電腦labman軟件,打印機,再開啟生化分析儀;
2)選擇并清洗檢測探針、比色杯等,保證探針通暢、比色杯無雜質附著,吸光值在設定的參考范圍;
3)將待檢測的血清標本從-80℃冰箱中找出;將待檢測的血清在室溫下復融至液態,準備檢測;
4)在labman軟件上檢查所需檢測指標試劑是否足夠,設定檢測指標和檢測順序等;
5)加入待檢血清樣品50μl,開始檢測;
6)待檢測完畢后記錄檢測數值。
肝臟重量及肝臟重量與小鼠體重比值結果見圖4所示,在HFD組的RGS6-KO小鼠無論肝臟重量還是肝臟重量與小鼠本身體重比值均較HFD組的WT小鼠低(如圖4)。進一步肝功能檢測表明,HFD組小鼠肝功明顯較NC組差,而RGS6-KO小鼠的三種肝酶(AST(谷草轉氨酶)、ASLT(谷丙轉氨酶)、ALP(堿性磷酸酶))均較HFD組的WT小鼠更低(如圖5)。這些結果說明RGS6基因敲除小鼠的脂肪肝明顯好轉。
上述結果顯示RGS6-KO小鼠在HFD的誘導下發生的Ⅱ型糖尿病和脂肪肝病變顯著減輕。這些結果表明RGS6基因對加重Ⅱ型糖尿病和脂肪肝具有顯著的作用。本發明結果說明RGS6基因在脂肪肝、Ⅱ型糖尿病疾病模型中有著重要的促進作用。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
SEQUENCE LISTING
<110> 武漢大學
<120> G蛋白信號調節因子6及其抑制劑在治療脂肪肝和Ⅱ型糖尿病中的功能和應用
<160> 8
<170> PatentIn version 3.3
<210> 1
<211> 28
<212> DNA
<213> RGS6-sRNA1
<400> 1
ggtcacagca tcatgctgta ggcgatgg 28
<210> 2
<211> 28
<212> DNA
<213> RGS6-sRNA2
<400> 2
ggagtggaca ccacccgtct tacaaagg 28
<210> 3
<211> 50
<212> DNA
<213> RGS6 LA-F
<400> 3
tcgagtgccc accatgagca gagggagtca tcatcggtgc catcggacgt 50
<210> 4
<211> 42
<212> DNA
<213> RGS6 LA-R
<400> 4
ccgatggcac cgatgatgac tccctctgct catggtgggc ac 42
<210> 5
<211> 30
<212> DNA
<213> RGS6 M-F
<400> 5
ccggaattcc ctacagcatg atgctgtgac 30
<210> 6
<211> 28
<212> DNA
<213> RGS6 M-R
<400> 6
cgggatccta agacgggtgg tgtccact 28
<210> 7
<211> 47
<212> DNA
<213> RGS6 RA-F
<400> 7
cgcgtcaaag gagagctggg gcactcagag aatggcctcg gctttgc 47
<210> 8
<211> 47
<212> DNA
<213> RGS6 RA-R
<400> 8
ggccgcaaag ccgaggccat tctctgagtg ccccagctct cctttga 47
- 還沒有人留言評論。精彩留言會獲得點贊!
- 腎外髓質鉀通道的抑制劑的制作方法與工藝
- 一種抑制植物細胞組織在培養中褐化的方法與流程
- 干擾素調節因子5及其抑制劑在腦卒中疾病中的應用的制作方法與工藝
- 干擾素調節因子6(IRF6)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 人喉組織中水通道的表達定位方法與流程
- 補體因子H抑制劑及與之相關的用途的制作方法與工藝
- 干擾素調節因子5(IRF5)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 作為因子XIA抑制劑的環狀P1連接體的制作方法與工藝
- 作為補體因子B抑制劑用于治療眼科疾病的2?(1H?吲哚?4?基甲基)?3H?咪唑并[4,5?B]吡啶?6?甲腈衍生物的制作方法與工藝
- 能夠結合組織因子途徑抑制劑(1?161)上的兩個表位的抗體的制作方法與工藝
- 干擾素調節因子5(IRF5)及其抑制劑在治療心肌肥厚中的應用的制作方法與工藝
- 作為因子XIA抑制劑的環狀P1連接體的制作方法與工藝
- 能夠結合組織因子途徑抑制劑(1?161)上的兩個表位的抗體的制作方法與工藝
- 針對組織因子途徑抑制劑(TFPI)的優化的單克隆抗體的制作方法與工藝
- 一種作為自分泌運動因子抑制劑的咔唑類化合物及其制備方法和應用與流程
- 外周血單核細胞活化抑制劑在制備治療急性肝衰竭的藥物中的用途的制造方法與工藝
- 對NEDD8活化酶(NAE)抑制劑的反應的生物標記的制造方法與工藝
- 一種肺癌調節因子SRSF5及其抑制劑與應用的制造方法與工藝
- 自分泌運動因子抑制劑的制造方法與工藝
- 一種BCL?2抑制劑Venetoclax的合成方法與流程
- 一種制備自噬小體型瘤苗的培養基添加劑及其制備方法與制造工藝
- N-萘烷基取代的含氮雜環衍生物、制備方法及其抗腫瘤用途與制造工藝
- 作為BET蛋白抑制劑的1H?吡咯并[2,3?c]吡啶?7(6H)?酮和吡唑并[3,4?c]吡啶?7(6H)?酮的制造方法與工藝
- 一種人腫瘤抑制蛋白變體及其應用的制造方法與工藝
- 一種人腫瘤抑制蛋白變體及其應用的制造方法與工藝
- G蛋白信號調節因子6及其抑制劑在治療脂肪肝和Ⅱ型糖尿病中的功能和應用的制造方法與工藝
- 蛋白酶體抑制劑在制備降低動物脂含量或脂儲積能力產品中的應用的制造方法與工藝
- GINS2基因或蛋白的抑制劑在制備抗腫瘤藥物中的應用的制造方法與工藝
- ZNF383蛋白在制備抑制p53蛋白活性的產品中的應用的制造方法與工藝
- 蛋白酶體抑制劑MLN9708的合成方法與制造工藝