N15多肽在制備細菌抑制劑中的用途的制作方法
本發明涉及生物技術領域,具體指N15多肽在制備細菌抑制劑中的用途。
背景技術:
人體中存在著很多種類的細菌,其中有些是有益菌,有益菌對維持人體微生環境有著重要的作用,還有些細菌則是致病菌,能引起人類疾病。細菌在人體內寄生,增殖并引起疾病的特性稱為細菌的致病性或病原性(pathogenicity)。病原菌的致病作用與其毒力、侵入機體的數量、侵入途徑及機體的免疫狀態密切相關。例如,大腸桿菌寄居于腸道內,它的單獨致病力不大,若和其他致病菌在一起時,可造成嚴重的混合感染,常見的致病菌還有金黃色葡萄球菌、沙門氏菌等。
藍藻之所以又稱藍細菌,是因為藍藻是最原始、最古老的藻類.其結構簡單,無典型的細胞核,所以又稱藍細菌,屬于原核生物。已知藍藻約2000種,中國已有記錄的約900種。藍藻有極大的適應性,分布很廣。在一些營養豐富的水體中,有些藍藻常于夏季大量繁殖,并在水面形成一層藍綠色而有腥臭味的浮沫,稱為“水華”,大規模的藍藻爆發,被稱為“綠潮”(和海洋發生的赤潮對應)。綠潮引起水質惡化,嚴重時耗盡水中氧氣而造成魚類的死亡。
技術實現要素:
本發明的目的在于提供一種多肽,該多肽能夠抑制多種致病菌和藍藻生長,具有制備細菌抑制劑的用途,它已被現有技術公開,名為N15多肽。
N15多肽是一個具有15個氨基酸的短肽,其序列為甲硫氨酸-脯氨酸-酪氨酸-絲氨酸-蘇氨酸-谷氨酸-亮氨酸-異亮氨酸-苯丙氨酸-酪氨酸-異亮氨酸-谷氨酸-甲硫氨酸-天門冬氨酸-脯氨酸,它具有多種生物學功能,包括調節NF-κB轉錄因子結合目的基因的能力,影響NF-κB目的基因產物蛋白質的轉錄和表達;阻斷PCNA結合DNA聚合酶,從而阻止細胞DNA合成抑制細胞增殖;抑制上皮細胞增生,調節表皮增生及分化,使皮膚角化過程正常化等。
發明人發現在研究中發現N15可以對多種革蘭氏陰性菌、革蘭氏陽性菌、藍細菌的生長產生抑制作用。經試驗檢測,N15多肽抑制藍藻增殖可能是通過抑制DNA復制和異形胞分化基因的表達,起到抑制藍藻增殖的。
本發明還提供了一種N15多肽制備的抗細菌藥物,為N15多肽的水溶液,濃度大于等于100μg/mL。
本發明的有益效果:N15多肽是一種結構清晰,易于工業化生產的多肽,它可以抑制大腸桿菌、金黃色葡萄球菌、沙門氏菌、魚腥藍細菌等多種細菌的增殖,效果好且無毒副作用。
附圖說明
圖1為N15對大腸桿菌的抑菌曲線。
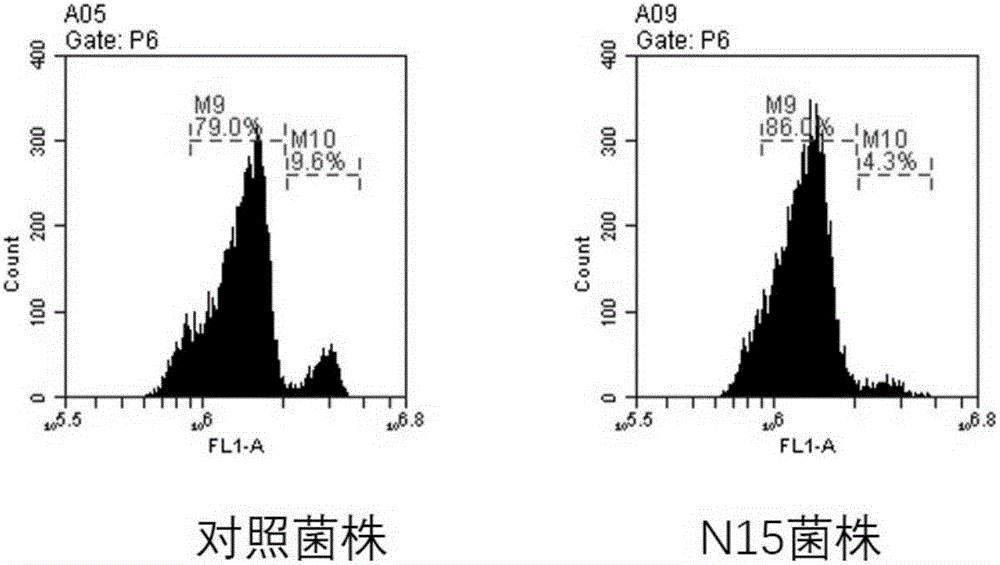
圖2為流式細胞儀檢測N15對金黃色葡萄球菌DNA含量的影響。
圖3為N15對魚腥藍細菌PCC 7120的抑菌曲線。
圖4為缺氮誘導48小時對照組和N15實驗組魚腥藍細菌PCC7120異形胞的分化情況。
圖5為熒光定量RT-PCR檢測N15對藍藻hetR基因mRNA表達量的影響。
圖6為熒光定量RT-PCR檢測N15對藍藻ntcA基因mRNA表達量的影響。
具體實施方式
下面結合附圖和具體實驗例對本發明作進一步的論證說明,以下實驗例僅是對本發明的解釋而本發明并不局限于以下實驗例。
實驗例1:N15抑制了大腸桿菌的生長
實驗方法:
在液體培養基中,微生物隨著培養時間的增加而不斷增加,逐漸使培養基混濁,這一變化,可以用分光光度計測定,并可根據不同的時間里測定的數值而做出該種微生物的生長曲線。
以LB液體培養基作為空白,在分光光度計上調零點。從0時開始,添加N15至終濃度為500μg/mL,每隔2h測定液體LB培養液的OD600(波長600nm處的吸光度),同時設置不添加N15的菌株作為對照。以時間為橫坐標,以OD值為縱坐標,制作曲線,即為N15多肽對大腸桿菌的抑菌曲線,結果如圖1所示。
實驗結果表明,加入N15多肽至終濃度為500μg/mL的大腸桿菌的生長和不加入N15的對照菌株比較,受N15多肽抑制大腸桿菌的生長較為緩慢,加入N15對大腸桿菌的生長具有抑制作用。
實驗例2:N15對金黃色葡萄球菌的生長具有抑制作用
實驗方法:
取金黃色葡萄球菌菌株接種到牛肉膏蛋白胨培養基斜面上,37℃下活化培養,用接種環從斜面上挑菌到無菌水中制成菌懸液,接種培養無菌操作下,用取液器吸取100μL體積的菌液到滅菌小離心管中,充分混勻后,迅速注入到滅菌平皿中,在平板中加入N15多肽,以同體積的無菌水的混合液注入作空白,置于37℃恒溫培養箱中培養48小時,觀察菌落生長情況,并對菌落計數,結果見表1。
表1.N15對金黃色葡萄球菌生長抑制結果對照表
結果顯示,和對照相比,加入N15多肽的平板上金黃色葡萄球菌的菌落數明顯減少,N15對金黃色葡萄球菌的生長具有抑制效應。
實驗例3:N15對金黃色葡萄球菌的DNA復制具有抑制效應
實驗方法:
制備YEPD液體培養基,培養金黃色葡萄球菌,并加入N15到YEPD液體培養基中,同時設置不加N15多肽的金黃色葡萄球菌作為對照(control),加入N15多肽(終濃度500μg/mL),在處理2小時分別取樣2mL金黃色葡萄球菌菌體,加入Sytox-Green染料對金黃色葡萄球菌細胞DNA染色后,使用流式細胞儀進行金黃色葡萄球菌的DNA相對含量進行測定,結果見圖2。
如實驗結果所示,橫坐標表示單個金黃色葡萄球菌細胞內DNA的含量,縱坐標表示酵母細胞數量。在N15處理2小時內,N15處理細胞內的DNA含量和對照細胞相比沒有顯著性差異,而隨著時間的增加,在N15處理15小時以后,N15處理細胞內的DNA含量和對照細胞相比明顯減少。該結果表明N15會引起金黃色葡萄球菌細胞DNA含量的減少。
實驗例4:N15對沙門氏菌的生長具有抑制作用
實驗方法:
取沙門氏菌菌株接種到牛肉膏蛋白胨培養基斜面上,37℃下活化培養,用接種環從斜面上挑菌到無菌水中制成菌懸液,接種培養無菌操作下,用取液器吸取100μL體積的菌液到滅菌小離心管中,充分混勻后,迅速注入到滅菌平皿中,在平板中加入N15多肽,以同體積的無菌水的混合液注入作空白,置于37℃恒溫培養箱中培養48小時,觀察菌落生長情況,并對菌落計數,結果見表2。
表2.N15對沙門氏菌生長抑制結果對照表
結果顯示,和對照相比,加入N15多肽的平板上沙門氏菌的菌落數明顯減少,N15對沙門氏菌的生長具有抑制效應。
實驗例5:N15抑制了魚腥藍細菌的生長
實驗方法:
將魚腥藍細菌PCC 7120在液體BG11培養基中培養至OD750(波長750nm處的吸光度)在0.3~0.4左右,添加N15至終濃度為100μg/mL,同時設置不添加N15的菌株作為對照。每隔24小時用分光光度計測定菌液的OD750,連續測定8天后根據數據繪制N15的抑菌曲線,結果如圖3所示。
實驗結果表明,加入N15多肽至終濃度為100μg/mL的魚腥藍細菌PCC 7120的生長和不加入N15的對照菌株比較,受N15多肽抑制魚腥藍細菌的生長較為緩慢,加入N15對魚腥藍細菌PCC 7120的生長具有抑制作用。
實驗例6:N15推遲了魚腥藍細菌的異形胞分化時間
實驗方法:
魚腥藍細菌PCC 7120是一種絲狀細菌,其菌絲體能進行光合作用。在環境中缺乏氮源的條件下,會分化出具有固氮功能的異形胞。為了觀察N15處理對異形胞發育的影響,本研究中在對魚腥藍細菌進行缺氮處理的同時,加入100ug/mL的N15,同時設置不加入N15的對照組,誘導后進行顯微鏡觀察。
實驗結果:
魚腥藍細菌PCC 7120的營養細胞在形成異形胞的過程中,產氧的光系統II復合物在異形胞中失活,因此在熒光顯微鏡下,只有營養細胞能夠發紅色熒光,而異形胞沒有熒光。在進行缺氮誘導的同時加入100μg/mL的N15,分別在24小時、48小時候、72小時、96小時進行顯微鏡觀察,結果顯示對照組的魚腥藍細菌在缺氮誘導24小時就有異形胞的產生,而加入N15的魚腥藍細菌直到96小時以后才有異形胞生成,缺氮誘導48小時的照片如圖4所示,加入N15的魚腥藍細菌PCC 7120沒有異形胞產生,菌絲體的所有細胞在熒光顯微鏡下都發紅色熒光,而對照組菌絲有異形胞產生,這些異形胞在熒光顯微鏡下也沒有紅色熒光。由此我們得知,N15推遲了魚腥藍細菌PCC7120的異形胞發育生成的時間。
實驗例7:N15抑制了異形胞分化基因的表達
實驗方法:
為了觀察N15處理對異形胞發育的影響,本研究中在對魚腥藍細菌進行缺氮處理的同時,加入100μg/mL的N15,同時設置不加入N15的對照組,分別提取0hour、6hour、12hour、24hour的對照組和實驗組,每個樣品收集50mL菌體,提取RNA,并且用DNasel去除殘余的基因組DNA。利用紫外分光光度計對總RNA定量后,使用TakaRa公司的反轉錄試劑盒反轉錄RNA合成cDNA。具體操作步驟參見產品說明書。用TakaRa公司的試劑盒PrimeScriptTM RT Reagent Kit(Perfect Real Time)進行實時熒光定量反轉錄PCR。具體操作參見產品說明書。分析軟件使用ROCHE LightCycler480進行分析,定量方法為相對定量法。
實驗結果:
異形胞在發育過程中需要在許多基因的參與,其中hetR和ntcA基因是異形胞發育的關鍵基因,與異形胞發育的多個后期基因的轉錄激活依賴于hetR和ntcA。我們通過實時熒光定量反轉錄PCR實驗檢測了N15對這幾個異形胞分化相關基因表達的影響,實驗結果如圖5和6所示。
和對照組相比,N15加入6hour、12hour、24hour后,較明顯的抑制了魚腥藍細菌中hetR和ntcA基因的表達,由此我們得知N15對藍藻生長的抑制是通過抑制藍細菌中異形胞分化相關基因的表達來實現的。
N15多肽的抑菌效果可作用于革蘭氏陰性菌、革蘭氏陽性菌、藍細菌,上述實施例僅為對細菌抑制劑的舉例,挑選了較有代表性的細菌,無法將所有細菌種類的抑制實驗例一一列出,不因此限制本發明的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!