一種聚集誘導發光抗菌多肽探針及制備與應用的制作方法
本發明涉及一種聚集誘導發光抗菌多肽探針的制備方法及其在殺菌方面的應用,尤其涉及通過熒光信號變化監測抗菌多肽與細菌的結合方式及結合動力學過程方面的用途。
背景技術:
由外傷或疾病引起的骨缺損或骨缺失在臨床上十分常見。傳統的臨床治療主要是通過自體骨移植或植入生物相容性好的植入體材料。但是,盡管在手術前對患者進行抗生素預防和材料無菌處理,在植入手術初期因細菌感染引發的植入體失效率仍然較高。據臨床統計,細菌感染導致的植入體實效比例約為4%-6%,如此高的比例已經在國際上引起廣泛的關注。植入體細菌感染后果十分嚴重,這些細菌會直接導致周圍組織壞死,甚至使病人殘疾或死亡。
為預防植入體細菌感染,當前最常使用的方法為無機離子抗菌和抗生素抗菌。無機離子多為重金屬離子,在隨植入體進入體內之后無法正常排出體外;抗生素由于其廣泛的使用,使得細菌產生耐藥性,嚴重影響了其抗菌性能。抗菌多肽是最新研究出的一種氨基酸抗生素,由12~50個氨基酸殘基組成,具有強堿性、熱穩定性以及廣譜抗菌性等特點。抗菌多肽具有優異的抗菌性能,可以快速殺死細菌;并且由于其為氨基酸形成的肽鏈,可以迅速成為潛在的治療藥物。抗菌多肽的治療范圍為:革蘭氏陰性細菌、革蘭氏陽性細菌、真菌、寄生蟲和腫瘤細胞等。
當前對抗菌多肽的作用方式的研究方法主要包括掃描電鏡(sem)、投射電鏡(tem)、原子力顯微鏡(afm)、大型單層囊泡模擬(guv)、熒光成像等。相對于sem、afm和tem成像技術,熒光成像具有成本低、易于操作及可以直接觀察等優點。現有的熒光成像主要是采用熒光素等小分子有機染料,但是傳統的小分子有機染料的熒光具有聚集誘導猝滅的缺陷,在高密度染色細菌時,其熒光會發生明顯的自我猝滅,同時,其光穩定性差,難以實時監測抗菌多肽與細菌的結合過程及殺菌方式。
近年來,聚集誘導發光(aie)材料作為新一代熒光材料,在生物醫學領域日益獲得廣泛應用。聚集誘導發光材料具有強抗光漂白能力、高發光效率、大的斯托克位移和低毒性等優點。由于分子內運動受限,aie材料在聚集態具有高發光效率。由于aie材料可以通過化學反應接枝到抗菌多肽上,可通過其特有的聚集誘導發光特性,實現對細菌的高信噪比熒光成像,有效揭示抗菌多肽與細菌結合的動力學過程及殺菌方式,且具有光穩定性好的優勢,適于長期實時監測抗菌多肽對細菌的殺滅過程。
技術實現要素:
本發明的目的在于提供一種具有聚集誘導發光(aie)性質的熒光抗菌多肽探針以研究抗菌多肽的殺菌作用原理及過程。本發明的抗菌多肽探針抗菌活性高、聚集態發光效率高,通過熒光強度變化可以實時觀測抗菌多肽對大腸桿菌作用過程。
本發明的另一目的在于提供上述聚集誘導發光抗菌多肽探針的制備方法。
本發明的再一目的在于提供上述聚集誘導發光抗菌多肽探針的應用。
本發明的目的是通過下列技術方案實現的:
一種聚集誘導發光抗菌多肽探針,由聚集誘導發光化合物與抗菌多肽連接而成;所述聚集誘導發光化合物的通式為式(i):
其中,x選自n、s、o雜原子;r1、r2相同或不同,且分別獨立地選自氫、鹵素、取代或未被取代的芳基、取代或未被取代的雜芳基、烴基、取代或未被取代的芳氧基(如:c6h5-o-)、取代或未被取代的烷氧基(如:ch3-o-)、取代或未被取代的芳硫基、取代或未被取代的烷硫基。
所述芳基是指具有6-20個碳原子的單環或多環芳族基團,所述芳基優選為苯基、萘基、1,2,3,4-四氫萘基、蒽基、芘基或菲基。
所述雜芳基是指具有1-20個碳原子、1-4個選自n、s、o雜原子的單環或多環雜芳族基團;且當碳原子的個數為1時,雜原子的個數≥2;當雜原子的個數為1時,碳原子的個數≥2。
所述雜芳基優選為吡咯基、吡啶基、嘧啶基、咪唑基、噻唑基、吲哚基、氮雜萘基、氮雜蒽基、氮雜芘基等。
所述烴基為直鏈或支鏈烷基、直鏈或支鏈烯烴基、直鏈或支鏈炔基;優選為甲基、乙基、丙基、丁基、異丁基、叔丁基、烯丙基、炔丙基。
r(y)選自以下任意一種:被官能團y取代的芳基,其結構為-ar-y;被官能團y取代的雜芳基,其結構為-雜芳基-y;含有官能團y的烷基,其結構為-r-y,r為亞烷基;被官能團y取代的芳氧基,其結構為-o-ar-y;含有官能團y的烷氧基,其結構為-o-r-y,r為亞烷基;被官能團y取代的芳硫基,其結構為-s-ar-y;含有官能團y的烷硫基,其結構為-s-r-y,r為亞烷基;鹵素;
官能團y選自:-n3、-nh2、-cooh、-ncs、-sh、炔基(-c≡ch)、-cho、-oh、鹵素、n-羥基丁二酰亞胺酯基團、馬來酰亞胺基團、酰肼基團、含有硝酮基的基團。
所述n-羥基丁二酰亞胺酯基團的結構為
所述抗菌多肽與聚集誘導發光化合物中的r(y)反應。
所述抗菌多肽為krwwkwwrr、krwwkwwrrc、llgdffrkskekigkefkrivqrikdflrnlvprtes、gigkflhsakkfgkafvgeimns、trssraglqfpvgrvhrllrk中一種以上。
進一步優選,所述聚集誘導發光抗菌多肽探針中,聚集誘導發光化合物的式(i)中r1、r2分別為氫;所述r(y)為-och2cooh。
所述多肽優選為krwwkwwrr。
所述抗菌多肽探針優選為以下結構式的化合物:
所述聚集誘導發光抗菌多肽探針的制備方法,包括以下步驟:
在溶劑、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽和n-羥基硫代琥珀酰亞胺的體系中,將聚集誘導發光化合物和抗菌多肽進行反應,分離,干燥,得到聚集誘導發光抗菌多肽探針。
所述溶劑為水或具有水溶性的有機溶劑;所述有機溶劑為二甲基亞砜、乙醇、甘油,優選為二甲基亞砜。
所述反應為酰胺反應時,需在堿的環境下進行,所述堿為二異丙基乙基胺。
所述1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽和n-羥基硫代琥珀酰亞胺的摩爾比為1:1~1:2,聚集誘導發光化合物和抗菌多肽的摩爾比為1:1~5:1,1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽和n-羥基硫代琥珀酰亞胺的總用量與聚集誘導發光化合物的摩爾比為(5:1~10:1);
所述反應時間為1~15h;所述分離為通過高效液相色譜進行分離,洗脫液優選含1%體積三氟乙酸的乙腈和1%體積三氟乙酸的水組成的洗脫液進行梯度洗脫。
所述干燥為冷凍干燥。
所述聚集誘導發光抗菌多肽探針在實時監測抗菌多肽殺滅細菌的結合方式和動力學過程的用途。
本發明所述的聚集誘導發光抗菌多肽探針是通過聚集誘導發光(aie)實現實時監測抗菌多肽結合及殺滅細菌的過程。
在本發明的上下文中,術語“聚集誘導發光”或“aie”是指熒光化合物在稀溶液中幾乎不發光,但在聚集態或固態發出強熒光的現象。
本發明的上下文中,術語“抗菌多肽”是指一種帶有正電荷并呈現出疏水性、由4-50個氨基酸組成的新型抗菌劑。它對于革蘭氏陽性菌和革蘭氏陰性菌均具有優異的抗菌效果。
與現有技術相比,本發明具有以下優點及有益效果:
(1)本發明的探針抗菌活性高,短時間內即可殺死細菌,且不易產生耐藥性;
(2)本發明的抗菌多肽探針聚集態發光效率高,克服了傳統染料高密度染色時熒光自我淬滅的問題;
(3)本發明的aie化合物的制備容易,易于修飾,聚集態發光效率高,且在水溶液中發光微弱,對細菌成像的信噪比高;
(4)本發明的制備方法簡單,易于實現。
附圖說明
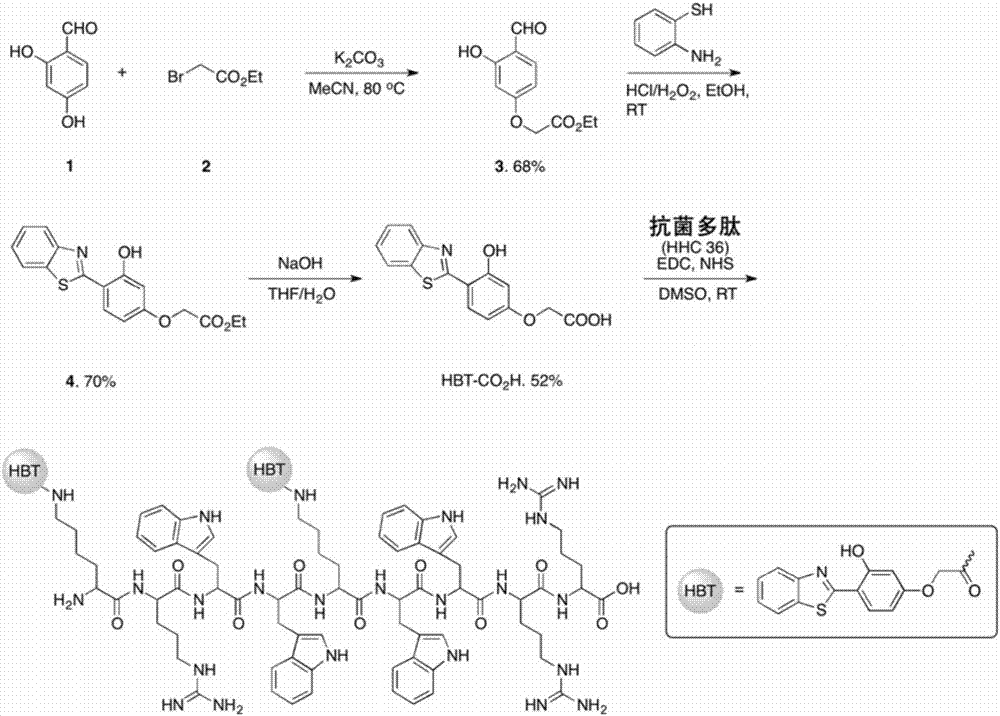
圖1為抗菌多肽探針amp-2hbt的制備流程圖;
圖2為抗菌多肽探針amp-2hbt的質譜圖;
圖3為抗菌多肽探針amp-2hbt的hplc圖;
圖4中(a)為抗菌多肽探針amp-2hbt在四氫呋喃中的紫外吸收光譜圖;(b)為抗菌多肽探針amp-2hbt在thf溶液條件和薄膜條件下的uv-pl光譜;圖b中內插圖為amp-2hbt在溶液條件和薄膜條件下的光學照片;
圖5中(a)-(d)為不同時間條件下抗菌多肽探針amp-2hbt作用于大腸桿菌之后的熒光強度變化圖;(e)-(h)不同時間條件下hbt-cooh作用于大腸桿菌之后的熒光強度變化圖;其中hbt-cooh作為對照組;(a)、(e)為15min,(b)、(f)為30min,(c)、(g)為45min,(d)、(h)為60min;
圖6為抗菌多肽探針amp-2hbt作用于大腸桿菌,不同時間下的細菌熒光比例曲線圖;其中的熒光比例是指熒光強度高于檢測限的細菌數量占設定總細菌量的百分比,圖中縱坐標為細菌數量,橫坐標為熒光強度的log值,其中高于101的均為高于檢測限的細菌;
圖7為抗菌多肽探針amp-2hbt作用于大腸桿菌后,大腸桿菌的熒光照片;a、b為不同部位的大腸桿菌的熒光照片;
圖8中(a)為與amp-2hbt探針作用前的大腸桿菌的透射電鏡圖片;(b)為與amp-2hbt探針作用后的大腸桿菌的透射電鏡圖片;(c)為與amp-2hbt探針作用前的大腸桿菌的掃描電鏡圖片;(d)為與amp-2hbt探針作用后的大腸桿菌的掃描電鏡圖片;
圖9為hhc36抗菌肽(amp)與amp-2hbt探針在不同濃度下的殺菌效率對比圖。
具體實施方式
下面結合實施例和附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
aie熒光分子hbt-cooh的合成:
(1)化合物3合成:將690mg(5mmol)2,4-二羥基苯甲醛(化合物1)與830mg(5mmol)2-溴乙酸乙酯(化合物2)加入到反應瓶中,然后加入1.38g(10mmol)k2co3、30ml乙腈,80℃回流反應過夜,待反應結束,萃取除去體系中的無機鹽,然后旋干,使用硅膠柱進行分離,產率68%(762mg);
(2)化合物4合成:將224mg(1mmol)化合物3與150mg(1.2mmol)2-氨基苯硫酚溶解到15ml乙醇中,之后,逐滴加入100mg(37wt.%,1mmol)的濃鹽酸,攪拌10min,然后將113mg(30wt.%,1mmol)雙氧水滴加到混合溶液中,并在室溫繼續攪拌2h,反應完全后,將溶液旋干,殘留物質通過乙醇重結晶即可得到化合物4,產率70%(230mg);
(3)化合物hbt-cooh合成:將165mg(0.5mmol)化合物4溶解于5mlthf溶液中,同時將40mg(1mmol)naoh溶解于2ml水中,然后將thf溶液加入到naoh溶液中,將混合溶液加熱回流3h,將反應溶液冷卻到室溫后,通過抽真空方法排除體系中的有機溶劑,然后加入5ml水,逐滴滴加1m的hcl(aq),使得產物沉淀出來,將產物濾出,分別用水、乙酸乙酯清洗,然后旋干,得到化合物hbt-cooh,產率52%(78mg)。
hbt-cooh結構式為:
實施例1
(1)將1-(3-二甲氨基丙基)-3-乙基碳二亞胺(11.5mg,0.06mmol)、n-羥基琥珀酰亞胺(6.9mg,0.06mmol)、aie熒光分子hbt-cooh(6mg,0.02mmol)溶解在1ml二甲基亞砜中,在氮氣條件下室溫攪拌4小時;然后加入二異丙基乙基胺(1.3mg,0.01mmol)和抗菌多肽hhc36(生產廠家為上海吉爾生化有限公司)(7.4mg,0.005mmol),再次在氮氣條件下室溫攪拌12小時;反應之后,將混合溶液通過0.2μm的過濾頭過濾,然后利用液相色譜儀進行分離純化,其中分離溶劑a為含有體積分數為0.1%三氟乙酸的hplc級別水,分離溶劑b為含有體積分數為0.1%三氟乙酸的hplc級別乙腈;冷凍干燥(-50℃),得到amp-2hbt抗菌多肽探針(即聚集誘導發光抗菌多肽探針),產率36%(3.9mg)。本實施例中amp-2hbt抗菌多肽探針的制備流程圖如圖1所示;質譜圖如圖2所示;hplc圖如圖3所示。
本實施例制備的amp-2hbt抗菌多肽探針在四氫呋喃中的紫外吸收光譜圖如圖4a所示,薄膜條件下的uv-pl光譜如圖4b所示,圖4b中內插圖為amp-2hbt在溶液條件和薄膜條件下的光學照片。
本實施例制備的amp-2hbt抗菌多肽探針薄膜態的熒光量子產率為20.0%,本實施例制備的amp-2hbt抗菌多肽探針分子量為2052.88,高效液相色譜分離結果說明所合成的抗菌多肽探針的出峰時間為19.3-19.7min,監測波長為350nm。
抗菌測試:
(1)抗菌效果測試:將不同體積的實施例1制備的抗菌多肽探針與大腸桿菌溶液混合,抗菌多肽探針的最終濃度為0,20,50和100μm,大腸桿菌的最終濃度為107cfuml-1。將混合溶液置于霉菌搖床中37℃下避光輕搖2小時,然后將菌液進行梯度稀釋,并涂附于瓊脂板上培養。14小時后取出,讀取不同抗菌多肽探針條件下瓊脂板表面的細菌菌落數量。其中采用未修飾aie分子的amp作為陽性對照,同樣測試不同濃度下,抗菌多肽對大腸桿菌的抗菌效果,測試結果如圖9所示,圖9為hhc36抗菌肽(amp)與amp-2hbt探針在不同濃度下的殺菌效率對比圖。最終濃度為20μm的抗菌多肽探針與大腸桿菌作用前后的表征圖如圖8所示,其中(a)為與amp-2hbt探針作用前的大腸桿菌的透射電鏡圖片;(b)為與amp-2hbt探針作用后的大腸桿菌的透射電鏡圖片;(c)為與amp-2hbt探針作用前的大腸桿菌的掃描電鏡圖片;(d)為與amp-2hbt探針作用后的大腸桿菌的掃描電鏡圖片。從圖8和9可知,抗菌多肽修飾了aie分子之后,依然保持了其原有的抗菌性能,隨著其濃度的增加,抗菌效果越好。
(2)基于抗菌多肽探針優異的抗菌效果,選擇對于不同的時間(15,30,45,60min)下細菌的熒光強度以及抗菌多肽探針的作用效率進行評估:
熒光探針amp-2hbt(20μm)與hbt-cooh(20μm)分別加入到相同數量(107cfuml-1)的大腸桿菌(廣東省微生物研究所,atcc8739)中,避光培養到設定的時間(15,30,45,60min)時,通過倒置熒光顯微鏡對熒光強度進行分析。不同時間下(培養時間),抗菌多肽探針amp-2hbt作用于大腸桿菌之后的熒光強度變化圖如圖5所示(圖中(a)-(d)為不同時間條件下抗菌多肽探針amp-2hbt作用于大腸桿菌之后的熒光強度變化圖;(e)-(h)為不同時間條件下hbt-cooh作用于大腸桿菌之后的熒光強度變化圖;其中hbt-cooh作為對照組;(a)、(e)為15min,(b)、(f)為30min,(c)、(g)為45min,(d)、(h)為60min)。實驗組amp-2hbt在不同的時間下均有熒光,對照組hbt-cooh在不同的時間下均沒有熒光,同時,隨著時間的延長,細菌表面的熒光強度也逐漸的增加。該結論說明熒光探針可以快速作用于細菌表面,隨著時間延長,探針在細菌表面的聚集程度加深,熒光強度加強。同時,隨著聚集程度的加深,探針在細菌膜上形成的孔洞越大,細菌內容物流出,最終導致細菌的死亡。
通過流式細胞儀(統計50000個細菌)對抗菌多肽探針的作用效率進行評估:將20μm的熒光探針amp-2hbt加入到大腸桿菌中,避光培養到設定的時間,然后測定熒光含量高于空白組(未加入熒光探針amp-2hbt)的細菌占整體計數細菌的比例,測試結果如圖6所示。圖6為抗菌多肽探針amp-2hbt作用于大腸桿菌,不同時間下的細菌熒光比例曲線圖;其中的熒光比例是指熒光強度高于檢測限的細菌數量占設定總細菌量的百分比,圖中縱坐標為細菌數量,橫坐標為熒光強度的log值,其中高于101的均為高于檢測限的細菌。在設定的0,15,30,45和60min條件下,熒光強度高于空白組的細菌比例分別為14.02%,40.85%,64.96%和84.99%。該結果表明,抗菌多肽熒光探針隨著時間的延長,熒光信號增加,可被流式細胞儀識別的含熒光的細菌比例增加。
(3)為了進一步研究抗菌多肽探針在細菌上的分布位置,選擇使用超級顯微鏡來觀察微觀形貌下抗菌多肽探針的聚集狀態:
抗菌多肽探針amp-2hbt作用于大腸桿菌后,大腸桿菌的熒光照片如圖7所示;其中a、b為不同位置的大腸桿菌的熒光照片。在超級顯微鏡觀察下,抗菌多肽探針在細菌表面呈現出點狀分布。該結果表明,抗菌多肽在殺死細菌的時候,會先在細菌膜上聚集形成孔洞,使得細菌內容物流出,最終導致細菌凋亡。
最后所應當說明的是,以上實施例僅用于說明本發明的技術方案而非對本發明保護范圍的限制,盡管參照較佳實施例對本發明作了詳細說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的實質和范圍。
sequencelisting
<110>華南理工大學
<120>一種聚集誘導發光抗菌多肽探針及制備與應用
<130>1
<160>5
<170>patentinversion3.5
<210>1
<211>9
<212>prt
<213>artificialsequence
<220>
<223>1
<400>1
lysargtrptrplystrptrpargarg
15
<210>2
<211>10
<212>prt
<213>artificialsequence
<220>
<223>2
<400>2
lysargtrptrplystrptrpargargcys
1510
<210>3
<211>37
<212>prt
<213>artificialsequence
<220>
<223>3
<400>3
leuleuglyaspphephearglysserlysglulysileglylysglu
151015
phelysargilevalglnargilelysasppheleuargasnleuval
202530
proargthrgluser
35
<210>4
<211>23
<212>prt
<213>artificialsequence
<220>
<223>4
<400>4
glyileglylyspheleuhisseralalyslyspheglylysalaphe
151015
valglygluilemetasnser
20
<210>5
<211>21
<212>prt
<213>artificialsequence
<220>
<223>5
<400>5
thrargserserargalaglyleuglnpheprovalglyargvalhis
151015
argleuleuarglys
20
- 還沒有人留言評論。精彩留言會獲得點贊!