KRASG12C抑制劑給藥方案的制作方法
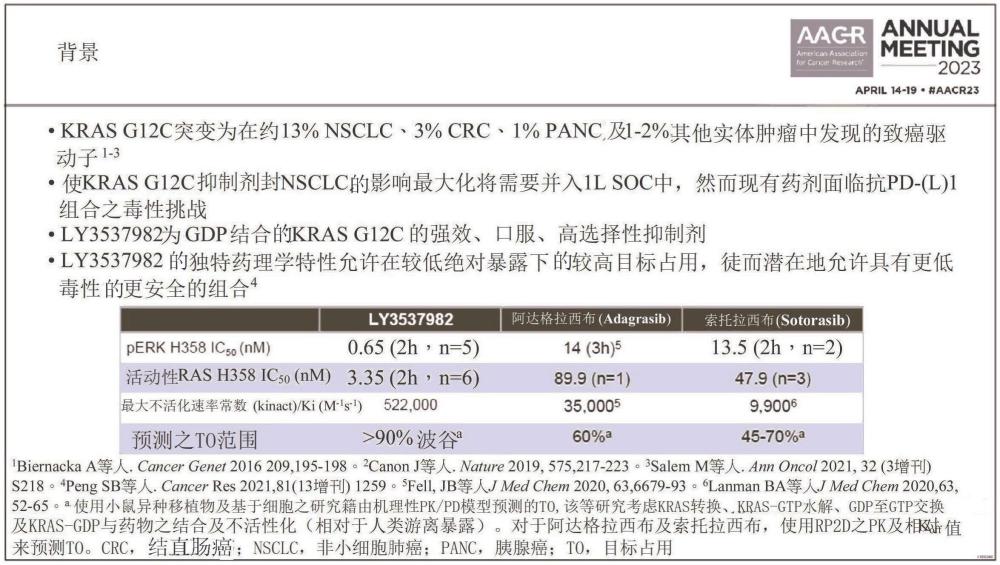
背景技術:
1、已經在約30%的人類癌癥中發現了致癌kras突變,并且已證明這些突變會激活多個下游信號通路。盡管kras突變普遍存在,但它一直是一個困難的治療目標。
2、wo?2021/118877和us2021/0179633?a1各自公開了可用作kras?g12c抑制劑的化合物或其鹽。值得關注的kras?g12c抑制劑的例子是4-[(13as)-10-氯-8-氟-6-氧代-2-丙-2-烯酰基-1,3,4,12,13,13a-六氫吡嗪并[2,1-d][1,5]苯并氧雜氮雜環辛四烯(benzoxazocin)-9-基]-2-氨基-7-氟-苯并噻吩-3-甲腈,其具有以下結構:
3、
4、該化合物在wo?2021/118877和us2021/0179633?a1中各自作為實施例35被公開。如其中所公開的,該化合物作為阻轉異構體存在。此外,如這些參考文獻的制備167和168所討論的,阻轉異構體可使用硅膠快速柱色譜法分離。制備167進一步指出,當用0-30%丙酮/己烷洗脫時,所需的非對映異構體是第二個從硅膠快速柱上洗脫下來的非對映異構體。
5、該第二非對映異構體對應于m阻轉異構體。該化合物的名稱為4-[(13as)-10-氯-8-氟-6-氧代-2-丙-2-烯酰基-1,3,4,12,13,13a-六氫吡嗪并[2,1-d][1,5]苯并氧雜氮雜環辛四烯-9-基]-2-氨基-7-氟-苯并噻吩-3-甲腈,m阻轉異構體(下文為“式i”),其具有以下結構:
6、
7、式i化合物目前正在進行臨床試驗(clinicaltrials.gov標識符:nct04956640),以評估其在治療患有可通過抑制kras?g12c治療的癌癥患者中的效用。
8、開發使用式i化合物,無論是作為單一療法、與一種或多種其它治療劑組合、或是作為新輔助、輔助、晚期或轉移療法的一部分來治療癌癥的新治療方案和實驗計劃(protocol)將是有用的。開發比當前治療方案和實驗計劃更耐受的治療方案和實驗計劃將是有用的。開發比當前治療方案和實驗計劃毒性更低的治療方案和實驗計劃將是有用的。
技術實現思路
1、本文公開了式i化合物或其藥學上可接受的鹽治療可通過抑制kras?g12c治療的癌癥的方法和用途。
2、在一個方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量在約50mg和約200mg之間的式i化合物:
3、
4、或其藥學上可接受的鹽。
5、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽。
6、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽。
7、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽。
8、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期nsclc。
9、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期nsclc。
10、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期crc。
11、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期crc。
12、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型胰腺癌。
13、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型胰腺癌。
14、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約100mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型胰腺癌。
15、在再一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向需要此類治療的患者施用劑量約50mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型胰腺癌。
16、在又一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括
17、向需要此類治療的患者施用第一劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,或其藥學上可接受的鹽;
18、監測患者的劑量限制毒性(dlt);以及
19、如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
20、在又一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括
21、向需要此類治療的患者施用第一劑量約150mg的式i化合物或其藥學上可接受的鹽;
22、監測患者的dlt;以及
23、如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
24、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,與第二治療劑的一種或多種同時、分開或依次組合。在一個實施方案中,第二治療劑選自由以下組成的組:pd-1抑制劑或其藥學上可接受的鹽、pd-l1抑制劑或其藥學上可接受的鹽、cdk4/cdk6抑制劑或其藥學上可接受的鹽、egfr抑制劑或其藥學上可接受的鹽、erk抑制劑或其藥學上可接受的鹽、鉑劑或其藥學上可接受的鹽、抗葉酸劑或其藥學上可接受的鹽、aurora?a抑制劑或其藥學上可接受的鹽、以及shp2抑制劑或其藥學上可接受的鹽的一種或多種。
25、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽。
26、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽。
27、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽。
28、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗(pembrolizumab)同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
29、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
30、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
31、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
32、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞(pemetrexed)和順鉑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
33、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
34、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
35、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
36、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
37、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
38、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
39、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
40、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
41、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
42、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
43、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。
44、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與阿貝西利同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
45、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
46、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
47、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
48、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
49、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
50、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
51、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
52、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc或crc。
53、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
54、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
55、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
56、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
57、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
58、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與temuterkib同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
59、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
60、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
61、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
62、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
63、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc或crc。
64、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
65、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
66、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
67、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
68、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
69、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與tno155同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
70、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與西妥昔單抗(cetuximab)同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
71、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
72、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
73、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
74、在另一方面,本文公開了式i化合物:
75、或其藥學上可接受的鹽,其用于治療kras?g12c突變型癌癥,其中式i化合物或其藥學上可接受的鹽以約50mg和約200mg之間的劑量施用。
76、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,其中所述化合物以約150mg的劑量施用。
77、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,其中式i化合物或其藥學上可接受的鹽以約100mg的劑量施用。
78、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽。
79、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽。
80、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽。
81、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽。
82、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
83、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
84、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前krasg12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
85、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前krasg12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
86、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
87、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
88、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
89、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
90、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
91、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
92、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
93、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
94、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
95、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
96、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
97、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
98、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中式i化合物或其藥學上可接受的鹽以約50mg和約200mg之間的劑量施用。
99、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中式i化合物或其藥學上可接受的鹽以約150mg的劑量施用。
100、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中式i化合物或其藥學上可接受的鹽以約100mg的劑量施用。
101、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中
102、式i化合物或其藥學上可接受的鹽以選自由約50mg、約100mg、約150mg和約200mg組成的組的第一劑量施用;
103、監測患者的dlt;以及
104、如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
105、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中
106、式i化合物或其藥學上可接受的鹽以約150mg的第一劑量給藥;
107、監測患者的dlt;以及
108、如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
109、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中
110、式i化合物或其藥學上可接受的鹽以約100mg的第一劑量給藥;
111、監測患者的dlt;以及
112、如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
113、在再一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中向有需要的患者施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期nsclc。
114、在再一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途:
115、
116、其用于治療kras?g12c突變型癌癥的藥物制造,其中向有需要的患者施用劑量約150mg的式i化合物或其藥學上可接受的鹽,其中所述kras?g12c突變型癌癥是kras?g12c突變型晚期nsclc。
117、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,其中所述化合物以選自由約50mg、約100mg、約150mg和約200mg組成的組的第一劑量施用;監測患者的dlt;如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。
118、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽,其用于治療krasg12c突變型癌癥中,其中式i化合物或其藥學上可接受的鹽以約150mg的第一劑量施用;監測患者的dlt;如果患者表現出dlt,則施用第二劑量的式i化合物或其藥學上可接受的鹽,其中第二劑量與第一劑量相比有所減少。在一個實施方案中,kras?g12c突變型癌癥選自由以下組成的組:kras?g12c突變型晚期nsclc、kras?g12c突變型肺癌、kras?g12c突變型結直腸癌、kras?g12c突變型胰腺癌、kras?g12c突變型膀胱癌、kras?g12c突變型宮頸癌、krasg12c突變型子宮內膜癌、kras?g12c突變型卵巢癌、kras?g12c突變型膽管癌和kras?g12c突變型食管癌。在另一個實施方案中,kras?g12c突變型癌癥選自由以下組成的組:kras?g12c突變型非小細胞肺癌、kras?g12c突變型胰腺癌或kras?g12c突變型結直腸癌。在另一個實施方案中,kras?g12c突變型癌癥為kras?g12c突變型非小細胞肺癌。在另一個實施方案中,kras?g12c突變型癌癥為kras?g12c突變型胰腺癌。在另一個實施方案中,kras?g12c突變型癌癥為kras?g12c突變型結直腸癌。
119、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽。
120、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽。
121、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽。
122、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與第二治療劑同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽。
123、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
124、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經krasg12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
125、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經krasg12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
126、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,有需要的患者是首次經krasg12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
127、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與阿貝西利同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
128、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
129、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
130、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與阿貝西利同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
131、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
132、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
133、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
134、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
135、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
136、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
137、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
138、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
139、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
140、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前krasg12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
141、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
142、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療krasg12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
143、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在一個實施方案中,培美曲塞和順鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用順鉑至多四個周期。在另一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
144、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在又一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在一個實施方案中,培美曲塞和順鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用順鉑至多四個周期。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
145、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和順鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,順鉑每三周一次給藥(或施用)75mg/m2。在一個實施方案中,培美曲塞和順鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用順鉑至多四個周期。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
146、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用卡鉑至多四個周期。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前krasg12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
147、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用卡鉑至多四個周期。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前krasg12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
148、在另一方面,本文公開了一種治療kras?g12c突變型癌癥的方法,其包括向有需要的患者與帕博利珠單抗、培美曲塞和卡鉑同時、分開或依次組合施用劑量為50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期非鱗狀nsclc。在一個實施方案中,帕博利珠單抗每三周一次給藥(或施用)200mg。在另一個實施方案中,培美曲塞每三周一次給藥(或施用)500mg/m2。在又一個實施方案中,卡鉑每三周一次給藥(或施用)曲線下面積(auc)5mg/ml/分鐘,最大劑量為750mg。在一個實施方案中,培美曲塞和卡鉑在同一天施用。在一個實施方案中,施用帕博利珠單抗至多三十五個周期。在一個實施方案中,施用卡鉑至多四個周期。在又一個實施方案中,有需要的患者是首次經kras?g12ci、pd-1或pd-l1療法治療。在另一個實施方案中,有需要的患者已接受至少一種治療,其包括先前kras?g12c抑制劑。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至100%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為0%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,kras?g12c突變型晚期nsclc的腫瘤比例評分(tps)狀態為1%至49%。在又一個實施方案中,有需要的患者的腫瘤比例評分(tps)狀態大于或等于50%。在又一個實施方案中,krasg12c突變型晚期nsclc的腫瘤比例評分(tps)狀態大于或等于50%。
149、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
150、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
151、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
152、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與厄洛替尼同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
153、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc或crc。
154、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
155、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
156、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
157、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
158、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
159、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與temuterkib同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
160、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
161、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
162、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
163、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與(2r,4r)-1-[(3-氯-2-氟-苯基)甲基]-4-[[3-氟-6-[(5-甲基-1h-吡唑-3-基)氨基]-2-吡啶基]甲基]-2-甲基-哌啶-4-甲酸:2-甲基丙-2-胺(1:1)鹽同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
164、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc或crc。
165、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
166、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
167、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期nsclc。
168、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
169、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
170、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與tno155同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
171、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量在約50mg和約200mg之間的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
172、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約150mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
173、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約100mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
174、在另一方面,本文公開了式i化合物或其藥學上可接受的鹽的用途,其用于治療kras?g12c突變型癌癥的藥物制造,向有需要的患者與西妥昔單抗同時、分開或依次組合施用劑量約50mg的式i化合物或其藥學上可接受的鹽,以治療kras?g12c突變型晚期crc。
- 還沒有人留言評論。精彩留言會獲得點贊!