利用PCR?RFLP檢測綿羊PCNP基因單核苷酸多態性的方法及其應用與流程
本發明屬于分子遺傳學領域,涉及以綿羊的功能基因的單核苷酸多態性(SNP)作為分子遺傳標記,特別涉及綿羊PCNP基因的單核苷酸多態性及其檢測方法。
背景技術:
在綿羊育種中,人們期望通過對繁殖性狀密切相關,并且與數量性狀緊密連鎖的DNA標記的選擇,達到早期選種和提高育種值準確性的目的,從而在畜禽育種中獲得更大的遺傳進展。
分子育種,即分子標記輔助選擇育種(Molecular Mark-Assist Selection,MAS),該技術是借助DNA分子標記對遺傳資源或育種材料進行選擇,對畜禽的綜合性狀進行品種改良,它是利用現代分子生物學和傳統遺傳育種相結合的方法,進行新品種選育。
基因多態性是指不同物種或者同一物種內的不同個體間基因組序列的差異,這些差異是由于染色體中DNA等位基因中核苷酸改變引起,主要是包括堿基的替換、插入、缺失以及重復序列拷貝數的變化。
單核苷酸多態性(Single Nucleotide Polymorphism,SNP)是由美國麻省理工學院的人類基因組研究中心的學者Lander(1996)提出的一類遺傳標記系統,就是指基因組DNA序列中由于單個核苷酸(A/T/C/G)的替換而引起的多態性。SNP作為新的遺傳標記已廣泛應用于基因定位、克隆、遺傳育種及多樣性的研究。SNP是基因組中存在的一種數量非常豐富的變異形式,占人類基因組中遺傳多態性的90%以上。SNP與罕見的變異不同,通常在種群中頻率等于或小于1%的此種變異被稱為突變,而只有頻率大于1%時才被稱為單核苷酸多態性。它的變異形式有:顛換、轉換、插入和缺失等,主要由單個堿基的轉換或者顛換所引起。具有轉換型的堿基變異的SNPs約占2/3。
根據基因組中單核苷酸多態性產生的位置,可分為以下3類:基因編碼區單核苷酸多態性(Coding-region SNPs,cSNPs)、基因周邊單核苷酸多態性(Perigenic SNPs,pSNPs)以及基因間單核苷酸多態性(Intergenic SNPs,iSNPs)。
研究表明,位于編碼區內的cSNP比較少。基因編碼區內的cSNP又可分為2種:一種是編碼區內的同義cSNP(Synonymous cSNP),即SNP所致編碼序列的改變并不會影響其所翻譯的蛋白質中氨基酸序列的改變;另一種是編碼區內的非同義cSNP(Non-Synonymous cSNP),即堿基序列的改變將導致編碼氨基酸的改變,從而導致蛋白質中氨基酸序列的改變,可能最終影響到蛋白質的功能。
由于SNPs是二等位基因分子標記,所以,理論上在一個二倍體生物群體中,SNPs可能是由2個、3個或4個等位基因構成,但實際上3個或4個等位基因的SNPs很罕見,故SNPs通常被簡單地稱為二等位基因分子標記。目前,主要采用幾種不同的路線來發現SNPs:即DNA序列測定方法、聚合酶鏈反應—單鏈構象多態(Polymerase Chain Reaction-Single Strand Conformation Polymorphism,PCR-SSCP)與DNA測序結合法、等位特異性PCR(Allele Specific PCR,AS-PCR)方法、引物延伸法和寡核苷酸連接反應等。在這些SNP檢測技術中,DNA序列測定法是最為準確的SNP檢測方法,但是,其檢測費用昂貴,且需要有DNA測序儀等大型儀器,同時,在測序過程中需要非常熟練的技術人員和經驗,所以,DNA序列測定法不是一種應用于生產實際的理想SNP檢測方法;當然,利用PCR-SSCP與DNA測序結合法檢測SNP可以適當降低檢測費用,但是,PCR-SSCP的實驗過程比較長,操作比較繁瑣,且實驗過程中存在假陽性問題,所以,也并非理想的SNP檢測手段;AS-PCR方法作為一種新型的SNP檢測方法,在未來的應用領域中具有非常廣闊的前景,但是,該方法需要設計特別的引物,且只能針對特定的基因位點,同時,檢測過程中還存在誤檢的概率,因此,目前不具有普遍應用的特點;而引物延伸法和寡核苷酸連接反應技術檢測SNP位點,需要平板讀數儀、基因芯片、微球陣列技術和質譜儀等檢測平臺,對于一般的分子實驗室來說可實施性不強。
限制性片段長度多態性-聚合酶鏈反應(Restriction Fragment Length Polymorphism-Polymerase Chain Reaction,RFLP-PCR)方法是一種檢測SNP的有效技術,在發現SNP位點后設計上下游引物用限制性內切酶進行切割,然后進行瓊脂糖、聚丙烯凝膠電泳分析,就能準確地鑒別SNP位點。RFLP-PCR方法不僅具有DNA測序法的準確性,又克服了費用昂貴、繁瑣操作、假陽性的缺點,而且所檢測的序列位點無特殊性要求。
PCNP(PEST-containing nuclear protein)是一類定位于細胞核并含有PEST序列(即富含脯氨酸(P)、谷氨酸(E)、絲氨酸(S)和蘇氨酸(T)四種氨基酸的蛋白。
通過比對多個物種的序列發現,PCNP基因核酸序列的同源性較高,尤其在哺乳動物中均達到94%以上,都比較保守,說明在生物體中該蛋白應具有重要的作用及功能。在人類基因組中PCNP基因被定位在3q12.3,編碼178個氨基,對其理化性質進行分析后顯示其是由18種氨基酸組成的一種半衰期較短且不穩定的親水性蛋白。PCNP很可能在細胞周期調控與腫瘤發生過程中發揮作用,編碼PCNP的基因所在的3號染色體含有趨化因子受體(CKR)基因簇和多種人類癌癥相關基因位點,關鍵腫瘤抑制基因如凋亡調控因子RASSF1、細胞移調控因子HYAL1、血管生成抑制因子SEMA3B也都在3號染色體,馬凡綜合征、卟啉癥、Von Hippel-Lindau綜合癥、成骨不全癥等遺傳病也與3號染色體相關。
國內外目前關于PCNP的研究還比較少。朱江木研究發現PCNP的過表達能顯著促進小鼠骨骼肌細胞C2C12細胞生長,PCNP可能參與了肌細胞的周期調控,對肌細胞生長有調控作用,對肌細胞的功能也有影響。孫穎川研究發現在類風濕關節炎患者外周血中PCNP在基因水平和蛋白水平的表達增高,類風濕關節炎病情的輕重與PCNP的表達量正相關。在類風濕關節炎的發病中,該基因的表達變化和病人的病情密切相關,PCNP有可能成為臨床診斷類風濕關節炎的檢測指標,也可作為疾病病情發展、預后的參考指標,亦可能是潛在的分子治療靶點。通過mRNA差異顯示技術獲得屬于PCNP基因的表達量差異片段GW360093,在不同繁殖力山羊的卵巢組織中存在表達量差異,真正影響山羊繁殖性狀差異的是該基因表達產物的多少。
PCNP在綿羊上被準確定位到1號染色體上,包括5個外顯子。Genomic的登錄號(NC_019458.1),predicted mRNA登錄號XM_012189341.1,mRNA全長為712bp,該基因的CDS序列全長為537bp(7-543),可以編碼179個氨基酸。針對綿羊PCNP的研究還很少,國內外鮮見報道。2013年河北農業大學邢增喜成功的克隆了山羊PCNP基因的啟動子并預測了其核心調控區,為研究PCNP基因的轉錄調控機制奠定基礎。
關于動物PCNP基因遺傳變異的研究國內外多見于人、鼠、豬等動物,而未有綿羊PCNP基因遺傳變異或SNP研究的報道。由于目前中國湖羊、小尾寒羊PCNP基因遺傳變異領域的研究匱乏,使該基因位點的功能研究及該基因遺傳變異與經濟性狀,如繁殖性狀關聯的研究成為空白。
技術實現要素:
本發明的目的在于提供一種利用PCR-RFLP檢測綿羊PCNP基因單核苷酸多態性的方法及其應用,利用PCR-RFLP方法針對其基因位點上的錯義突變可能導致編碼蛋白構象發生變化的單核苷酸多態性進行檢測,提前淘汰產生錯義突變的個體,加快具有優質經濟性狀綿羊種群的建立。
本發明通過以下技術方案來實現:
綿羊PCNP基因第5019位為G或A的單核苷酸多態性的檢測方法為:以包含PCNP基因的待測綿羊(如湖羊、小尾寒羊等)全基因組DNA為模板,以引物對P為引物,PCR擴增湖羊、小尾寒綿羊PCNP基因;用限制性內切酶SPhI消化PCR擴增產物之后,再對酶切后的擴增片段進行瓊脂糖凝膠電泳;根據電泳結果鑒定綿羊PCNP基因第5019位的單核苷酸多態性;
所述的引物對P為:
上游引物:5’-AGAATAGCATGGGCAGAA-3’ 18nt;
下游引物:5’-TCATTTCTGTGGGACACC-3’ 18nt。
所述的PCR擴增反應程序為:94℃預變性5min;94℃變性30s,55.3℃退火30s,72℃延伸50s,35個循環;72℃延伸10min。
所述的瓊脂糖凝膠電泳為質量濃度為1%的瓊脂糖凝膠電泳。
根據瓊脂糖凝膠電泳結果PCNP基因第5019位堿基多態性為:AA型表現:377bp和309bp;GA型表現:686bp、377bp和309bp;GG型表現:686bp。
與現有技術相比,本發明具有以下有益的技術效果:
本發明利用RFLP-PCR方法對綿羊PCNP基因第5019位點上的突變可能產生編碼蛋白構象發生變化的單核苷酸多態性進行檢測,當位點由G突變為A時,為G→A的突變,該突變未引起氨基酸的改變,屬于同義突變,使具有重要生理功能的PCNP基因所編碼蛋白的空間二、三級構型發生變化,以至影響蛋白的生物學功能。該核苷酸多態性能夠作為一個分子遺傳標記,利用標記位點信息和數量性狀的表型信息,更準確估計動物個體的育種值,提高選擇效率,加快育種進展。
本發明通過設計特定的PCR引物擴增片段,能夠用RFLP-PCR方法簡單、快速、成本低、精確的檢測上述PCNP基因的單核苷酸的多態性。
本發明對PCNP基因的SNP進行了基因分型和基因頻率分析,以及與湖羊、小尾寒羊生長性狀之間進行了關聯分析;結果顯示PCNP基因的核苷酸多態位點能夠成為分子遺傳輔助育種的標記。
本發明提供的檢測方法為PCNP基因的SNP與生長性狀關系的建立奠定了基礎,以便用于中國湖羊、小尾寒羊等綿羊品種生長性狀的標記輔助選擇,快速建立遺傳資源優良的綿羊種群。
附圖說明
圖1為湖羊、小尾寒羊血樣基因組DNA電泳檢測圖;
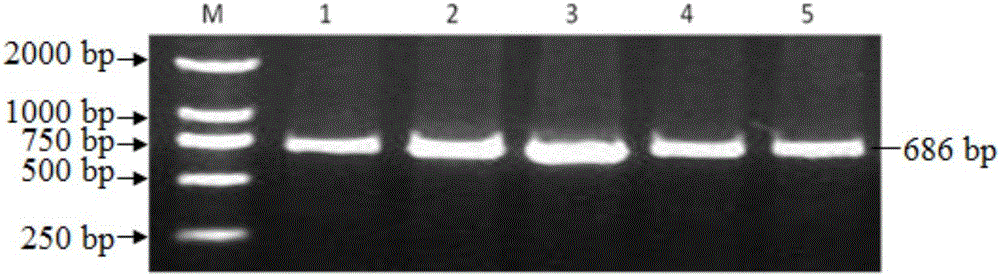
圖2為湖羊、小尾寒羊PCNP基因PCR擴增的686bp片段的電泳圖;
圖3為湖羊、小尾寒羊PCNP基因686bp PCR產物的SPhI酶切電泳檢測PCNP基因多態性的電泳結果圖;泳道1,2:GG基因型個體(686bp);泳道3,4:AA基因型個體(377bp,309bp);泳道5,6:GA基因型個體(686bp,377bp和309bp);M:Marker(2000bp,1000bp,750bp,250bp,100bp);
圖4為湖羊、小尾寒羊PCNP基因5019位SNP的不同基因型測序峰圖,其中,a對應GG基因型,b對應AA基因型,c對應GA基因型。
具體實施方式
下面結合附圖和實施例對本發明作進一步詳細說明,所述實施例是對本發明的解釋,而不是限定。
本發明以PCNP基因保守序列設計引物擴增PCNP基因第2外顯子686bp片段,以湖羊、小尾寒羊基因組為模板,進行PCR擴增,擴增產物經測序后尋找該擴增片段的單核苷酸多態;針對發現的單核苷酸多態進行性狀關聯性分析,并提供其檢測方法,使得PCNP基因的核苷酸多態性成為一種能夠快速、方便檢測的分子遺傳標記,為加快建立具有優質經濟性狀的湖羊、小尾寒羊等綿羊種群提供依據。
a、綿羊PCNP基因多態性的檢測
1、綿羊血樣的采集及處理
取湖羊、小尾寒羊血樣10mL,加入0.5mol/L的EDTA 500μL抗凝,緩慢顛倒3次后放入冰盒,-80℃保存備用。
本發明采用湖羊、小尾寒羊品種,具體如表1所示。
表1 綿羊樣品來源表
2、血樣基因組DNA的提取
(1)冰凍的血樣在室溫水浴中融化;
(2)將1mL全血轉入一個無菌的2mL離心管中;
(3)加入等體積(1mL)的PBS緩沖液,溫和搖動15-20min;
(4)4℃12000*g離心10min;
(5)用移液槍棄上清,重復步驟3、4至上清液透明,沉淀白色;
(6)離心管中加DNA提取液650-750μL,溫和搖動使細胞沉淀懸浮;
(7)37℃水浴1h;(可省略)
(8)加入蛋白酶K 3μL(終濃度為60μg/mL),混勻;
(9)在恒溫水浴箱中55℃溫育過夜(16h左右),至細胞沉淀物被完全消化,溶液澄清;
(10)反應液冷卻至室溫,加入1倍體積(800μL-1mL)的Tris飽和酚,放置冰上溫和搖動15min;
(11)4℃,12000g離心10min;
(12)將上層水相用移液槍移到另一滅菌離心管中;
(13)加入0.5倍體積(0.5mL)的酚和0.5倍(0.5mL)的氯仿,放置冰上溫和搖動15min;
(14)4℃,12000g離心10min;
(15)將上層水相用移液槍移到另一滅菌離心管中;
(16)加入1倍體積(1mL)的氯仿,放置冰上溫和搖動15min;
(17)4℃,12000g離心10min;
(18)將上層水相用移液槍移到另一滅菌離心管中;
(19)加入2倍體積的預冷無水乙醇(-20℃),輕輕口底搖晃多次至DNA析出,然后-20℃放置30min;
(20)4℃,12000g離心10min;棄上清液;
(21)加入70%乙醇1mL,溫和搖動10min;
(22)4℃,12000g離心10min,棄乙醇,重復漂洗一次;
(23)真空干燥或室溫下使乙醇揮發干凈;
(24)根據DNA的量,加入超純水100-300μL,4℃保存至DNA完全溶解,分光光度計測定濃度后,-80℃保存。
3、DNA池的構建
(1)1%瓊脂糖凝膠電泳檢測
選部分DNA樣品進行瓊脂糖凝膠電泳檢測,選擇DNA樣品條帶均一、無拖尾、無降解的樣品進行DNA池的構建。
(2)OD值測定
用紫外光光度計測定DNA樣品在260nm、280nm處的OD值。計算DNA含量和OD260/OD280的比值。如OD260/OD280比值小于1.6,說明樣品中含有較多的蛋白質或酚,則應進行純化;若比值大于1.8,則應該考慮去除RNA純化。
DNA濃度(ng/μL)=50×OD260值×稀釋倍數
(3)品種DNA池的構建
DNA檢測完畢后,取出一定的量稀釋至50ng/μL,然后從湖羊、小尾寒羊50個濃度為50ng/μL DNA樣品中取10μL混合構建成品種DNA池;
湖羊、小尾寒羊血樣基因組DNA的檢測結果見圖1,從圖中可以看出湖羊、小尾寒羊基因組DNA的質量非常高。
4、PCR擴增
以綿羊DNA池為模版,用設計的引物對P進行PCR擴增,PCR總反應體系為25.3μL,見表2;PCR總反應程序,見表3。
表2 PCR反應體系
引物對P:
上游引物:5’-AGAATAGCATGGGCAGAA-3’ 18nt;
下游引物:5’-TCATTTCTGTGGGACACC-3’ 18nt
表3 引物最佳PCR反應程序
5、PCR產物純化和測序
PCR擴增完成之后進行瓊脂糖凝膠電泳,電泳結果如圖2所示,可以清楚看到686bp的條帶;然后進行PCR產物的切膠回收及純化:在紫外燈下從瓊脂糖凝膠上切下含目的片段的凝膠,放入1.5mL離心管中,然后用PCR產物回收純化試劑盒(北京天根生物公司)純化PCR產物,按照試劑盒說明書操作,具體步驟如下:
(1)首先向吸附柱中加入500μL平衡液BL,12000r/min離心1min,倒掉收集管中的廢液,將吸附柱重新放回收集管中。
(2)將單一的目的DNA條帶從瓊脂糖凝膠中切下放入干凈的離心管中,稱取重量。
(3)向膠塊中加入等體積溶液PC,60℃水浴放置10min左右,其間不斷溫和地上下翻轉離心管,以確保膠塊充分溶解。
(4)將上一步所得溶液加入一個吸附柱中,12000r/min離心1min,倒掉收集管中的廢液,將吸附柱重新放入收集管中。
(5)向吸附柱中加入700μL漂洗液,12000r/min離心1min,倒掉廢液,將吸附柱重新放入收集管中。
(6)向吸附柱中加入500μL漂洗液,12000r/min離心1min,倒掉廢液,將離心吸附柱放入收集管中,12000r/min離心2min,盡量除去漂洗液。將吸附柱置于室溫或50℃溫箱數分鐘,徹底晾干。
(7)將吸附柱放到一個干凈的離心管中,向吸附膜中間位置懸空滴加適量的洗脫緩沖液,室溫放置2分鐘。12000r/min離心1min收集DNA溶液。
(8)為了提高DNA的回收量,可將離心得到的溶液重新加回離心吸附柱中,重復步驟7。
把以湖羊、小尾寒羊DNA池為模板的PCR純化產物送上海生物工程有限公司進行雙向測序。湖羊、小尾寒羊PCNP基因目的片段686bp的測序結果如圖4所示。
對測序峰圖進行分析,其中在同一位點有兩個不同峰的是發生了單核苷酸突變;位于湖羊、小尾寒羊PCNP基因的第5019位出現了G、A兩種檢測結果,即為篩查到的湖羊、小尾寒羊PCNP基因的SNP多態性,該位點是為G或A的堿基多態性。
b、綿羊PCNP基因G>A突變多態性的RFLP-PCR檢測
由于篩查到的堿基多態性為自然酶切位點,能被常用的內切酶進行PCR-RFLP來鑒定。當湖羊、小尾寒羊的PCNP基因第5019位未發生G>A突變時,即為突變前G,利用引物對P擴增的PCNP基因序列GCATGC,為SPhI的限制性內切酶識別位點;可直接通過SPhI對目的片段的酶切進行基因分型。
1、RFLP-PCR引物設計
參照引物對P。
上述引物能夠擴增湖羊、小尾寒羊PCNP基因2第外顯子686bp片段。
2、RFLP-PCR反應條件
PCR產物擴增體系和反應條件分別如表2和表3所述,PCR擴增產物的1%瓊脂糖凝膠電泳圖譜如圖2所示,可以看到設計的引物對P能夠擴增686bp的片段。
3、PCR擴增產物的SPhI酶切
(1)酶切體系為:為sphI內切酶0.5μL,Buffer B 2μL,ddH2O 13μL,4μL PCR擴增產物,總計20μL。
(2)酶切消化條件:37℃恒溫培養箱中消化12~16h。
(3)SPhI消化PCR產物后瓊脂糖凝膠電泳分析
用1.0%的瓊脂糖凝膠,200V電壓電泳18min,核酸染料染色檢測酶切結果,用UVP凝膠成像系統(GelDoc-It TS Imaging System)照相分析,并判型、記錄其基因型;
由于PCR-RFLP擴增的686bp片段中不包含其它的SPhI酶切識別位點,當PCNP基因第5019位未發生G>A突變時,PCR擴增的PCNP基因產物被限制性內切酶SPhI識別后,在GCATGC/CGTACG對擴增片段酶切,將擴增片段切為2段;而當PCNP基因第5019位發生突變,不能形成新的限制性內切酶SPhI酶切識別位點,擴增片段不能被酶切;
由于綿羊為2倍體動物,所以當發生G>A的突變時,可形成3種不同的基因型,分別為GG、GA、AA,其PCR-RFLP檢測的凝膠結果如圖3所示:
其中,GG基因型為野生型,它的兩條DNA鏈的SNP位點均不能被酶切,表現為686bp條帶;發生突變后的AA基因型的兩條鏈的SNP位點均能被SPhI酶切,表現為377bp和309bp條帶;雜合子GA的兩條鏈中的一條的SNP位點能夠被識別而另一條不能被識別,表現為686bp,377bp和309bp條帶,根據條帶的個數和條帶的大小,能夠很清楚的判定是否發生了點突變,將三種基因型區分開,從而檢測其SNP多態性。
(4)不同基因型個體PCR產物的測序驗證
利用ABI 5019和ABI 3730測序儀對不同基因型個體PCR產物分別進行正反雙向測序;同時,進行SNP位置分析,結果表明包含686bp、377bp和309bp條帶的雜合子GA基因型個體其第5019位的測序圖的確表示為G或A,如圖4c所示,自左向右第5019位為兩個峰;而GG基因型、AA基因型分別為G、A,分別如圖4a、圖4b所示。
c、不同綿羊群體中PCNP基因第5019位的SNP作為分子標記的應用
1、群體單核苷酸多態性的檢測
利用上述的SNP多態性檢測方法對湖羊、小尾寒羊共計604份DNA樣品,進行SNP多態性的鑒定;統計其SNP位點的頻率分布情況。
2、SNP位點的頻率統計分析
基因型頻率是指一個群體中某一性狀的某種基因型個體數占總個體數的比率。PAA=NAA/N,其中PAA代表某一位點的AA基因型頻率;NAA表示群體中具有AA基因型的個體數;N為檢測群體的總數量。
基因頻率是指一個群體中某一基因數對其等位基因總數的相對比率。計算的公式可以寫成:PA=(2NAA+NAa1+NAa2+……+NAan)/2N。式中,PA表示等位基因A頻率,NAA表示群體中具有AA基因型的個體數量,NAai表示群體中具有Aai基因型個體數量,a1-an為等位基因A的n個不同的復等位基因;統計結果見表4。
表4 湖羊、小尾寒羊PCNP基因第5019位SNP基因頻率分布表
3、基因效應的關聯分析
基因型數據:SPhI識別的基因型(GG、GA、GA)
繁殖性狀數據:第一胎產羔數
關聯分析模型:
利用SAS(9.2)軟件分析基因位點與繁殖性狀(產羔數)的相關性。先對數據進行描述性統計分析,確定是否存在離群值,根據數據特征,利用t分析、方差分析或是多元線性模型分析基因型效應。在數據處理中,根據影響產羔數因素不同,考慮到環境效應、年齡、基因型效應及相關的互作效應,采用固定模型進行分析,同時,根據實際情況進行取舍。完整的模型如下:
Yijk=μ+Gj+Eijk
其中:Yijk為個體表型記錄;μ為群體均值;Gj為各位點的基因型效應;Eijk為隨機誤差。
表5 PCNP基因單核苷酸多態性與綿羊繁殖性狀之間的方差分析
注:具有相同字母肩標的平均值間差異不顯著(P>0.05),具有不同字母肩標的平均值間差異顯著(P<0.05)
結果表明,在綿羊PCNP基因組序列的第5019位單核苷酸多態位點上的不同基因型與綿羊產羔數關聯分析表明,AA基因的個體的產羔數顯著高于GG基因型個體,見表5。根據這個研究結果,可以通過選擇,建立基因型為AA純合型綿羊群體,提高其產羔率。
核苷酸序列表
<110> 蘭州大學
<120> 利用PCR-RFLP檢測綿羊PCNP基因單核苷酸多態性的方法及其應用
<160> 2
<210> 1
<211> 18
<212> DNA
<213> 人工合成
<400> 1
agaatagcat gggcagaa 18
<210> 2
<211> 18
<212> DNA
<213> 人工合成
<400> 2
tcatttctgt gggacacc 18
- 還沒有人留言評論。精彩留言會獲得點贊!