一種酪蛋白來源的降膽固醇肽及其制備方法和應用與流程
本發明屬于生物技術領域,涉及一種功能因子及其制備方法,具體涉及一種酪蛋白來源的降膽固醇肽及其制備方法和應用。
背景技術:
血液中膽固醇含量過高,尤其是低密度脂蛋白含量過高,可能會增加患心血管疾病的風險,并且,膽固醇在動脈壁上聚集會導致動脈粥樣硬化等疾病的發生。目前,用于臨床治療的降膽固醇藥物多屬于化學類藥物,會給患者帶來不同程度的毒副作用。例如,考來烯胺、考來替泊等膽酸整合劑,以及他汀類藥物,對患者的身體健康有一定風險,不適合長期服用。而食源性活性肽是功能性食品,臨床副作用小,市場前景良好。
目前,對降膽固醇肽的降膽固醇作用機理曾提出一種假設,既食品蛋白源降膽固醇肽可作用于膽固醇腸肝循環途徑,通過這些肽的較強結合膽汁酸的能力來抑制內源膽固醇的重吸收,從而達到降低血清膽固醇水平的功效。膽固醇活性肽降膽固醇作用的另一途徑是通過減少外源膽固醇的吸收來達到降低血清膽固醇的目的。外源膽固醇被小腸吸收后,大部分在小腸粘膜細胞滑面內質網上被酰基輔酶A:膽固醇酰基轉移酶(acyl coezyme A:cholesterol acyltransferase,ACAT)重新酯化,形成膽固醇酯,與粗面內質網上合成的載脂蛋白構成新生的乳糜微粒(包括甘油三酯、膽固醇酯和磷脂等),經高爾基復合體分泌到細胞外,進入淋巴循環最終進入血液循環。乳糜微粒中膽固醇溶解度的降低可導致外源膽固醇吸收量的減少從而引起血液膽固醇水平的降低。目前國內外針對大豆蛋白和乳清蛋白的降膽固醇肽有一些報導,但對牛乳中酪蛋白源的降膽固醇肽缺乏系統性的研究報導。酪蛋白在乳中的比例接近總體蛋白質含量的80%,來源豐富,因此,酪蛋白源降膽固醇生物活性肽的開發極具應用潛力和價值。
技術實現要素:
解決的技術問題:為了克服現有技術的缺陷,彌補牛乳中酪蛋白源的降膽固醇肽研究的空白,獲得一種新來源的的降膽固醇肽,并通過人工合成的方法制備抑制外源性膽固醇吸收的降膽固醇肽,本發明提供了一種酪蛋白來源的降膽固醇肽及其制備方法和應用。
技術方案:一種酪蛋白來源的降膽固醇肽,所述降膽固醇肽包含下述的氨基酸序列:SEQ ID NO:1和SEQ ID NO:2。
一種酪蛋白來源的降膽固醇肽的制備方法,包含以下步驟:
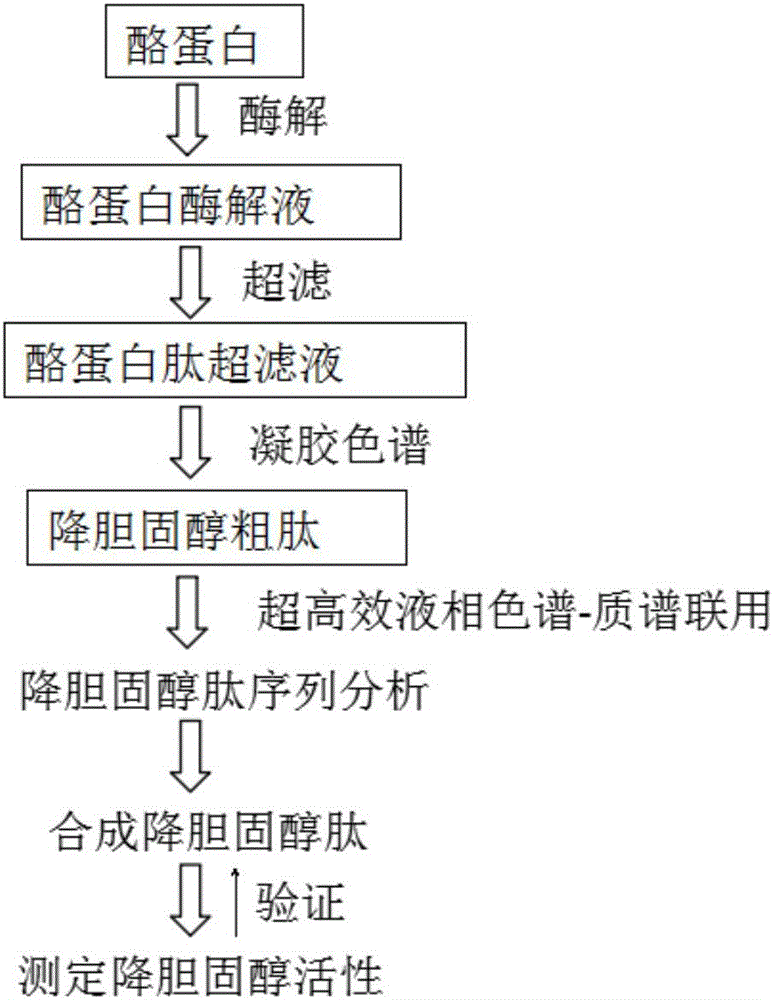
(1)制備酪蛋白酶解液:配制40~60mg/mL的酪蛋白溶液,加入蛋白酶,蛋白酶的終濃度為50~70mg/mL,酶解pH為6.0~8.0,酶解溫度為45~50℃,酶解時間為3~4h,加熱滅活,離心取上清;
(2)制備酪蛋白肽超濾液:將步驟(1)收集的上清液進行超濾,超濾膜壓力為0.1~0.4MPa,流速為5~10mL/min;所述超濾采用的超濾膜截留分子量為10000Da;
(3)制備降膽固醇粗肽:采用凝膠色譜分離純化步驟(2)制備獲得的酪蛋白肽超濾液,220nm檢測出峰位置,收集各吸收峰,以膽固醇膠束溶解度抑制率為評價指標測定降膽固醇活性,具有降膽固醇活性的組分進行冷凍干燥;
(4)降膽固醇肽序列分析:采用超高效液相-質譜聯用分析降膽固醇粗肽的氨基酸序列;
(5)降膽固醇肽合成:根據步驟(4)的氨基酸序列分析結果合成降膽固醇肽,收集具有降膽固醇活性的多肽。
優選的,步驟(1)中所述酪蛋白溶液濃度為50mg/mL,蛋白酶的終濃度為60mg/mL,酶解pH為7.0,酶解溫度為47.5℃,酶解時間為3.5h。
優選的,步驟(1)中所述蛋白酶為中性蛋白酶。
優選的,步驟(2)中所述超濾膜壓力為0.25MPa,流速為7.5mL/min。
優選的,步驟(3)中所述凝膠色譜采用的過濾介質為Sephadex G-10凝膠,蒸餾水平衡,上樣量為1~2%凝膠色譜柱體積,洗脫速度為2.5~3.5mL/min。
優選的,步驟(4)所述超高效液相-質譜聯用分析中液相色譜分析柱采用的是ACQUITY UPLC BEH130C18柱,規格為2.1×150nm,1.7μm,質譜儀采用的是WATERS MALDI SYNAPT Q-TOF MS。
所述的酪蛋白來源的降膽固醇肽在功能食品中的應用。
有益效果:(1)本發明所述的酪蛋白來源的降膽固醇肽來源于牛乳,其中酪蛋白含量占總蛋白含量的80%左右,因而來源豐富;(2)本發明所述方法采用中性蛋白酶酶解酪蛋白,無特異性酶切位點,因而能夠獲得廣泛的降膽固醇肽,酶切效率高;(3)本發明所述方法的凝膠過濾層析獲得的降膽固醇粗肽無需進行液相色譜分離,直接采用超高效液相質譜聯用UPLC-MS分析降膽固醇肽的氨基酸序列,并且合成降膽固醇肽進一步驗證降膽固醇活性,確定降膽固醇肽序列,提高了效率;(4)本發明所述酪蛋白來源的降膽固醇肽能夠用于制備功能性食品,從而抑制外源膽固醇的吸收。
附圖說明
圖1是本發明所述酪蛋白來源的降膽固醇肽制備方法的工藝流程圖;
圖2是中性蛋白酶酶解乳清蛋白的酶解物G-10凝膠層析分離圖;
圖3是蒸餾水的UPLC-MS總離子流圖;
圖4是中性蛋白酶酶解乳清蛋白的酶解物經G-10凝膠層析分離后獲得降膽固醇粗肽的UPLC-MS總離子流圖;
圖5是多肽TDVEN(Thr-Asp-Val-Glu-Asn)的MS/MS圖;
圖6是多肽LQPE(Leu-Gln-Pro-Glu)的MS/MS圖;
圖7是多肽VLPVPQ(Val-Leu-Pro-Val-Pro-Gln)的MS/MS圖;
圖8是多肽VAPFPE(Val-Ala-Pro-Phe-Pro-Glu)的MS/MS圖。
具體實施方式
以下實施例進一步說明本發明的內容,但不應理解為對本發明的限制。在不背離本發明精神和實質的情況下,對本發明方法、步驟或條件所作的修改和替換,均屬于本發明的范圍。若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段。本發明中所使用的術語,除非有另外說明,一般具有本領域普通技術人員通常理解的含義。
本發明所述實施例中采用的實驗測定方法如下:
1.酪蛋白水解度的測定
在酪蛋白水解過程中每隔一定時間測定溶液pH,加入一定濃度的NaOH溶液使之維持在恒定的pH值,在酶解過程中記錄消耗的NaOH量,用于計算水解度。
其中,B:NaOH的體積(mL);
Nb:NaOH的濃度(mol/L);
α:α-氨基的平均解離度,在pH 7.0,50℃的實驗條件下,對于酪蛋白,1/α為2.26;
Mp:底物中蛋白質總含量(g);
htot:每克原料蛋白質中肽鍵的毫摩爾數,在pH值為7.0和50℃的實驗條件下,對于酪蛋白而言,該值取8.2mmol/g。
2.多肽含量的測定
雙縮脲試劑的制備:稱取1.5g硫酸銅,6.0g酒石酸鉀鈉,溶于500mL蒸餾水,在溶解攪拌過程中加入300mL10%(W/V)的NaOH溶液,用蒸餾水定容至1L。
多肽含量標準曲線的制備:取10個10mL的容量瓶,用5%(W/V)的TCA(三氯乙酸)水溶液依次配制0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6和1.8mg/mL的Gly-Gly-Tyr-Arg四肽標準溶液,然后分別取6.0mL標準溶液,加入4.0mL雙縮脲試劑,混合均勻,靜置10min,2000r/min離心10min,取上清液于540nm測定OD值(以第一管做空白對照)。以肽的濃度為橫坐標X(mg/mL),吸光度(OD值)為縱坐標Y,制作標準曲線。
樣品多肽含量的測定:取2.5mL樣品溶液,加入2.5mL 10%TCA(三氯乙酸)水溶液,于漩渦混合儀上混合均勻,靜置10min后,4000r/min離心15min,將上清液全部轉移到50mL容量瓶中,并用5%TCA(三氯乙酸)定容至刻度,搖勻。取6.0mL上述溶液置另一試管中,加入4.0mL雙縮脲試劑,混合均勻,靜置10min,2000r/min離心10min,取上清液于540nm下測定OD值,對照標準曲線求得樣品溶液中的多肽濃度C(mg/mL),進而可求得樣品中多肽含量。
3.降膽固醇肽降膽固醇活性測定
制備模擬膽汁膽固醇膠束溶液,其中10mL膠束溶液含0.15g牛磺膽酸鈉、0.03g膽固醇、50μL油酸、0.2g NaCl。樣品組在膽固醇膠束溶液中添加30mg酪蛋白肽,超聲波乳化均勻后,37℃恒溫孵育24h。空白組不添加粗肽,用10mL的PBS緩沖液代替肽液。常溫下離心10000r/min,15min,取上清液30uL,用總膽固醇試劑盒測定膽固醇含量。計算酪蛋白肽對模擬膽汁膠束溶液中的膽固醇溶解度的抑制率,每組三次平行。
膽固醇抑制率計算公式如下:
實施例1
一種酪蛋白來源的降膽固醇肽,所述降膽固醇肽包含下述的氨基酸序列:SEQ ID NO:1和SEQ ID NO:2。
一種酪蛋白來源的降膽固醇肽的制備方法,包含以下步驟:
(1)制備酪蛋白酶解液:配制50mg/mL的酪蛋白溶液,加入50U/mg中性蛋白酶,蛋白酶的終濃度為60mg/mL;采用1mol/L NaOH和0.5mol/L HCl溶液調節酶解pH為7.0,酶解溫度為47.5℃,酶解過程中不斷加入1mol/L NaOH維持溶液pH恒定,酶解時間為3.5h;將反應體系90℃加熱20min滅酶活,4500r/min離心20min取上清;
(2)制備酪蛋白肽超濾液:將步驟(1)收集的上清液進行超濾,超濾膜壓力為0.25MPa,流速為7.5mL/min;所述超濾采用的超濾膜截留分子量為10000Da;收集分子量10000Da以下的酪蛋白肽超濾液,超濾液通過真空冷凍干燥濃縮;
(3)制備降膽固醇粗肽:將上述酪蛋白肽超濾液通過凝膠色譜進行分離純化,稱取一定量的Sephadex G-10固體,用沸水浴溶脹2h;在層析柱(¢1.6cm×50cm)中加入少量蒸餾水以排除層析柱底部的空氣;搖勻溶脹好的Sephadex G-10凝膠,用一根玻璃棒小心將凝膠導入層析柱,柱子裝完后用蒸餾水平衡充分;超濾后冷凍干燥的酪蛋白肽超濾液用蒸餾水溶解,質量濃度為80mg/mL,上樣量為1.5%凝膠色譜柱體積,洗脫速度為3.0mL/min,紫外檢測器波長為220nm,收集各組分,冷凍干燥,測定膽固醇膠束溶解度抑制率。如圖2所示,峰A、峰B的膽固醇膠束溶解度抑制率(%)分別為24.2±0.24,4.3±0.16,收集峰A為降膽固醇粗肽。
(4)降膽固醇肽序列分析:選擇Sephadex G-10分離后的酪蛋白肽膽固醇溶解度抑制率高的樣品(峰A)通過超高效液相質譜聯用UPLC-MS分析所含肽序列,UPLC-MS分析條件如下:
液相色譜分析柱:ACQUITY UPLC BEH130C18柱(2.1×150nm,1.7μm)(Waters,美國);流動相A:100%乙腈;流動相B:0.1%甲酸水溶液;柱溫:45℃;檢測波長:204nm;流速:0.3mL/min;進樣量:8μL;洗脫程序:0~1min,流動相A 2%,流動相B 95%;1~10min,流動相A 30%,流動相B 60%;10~17min,流動相A100%,流動相B 0%;17~22min,流動相A 2%,流動相B 95%;
質譜儀采用美國WATERS MALDI SYNAPT Q-TOF MS(Waters,美國),干燥氣和霧化氣均為N2;離子方式:ESI+;毛細管電壓:3.5kVolts;錐孔電壓:30Volts;脫溶劑氣體溫度:300℃;離子源溫度:100℃;脫溶劑氣體流量:500lit/hr;錐孔氣體流量(L/Hr):50lit/hr;碰撞能量:6/35Volts;質量范圍:100~1500m/z;檢測電壓:1600~1700Volts;利用軟件Masslynx4.1進行酪蛋白肽氨基酸序列分析與手動計算肽的氨基酸序列相結合,確定降膽固醇肽序列;
圖3為蒸餾水的總離子流圖,圖4為中性蛋白酶酶解酪蛋白水解物經G-10分離后簡單的總離子流圖,采用GPMAW軟件、Masslynx軟件進行多肽氨基酸序列解析,分別解析了四種多肽的氨基酸序列:TDVEN(Thr-Asp-Val-Glu-Asn)、LQPE(Leu-Gln-Pro-Glu)、VLPVPQ(Val-Leu-Pro-Val-Pro-Gln)和VLPVPQ(Val-Leu-Pro-Val-Pro-Gln),見表1;圖5為多肽TDVEN(Thr-Asp-Val-Glu-Asn)的MS/MS圖,圖6為LQPE(Leu-Gln-Pro-Glu)的MS/MS圖,圖7為VLPVPQ(Val-Leu-Pro-Val-Pro-Gln)的MS/MS圖,圖8為VAPFPE(Val-Ala-Pro-Phe-Pro-Glu)的MS/MS圖。
表1降膽固醇粗肽經UPLC-MS解析的四種多肽氨基酸序列及來源
(5)降膽固醇肽合成:合成TDVEN、LQPE、VLPVPQ和VAPFPE四種肽,純度為95%,測定降膽固醇活性,TDVEN、LQPE具有降膽固醇活性,膽固醇膠束溶解度抑制率分別為48.37%±4.42%,43.07%±3.09%,因此,確定TDVEN和LQPE為降膽固醇肽。
實施例2
本實施例與實施例1的區別在于步驟(1)制備酪蛋白酶解液:配制40mg/mL的酪蛋白溶液,加入中性蛋白酶的終濃度為50mg/mL,酶解pH為6.0,酶解溫度為45℃,酶解時間為4h,加熱滅活,離心取上清。
實施例3
本實施例與實施例1的區別在于步驟(1)制備酪蛋白酶解液:配制70mg/mL的酪蛋白。加入中性蛋白酶的終濃度為70mg/mL,酶解pH為8.0,酶解溫度為50℃,酶解時間為3h,加熱滅活,離心取上清。
實施例4
本實施例與實施例1的區別在于步驟(2)制備酪蛋白肽超濾液:超濾膜壓力為0.1MPa,流速為5mL/min。
實施例5
本實施例與實施例1的區別在于步驟(2)制備酪蛋白肽超濾液:超濾膜壓力為0.4MPa,流速為10mL/min。
實施例6
本實施例與實施例1的區別在于步驟(3)制備降膽固醇粗肽:酪蛋白肽超濾液通過凝膠色譜進行分離純化時,上樣量為1%凝膠色譜柱體積,洗脫速度為2.5mL/min。
實施例7
本實施例與實施例1的區別在于步驟(3)制備降膽固醇粗肽:酪蛋白肽超濾液通過凝膠色譜進行分離純化時,上樣量為2%凝膠色譜柱體積,洗脫速度為3.5mL/min。
SEQUENCE LISTING
<110> 南京師范大學
<120> 一種酪蛋白來源的降膽固醇肽及其制備方法和應用
<130>
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<400> 1
Thr Asp Val Glu Asn
1 5
<210> 2
<211> 4
<212> PRT
<213> 人工序列
<400> 2
Leu Gln Pro Glu
1
<210> 3
<211> 6
<212> PRT
<213> 人工序列
<400> 3
Val Leu Pro Val Pro Gln
1 5
<210> 4
<211> 6
<212> PRT
<213> 人工序列
<400> 4
Val Ala Pro Phe Pro Glu
1 5
- 還沒有人留言評論。精彩留言會獲得點贊!