一種培養羊膜上皮細胞的組合培養基的制作方法
本發明屬于細胞培養領域,特別涉及一種培養羊膜上皮細胞的組合培養基。
背景技術:
羊膜位于胎兒絨毛膜的表面,為光滑、無血管、無神經、無淋巴的透明薄膜,厚約0.02~0.50mm,由羊膜上皮細胞、基底膜和基質組成。形成于原腸胚之前的受精第8天,羊膜組織細胞保持有前原腸胚胚胎細胞的可塑性,羊膜組織主要由來源于外胚層的羊膜上皮(amnioticepithelialcells,aecs)和來源于中胚層的羊膜間充質(amnioticmesenchymecells,amcs)兩類細胞組成,羊膜上皮細胞具有三種胚原基層細胞的分化潛能。
神經發育生物學研究認為神經發生早期,羊膜組織直接與神經上皮聯系,向羊水中釋放神經遞質及神經營養因子,在神經系統發育過程中起著重要作用。由于羊膜組織是來源于胎兒的產物,暴露于母體免疫系統監視下,aecs表面人類白細胞抗原dr遺傳座位(humanleucocyteantigen-dr,hla-dr)低表達,不表達hla-a,b,c抗原,此外,羊膜組織系產后廢棄物無倫理學問題;羊膜組織細胞來源充分,具有神經細胞的神經生物學特點和功能,利用上述優勢使羊膜組織細胞有望成為再生醫學領域的可靠細胞來源,開展細胞移植治療神經系統退行性疾病和外傷性神經損傷。
但是由于羊膜上皮細胞在培養過程中難以維持其干細胞特性,一方面容易分化形成成熟上皮細胞,失去其干細胞特性;另一方面容易產生上皮—間質轉化,失去其上皮細胞特性。難以應用于再生醫學中。
羊膜上皮細胞要應用于再生醫學,首先需要解決的問題是如何在保持其上皮細胞特性的同時維持其增殖能力。
技術實現要素:
為了克服現有技術的缺點與不足,本發明的目的在于提供一種培養羊膜上皮細胞的組合培養基。
本發明的目的通過下述技術方案實現:
一種培養羊膜上皮細胞的組合培養基,包括如下組分:
eplife培養基+1%hkgs+羊膜勻漿上清;
所述的羊膜勻漿上清中的蛋白在組合培養基中的濃度為2~8ng/ml,優選為4ng/ml。
所述的羊膜勻漿上清的制備方法,包括如下步驟:
(1)羊膜經過0.25%胰酶消化,完全去除其上附著的羊膜上皮細胞,滅菌注射用水徹底清洗;
(2)將清洗好的羊膜剪碎,完全凍干水分;
(3)將液氮和凍干的羊膜倒入研缽,反復研磨直至液氮揮發;
(4)加入少量基礎培養基dmem/f12,混勻;
(5)超聲破碎,循環30次;
(6)0.22μm濾膜過濾,取濾液,即為羊膜勻漿上清。
步驟(1)中所述的消化的時間優選為2h。
步驟(1)中所述的超聲破碎的條件為ф=6,超聲時間3s,間隔時間3s。
本發明相對于現有技術,具有如下的優點及效果:
本發明的組合培養基是將消化去細胞的羊膜經過冷凍干燥、液氮研磨、超聲破碎,過濾除菌得到羊膜勻漿上清,將該勻漿上清以一定比例加入特定培養基中。該培養基可以在維持羊膜上皮細胞特性的同時有效提高羊膜上皮細胞增殖能力,延長羊膜上皮細胞的有效培養代數。
附圖說明
圖1是實施例1中p1代羊膜上皮細胞形態。
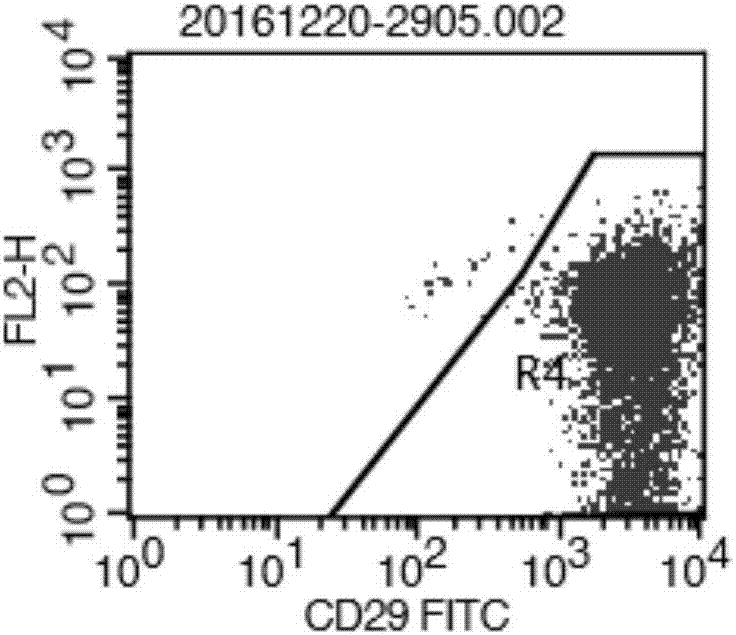
圖2是實施例1中p1代羊膜上皮cd29流式表型檢測。
圖3是實施例1中p1代ck19免疫組化。
圖4是實施例1中p6代羊膜上皮細胞形態。
圖5是實施例1中p6代ck19免疫組化。
圖6是實施例1中testp8細胞形態及免疫組化;其中,a:testp8細胞形態;b:testp8免疫組化。
圖7是實施例2中p6代兩組羊膜上皮細胞形態。
圖8是實施例2中p6代兩組羊膜上皮細胞ck19免疫組化。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1
一、材料與方法
1.材料及儀器
(1)材料:羊膜標本取自健康產婦孕嬰。經檢測乙型肝炎、丙型肝炎、梅毒、艾滋、巨細胞病毒、torch檢測、支原體、衣原體、g-6pd和地貧等均陰性。標本采集后運回血庫過程保持4~8℃運輸條件。
(2)儀器設備
培養箱:日本三洋,型號mco-20aic
超凈臺:蘇凈安泰空氣技術有限公司,型號sw-cj-2fd。
顯微鏡:olympus,型號ckx41-f32fl。
離心機:thermo,型號heraeusmultifugex3。
(3)耗材:
eplife基礎培養基gibico公司2~8℃
hkgs添加物gibico公司-20℃
胰酶gibico公司2~8℃。
2.羊膜上皮細胞的制備
從健康人的羊膜組織中提取羊膜上皮細胞,獲取的羊膜上皮細胞進行體外培養、擴增。
1)無菌采取健康人的胎盤,將羊膜與胎盤絨毛組織分離,無菌生理鹽水清洗羊膜;
2)0.01%胰酶37℃消化10分鐘,棄去消化物,無菌生理鹽水清洗羊膜;
3)0.1%胰酶37℃消化10分鐘,收集消化物并用血清終止消化,無菌生理鹽水清洗羊膜,收集洗液,混合消化物和洗液。
4)800g,10min離心,收集細胞。
3.羊膜勻漿上清制備
(1)羊膜經過0.25%胰酶消化2小時,完全去除其上附著的羊膜上皮細胞,滅菌注射用水徹底清洗。
(2)將清洗好的羊膜剪碎,冷凍干燥儀中完全凍干水分。
(3)將液氮和凍干的羊膜倒入研缽,反復研磨直至液氮揮發。
(4)加入少量基礎培養基dmem/f12,混勻。
(5)超聲破碎,ф=6,超聲時間3s,間隔時間3s,循環30次。
(6)0.22μm濾膜過濾。
(7)檢測蛋白濃度,加入少量基礎培養基eplife培養基調整蛋白濃度至40ng/ml,4℃保存。
4.細胞培養
細胞平均分為兩組test與control,test加入培養基eplife+1%(v/v)hkgs+羊膜勻漿上清,培養基中羊膜勻漿上清蛋白終濃度為4ng/ml;control為eplife+1%(v/v)hkgs,調整細胞密度至1×104/ml,2ml/t25培養瓶培養。
5.羊膜上皮細胞的鑒定
羊膜上皮細胞的鑒定通過以下方法:羊膜上皮細胞形態學分析,ck19免疫組化,cd19流式表型鑒定。
二、結果與分析:
倒置顯微鏡下觀察p1代羊膜上皮細胞形態較單一,鋪路石樣生長(見圖1)。經流式細胞儀檢測顯示,細胞表面抗原cd29、陽性表達率達到95%以上(見圖2),ck19免疫組化顯示胞質與胞膜染色陽性(見圖3),證明所獲得的細胞為羊膜上皮細胞。
6.傳代培養
細胞平均分為兩組test與control,test加入培養基eplife+1%(v/v)hkgs+羊膜勻漿上清,培養基中羊膜勻漿上清蛋白終濃度為4ng/ml;control為eplife+1%(v/v)hkgs,調整細胞密度至1×104/ml,2ml/t25培養瓶培養。細胞80%融合后傳代。
7.傳代培養結果
control組p6代細胞老化嚴重,p7代時細胞已經無法繼續貼壁生長(見圖4)。
test組p8代細胞老化,p9代時細胞已經無法繼續貼壁生長(見圖5)。
可見test組較control組維持更長時間增殖能力,并在增殖期間,維持了其上皮細胞特性(圖6)。
實施例2
羊膜標本取自健康產婦孕嬰。經檢測乙型肝炎、丙型肝炎、梅毒、艾滋、巨細胞病毒、torch檢測、支原體、衣原體、g-6pd和地貧等均陰性。標本采集后運回血庫過程保持4~8℃運輸條件。按照以下方法處理。
1.羊膜上皮細胞的制備
從健康人的羊膜組織中提取羊膜上皮細胞,獲取的羊膜上皮細胞進行體外培養、擴增。
1)無菌采取健康人的胎盤,將羊膜與胎盤絨毛組織分離,無菌生理鹽水清洗羊膜;
2)0.01%胰酶37℃消化10分鐘,棄去消化物,無菌生理鹽水清洗羊膜;
3)0.1%胰酶37℃消化10分鐘,收集消化物并用血清終止消化,無菌生理鹽水清洗羊膜,收集洗液,混合消化物和洗液。
4)800g,10min離心,收集細胞。
2.羊膜勻漿上清制備
(1)羊膜經過0.25%胰酶消化2小時,完全去除其上附著的羊膜上皮細胞,滅菌注射用水徹底清洗。
(2)將清洗好的羊膜剪碎,冷凍干燥儀中完全凍干水分。
(3)將液氮和凍干的羊膜倒入研缽,反復研磨直至液氮揮發。
(4)加入少量基礎培養基dmem/f12,混勻。
(5)超聲破碎,ф=6,超聲時間3s,間隔時間3s,循環30次。
(6)0.22μm濾膜過濾。
(7)檢測蛋白濃度,加入少量基礎培養基eplife培養基調整蛋白濃度至40ng/ml。
p2代細胞鑒定同實施例1
3.細胞平均分為兩組test與control,test加入培養基eplife+1%(v/v)hkgs+羊膜勻漿上清,培養基中羊膜勻漿上清蛋白終濃度為4ng/ml;control為基礎培養基dmem+10%(v/v)胎牛血清,調整細胞密度至1×104/ml,2ml/t25培養瓶培養。
4.羊膜上皮細胞的鑒定
1)羊膜上皮細胞的鑒定通過以下方法
p6代后ck19免疫組化鑒定。
2)細胞鑒定結果:
control表現明顯的間充質樣形態,細胞細長(見圖7),免疫組化ck19染色為陰性(見圖8)。
test鋪路石樣生長,細胞小且呈多邊形(見圖7),免疫組化ck19染色為陽性(見圖8)。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!