一種用于以實時熒光RT?PCR檢測樣品中HIV?1病毒的引物對和包含其的試劑盒的制作方法
本發明涉及生物檢測領域,更具體地涉及一種用于檢測hiv-1病毒載量的引物序列,以及含有所述引物序列的試劑盒。
背景技術:
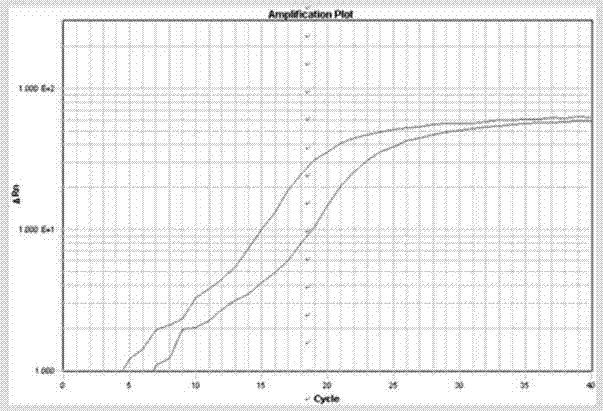
:人免疫缺陷病毒(又稱艾滋病病毒,hiv病毒)是造成艾滋病的主要病原體,其屬于逆轉錄病毒科慢病毒屬(lentiviruses)中的靈長類慢病毒群(weissetal.,1993,doueketal.,2009),基因組為兩條相同的正鏈rna。常見的艾滋病病毒株有兩種,即hiv-1和hiv-2兩種類型。其中hiv-1型起源于中非,以后擴散到地中海地區、歐美地區,是引起全球性艾滋病蔓延的主要病原體(gilbertetal.,2003,),hiv-2型主要分布于西部非洲,毒力較弱,引起的aids病程長且癥狀輕。根據世界衛生組織(who)統計,2011年全球共約3400萬名艾滋病病毒攜帶者和艾滋病患者,每年約有200萬人死于aids,同時又有270萬人新感染hiv,死亡人數中婦女和兒童占了一半以上,這給世界帶來了巨大的危害。目前,hiv病毒的檢測有基于抗體的檢測和基于核酸的檢測、質譜分析和測序等方法。為了達到最大可能的準確性,hiv抗體檢測分為篩查、復檢和確認三個步驟,篩查、復檢呈陽性反應的標本需要經過確認以后才能下結論,這是一個繁冗和耗時的過程。基于核酸的檢測主要包括rt-pcr、恒溫擴增和實時熒光定量pcr等。實時熒光定量pcr檢測方法靈敏度高,特異型強,操作也非常簡單,在當前hiv檢測中應用非常廣泛。實時熒光定量pcr是在普通pcr技術的基礎上,在擴增反應體系中加入一對特異性引物的同時再加入一個特異性的熒光探針,使用實時監測的熒光pcr檢測儀來檢測靶核苷酸序列的技術。除了具有普通pcr的優點外,它還具有以下優點:(1)特異性更強,靈敏度更高。由于多使用了一條可與模板互補配對的熒光探針,提高了特異性,并且由自動化儀器收集熒光信號,避免了人工判斷的主觀性,又可進一步提高靈敏度;(2)全封閉反應,在線式實時監測熒光,無須pcr產物的后處理,避免污染,保證了結果的可靠性;(3)數據分析選在核酸擴增的對數期,擯棄普通pcr方法的受多因素干擾的終點分析法,使得定量更準確可靠;(4)不接觸有毒試劑,操作安全;(5)有利于規模化、自動化及聯網管理;(6)適用范圍更廣,理論上可檢測任何病毒的核酸。hiv病毒的逆轉錄酶因為缺乏校正修復功能,導致其變異頻率非常高。不同亞型病毒包膜糖蛋白的氨基酸序列之間的差異在25%–35%之間,即使在某一特定亞型中包膜糖蛋白的氨基酸序列也存在高達20%的差異。針對hiv病毒的高變異性以及艾滋病流行趨勢的嚴重性,還需要開發新的靈敏度高、特異性好的實時熒光pcr檢測引物以及相應的檢測產品。技術實現要素:本發明的目的在于兩個方面:一方面提供一種用于檢測hiv-1病毒載量的熒光引物,以及含有該熒光引物的用于以實時熒光rt-pcr檢測樣品中hiv-1病毒的試劑盒。另一方面提供一種用于檢測hiv-1病毒載量的引物對和探針序列,以及含有該引物對和探針的用于以實時熒光rt-pcr檢測樣品中hiv-1病毒的試劑盒。為了實現上述目的,本發明采用了以下的技術方案:本發明提供一對核苷酸序列,其特異性結合hiv-1病毒,可用作檢測hiv-1病毒的引物對,所述引物對由上游引物和下游引物組成,所述上游引物包含seqidno.1所示的核苷酸序列,所述下游引物包含seqidno.2所示的核苷酸序列:seqidno.1ggggtacagtgcaggggaaagaa;seqidno.2taaacccgaaaattttgaatt。優選的,所述上游引物的核苷酸序列如seqidno.1所示,所述下游引物的核苷酸序列如seqidno.2所示。優選的,所述上游引物為熒光標記的引物(在本文中又稱為“hfman引物”),其中,所述上游引物的3’端標記有熒光報告基團,所述上游引物的5’端標記有熒光淬滅基團;或者所述上游引物的3’端標記有熒光淬滅基團,5’端標記有熒光報告基團;所述下游引物包含seqidno.2所示的核苷酸序列。優選的標記方式是:所述上游引物的3’端標記有熒光報告基團,所述上游引物的5’端標記有熒光淬滅基團。優選的,所述熒光報告基團為選自fam、hex、texasred、tet、joe、tamra、rox、lcred610、lcred640和cy5中的一種或多種;更優選為fam。優選的,所述熒光淬滅基團為選自bhq1、eclipse、bhq3、bhq2、dabcyl和tamra中的一種或多種;更優選為bhq1。優選的,所述上游引物的3’端標記有熒光發射基團fam,5’端標記有熒光淬滅基團bhq1。本發明還提供一種特異性結合hiv-1病毒的引物對,所述引物對由上游引物和下游引物組成,所述上游引物包含seqidno.3所示的核苷酸序列,所述下游引物包含seqidno.2所示的核苷酸序列::seqidno.3gacagcagtacaaatggcag。優選的,所述上游引物的核苷酸序列如seqidno.3所示,所述下游引物的核苷酸序列如seqidno.2所示。本發明還提供一種用于檢測hiv-1病毒的探針(在本文中又稱為“taqman探針”),所述探針包含seqidno.1所示的核苷酸序列。優選的,所述探針的核苷酸序列如seqidno.1所示。還優選的,所述探針的3’端標記有熒光報告基團,所述熒光報告基團為選自fam、hex、texasred、tet、joe、tamra、rox、lcred610、lcred640和cy5中的一種或多種,更優選為fam;所述探針的5’端標記有熒光淬滅基團,所述熒光淬滅基團為選自bhq1、eclipse、bhq3、bhq2、dabcyl和tamra中的一種或多種,更優選為bhq1。本發明所述的引物對和所述的探針用于檢測hiv-1病毒,所述hiv-1病毒優為人源hiv病毒。基于上述引物對和/或所述探針,本發明提供了兩種檢測hiv-1病毒的方法:方法一,利用上述特異性的序列如seqidno.1所示的hfman引物和序列如seqidno.2所示的所述下游引物,采用高保真dna聚合酶、反轉錄酶、四種核苷酸單體(dntp)等成分,應用rt-pcr技術實現待測定hiv-1病毒靶核苷酸序列的核酸片段擴增。其中,所使用的hfman引物的兩端分別標記熒光報告基團(r)和熒光淬滅基團(q)。在pcr擴增前,報告基團發射的熒光信號被淬滅基團所吸收;當有目的基因時,hfman引物就會與之結合,高保真dna聚合酶(具有3′→5′外切酶活性)對hfman引物3’末端修飾的熒光報告基團進行識別和切割,使pcr反應正常擴增;同時由于切割作用,熒光報告基團遠離淬滅基團,就會產生熒光信號,熒光信號就可以由儀器檢測到,并且熒光信號量的變化與擴增產物量成正比,從而判定待測樣本中靶核苷酸序列的存在。方法二,利用上述特異性的序列如seqidno.3所示的上游引物、序列如seqidno.2所示的下游引物和所述特異性taqman探針,采用taq酶(耐熱dna聚合酶)、反轉錄酶、四種核苷酸單體(dntp)等成分,同樣也應用rt-pcr技術實現待測定hiv-1病毒靶核苷酸序列的核酸片段擴增。其中,所使用的taqman探針為兩端分別標記熒光報告基團(r)和熒光淬滅基團(q)的寡核苷酸。在探針完整時,報告基團發射的熒光信號被淬滅基團所吸收,而在pcr擴增過程中,taq酶的5’端外切酶活性將特異性結合在靶核苷酸片段上的熒光探針酶切降解,使熒光報告基團游離于反應體系中。由于脫離了熒光淬滅基團的屏蔽作用,該熒光報告基團的熒光信號就可以由儀器檢測到,并且熒光信號量的變化與擴增產物量成正比,從而判定待測樣本中靶核苷酸序列的存在。在本發明中,熒光標記的序列如seqidno.3所示的核苷酸序列,既可以作為方法一的探針,又可以作為方法二的上游引物。與方法二比較,方法一省去了特異性探針,因此更簡潔,是本發明優選的方法。因此,本發明提供一種用于以實時熒光定量rt-pcr檢測樣品中hiv-1病毒的試劑盒,所述試劑盒包括:(1)上述的序列如seqidno.1所示的hfman引物和序列如seqidno.2所示的所述下游引物。明顯的,該試劑盒適用于所述方法一。本發明提供還一種用于以實時熒光定量rt-pcr檢測樣品中hiv-1病毒的試劑盒,所述試劑盒包括:(1)上述的序列如seqidno.3所示的所述上游引物和序列如seqidno.2所示的所述下游引物;(2)上述的taqman探針。顯然,該試劑盒適用于所述方法二。優選的,上述兩種試劑盒還包括以下中的一種或多種:(a)dntps;(b)pcr反應緩沖液;(c)mg2+;(d)高保真dna聚合酶或taq酶;(e)反轉錄酶;進一步優選地,上述試劑盒還包括以下中的一種或多種:(f)樣品rna提取試劑;(g)陰性質控品,為水,優選為depc水;和(h)陽性質控品,為hiv-1病毒rna片段,優選為1×105拷貝/μl的hiv病毒rna片段。優選的,所述高保真dna聚合酶是具有3’-5’外切酶活性的dna聚合酶,為選自pfudna聚合酶、hsdna聚合酶、kod酶、q5tm超保真dna聚合酶、phi9dna聚合酶和klenow酶中的一種。優選的,所述樣品為選自全血、血漿、淋巴細胞富集液、外周血淋巴細胞和濾紙干血斑中的一種或多種。所述樣品rna提取試劑可以是酚/氯仿/異戊醇法所使用的試劑,也可以是商購的rna提取試劑。優選的,在采用所述試劑盒進行hiv-1病毒檢測時,rt-pcr擴增的反應體系以25μl計包含如下主要組分:(1)上述的引物對的熒光標記的上游引物(hfman引物)0.1μmol/l;(2)上述的引物對的下游引物0.4μmol/l;(a)高保真dna聚合酶0.5u(b)反轉錄酶3.5u;(c)水,優選為depc水,將反應體系補至25μl。除上述主要成分外,實現本發明所述rt-pcr反應,還需要其它成分,如pcr反應緩沖液、dntps、mg2+等,這些組分和高保真dna聚合酶一起可以采用商業化的預混液,如2×pcrmastermix。或者所述rt-pcr擴增的反應體系以25μl計包含如下主要組分,(1)上述的序列如seqidno.3所示的所述上游引物和序列如seqidno.2所示的所述下游引物各0.4μmol/l;(2)上述的taqman探針0.1μmol/l;(a)taq酶2.5u;(b)反轉錄酶3.5u;(c)水,優選為depc水,將反應體系補至25μl。除上述主要成分外,實現本發明所述rt-pcr反應,還需要其它成分,如pcr反應緩沖液、dntps、mg2+等,這些組分可以和taq酶一起采用商業化的預混液,如2×taqpcrmastermix。優選的,所述rt-pcr的擴增反應條件為:50℃逆轉錄30min,1個循環;92℃3min,1個循環;92℃10s,55℃-68℃30s,45個循環。上述55℃-68℃為rt-pcr擴增的復性和延伸階段,在此階段采集熒光信號。本文提供的試劑盒的檢測原理是:利用上述熒光標記的特異性引物,或者一對非熒光標記的特異性引物和一個特異性熒光探針,在包含逆轉錄酶、高保真dna聚合酶(或taq酶)、脫氧核糖核苷三磷酸以及鎂離子等rt-pcr反應緩沖液中,擴增待檢測樣品中的hiv-1病毒,通過多種市售熒光pcr擴增儀實現靶核苷酸的循環擴增和實時監測,從而快速、靈敏地檢測樣品中的hiv-1病毒。與現有技術相比,本發明的技術方案具有以下優點:(1)本發明對大量hiv-1基因組序列進行比較分析,針對hiv-1病毒基因組中相對保守的整合酶(in)序列區段,進行引物和探針的設計和篩選,避免了假陰性結果的產生。(2)本發明提供的引物對于hiv-1的rna發生特異性擴增,而對含其它病毒的檢測樣本均無擴增信號,說明其具有良好的特異性。(3)本發明以特異性的引物對為基礎,提供了兩種實時熒光rt-pcr檢測方法,其一是遵循引物對-熒光探針的思路,其二是首次創新性地對上游引物進行熒光標記,而后將熒光標記的上游引物和非熒光標記的下游引物組成引物對用于hiv-1病毒的檢測。本發明提供的引物對-探針的檢測靈敏度為300個拷貝/反應,令人意想不到的是,本發明的熒光引物對的檢測靈敏度達到30個拷貝/反應。另外,在下面的實施例6中示出的臨床檢測應用中,引物-探針的試劑盒出現了假陰性的檢測結果,而熒光引物的試劑盒7份陽性血液樣品全部檢測出了病毒載量。說明本發明提供的熒光引物rt-pcr試劑盒避免了引物-熒光探針的假陰性,提高了檢測的準確性,改進了引物-熒光探針試劑盒的不足。本發明為實時熒光rt-pcr檢測hiv-1病毒提供了一種設計更簡潔、反應體系組成更簡單、成本更低、靈敏度更高的新思路。(4)由于本發明采用熒光rt-pcr技術作為檢測方法,整個反應均在封閉的反應管內進行,避免了其他核酸檢測方法如pcr-電泳等易于形成氣溶膠污染而造成假陽性結果。并且,由于對rt-pcr產物進行實時監測,大大節省了監測時間,節約了人力物力。(5)本發明提供的試劑盒,可以用于快速、高通量檢測hiv-1病毒,大大縮短檢測周期,在控制人和非人源性相關生物制品的質量及進出口動物檢驗檢疫領域中具有較大的實際意義,能夠保證相關生物制品的品質,控制hiv病毒的傳播。本發明提供的試劑盒可用于臨床病人和生物制品中hiv-1病毒的檢定,應用前景廣闊。附圖說明下面結合附圖對本發明做進一步的說明。圖1顯示了實施例3中檢測hiv-1病毒拷貝數的靈敏度的熒光rt-pcr擴增圖;其中圖1a是實施例1的反應體系和方法測出的擴增圖,圖1b是實施例2的反應體系和方法測出的擴增圖。圖2顯示了實施例4中檢測引物特異性的熒光rt-pcr擴增圖,其中標號為1、2和3的曲線是分別hiv-ae、hiv-b和hiv-bc的擴增曲線。圖3顯示了實施例5建立的定量檢測hiv病毒標準曲線,其中:“■”代表實施例1建立的反應體系,標準曲線的線性方程為:y=-3.546x+43.596,r2=0.9986;“▲”代表代表實施例2建立的反應體系,標準曲線的線性方程為:y=-3.565x+39.599,r2=0.999。圖4顯示了實施例6中本發明的兩種試劑盒臨床檢測hiv-1病毒載量的結果,其中“■”代表試劑盒i,“□”代表試劑盒ii。圖5顯示了實施例7中本發明的試劑盒ii與羅氏hiv-1商業化試劑盒檢測hiv-1病毒載量結果比較,其中:圖5a是兩種試劑盒檢測結果的回歸曲線,圖5b是兩種試劑盒檢測結果的bland-atlman分析,上下兩條虛線代表95%一致性界限的上下限,95%一致性界限為1.03和-1.13log10copies/ml,中間實線代表檢測結果差值的均數。圖6顯示了實施例8中本發明的試劑盒i和試劑盒ii在abi7900ht熒光定量機器上的熒光rt-pcr擴增圖;其中圖6a是試劑盒i的擴增圖,圖6b是試劑盒ii的擴增圖。具體實施方式以下參照具體的實施例來說明本發明。本領域技術人員能夠理解,這些實施例僅用于說明本發明,其不以任何方式限制本發明的范圍。應理解,在本發明范圍內中,本發明的上述各技術特征和在下文(如實施例)中具體描述的各技術特征之間都可以互相組合,從而構成新的或優選的技術方案。限于篇幅,在此不再一一累述。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的藥材原料、試劑材料等,如無特殊說明,均為市售購買產品。其中一些試劑的制造商信息如下:2×taqmastermix:天根生化科技(北京)有限公司;2×mastermix:neb公司;逆轉錄酶(amvrtase):生工生物工程(上海)股份有限公司。實施例1引物和探針設計以及反應體系的建立和優化1.引物和探針的設計:獲得genbank所有hiv-1的整合酶基因序列,進行序列比對以及序列分析,尋找保守區域,選擇了hiv-1病毒保守性較高的序列4606bp-4970bp區段,基于此進行引物設計。體外轉錄:hiv-1病毒質粒模板(pgh-newvector)由上海捷瑞生物工程有限公司合成,序列為4606bp-4970bp區段,序列如seqidno:4所示,用特異性引物對hiv病毒質粒模板進行擴增,擴增產物用2%的瓊脂糖凝膠進行電泳分析,確定大小正確后對目的條帶切膠回收,純化的rna產物就可作為體外轉錄的模板。體外轉錄使用promega的“ribomaxlargescalernaproductionsystem-t7”試劑盒,反應過程采用試劑制造商提供的方法。體外轉錄rna產物使用nanodrop進行濃度和純度測量,將單位換算成copies/μl(拷貝/μl)。為避免rna反復凍融,取適量稀釋至1×1010copies/μl進行分裝,并置-80℃保存。對設計出的多對引物和探針用所建立的rt-qpcr(syto9染料法)檢測體系進行篩選,得到特異性強、靈敏度高的最優引物對、探針組合,核苷酸序列如下:上游引物(seqidno.3):gacagcagtacaaatggcag;下游引物(seqidno.2):taaacccgaaaattttgaatt;taqman探針(seqidno.1):ggggtacagtgcaggggaaagaa。對所述探針的核苷酸序列進行熒光標記,其中3’端標記熒光報告基團fam,5’端標記熒光淬滅基團bhq1,得到熒光標記的taqman探針:taqman探針:5’-bhq1-ggggtacagtgcaggggaaagaa-fam-3’2.基于taqman探針的實時熒光rt-pcr反應體系的建立和優化:hiv-1病毒rna片段由中科院上海巴斯德研究所體外反轉錄合成。2.1引物濃度的優化在反應體系中,將hiv-1的引物濃度分別從0.4μmol/l至0.1μmol/l作倍比連續稀釋后進行檢測,通過試驗結果的分析比較,確定最佳引物終濃度為0.4μmol/l。2.2taqman探針濃度的優化在反應體系中,將hiv-1的探針濃度分別從0.4μmol/l至0.1μmol/l作倍比連續稀釋后進行檢測,通過試驗結果的分析比較,確定最佳探針終濃度為0.1μmol/l。利用上述引物(非熒光標記)、taqman探針進行反應體系的建立,最后確定采用的實時熒光rt-pcr反應體系為25μl體系,所需各組分及相應濃度見表1。表1優化后的引物(非熒光標記)-探針rt-pcr反應體系組分終濃度上游引物(seqidno.3)0.4μmol/l下游引物(seqidno.2)0.4μmol/ltaqman探針(seqidno.1)0.1μmol/l2×taqmastermixa1×反轉錄酶3.5urna模板3μl在加入模板后,補水至25μla:2×taqmastermix,含有2×taq酶(在上述反應體系中的終濃度為2.5u)、2×pcr反應緩沖液、2×dntps、mg2+。本領域技術人員應當知曉:在熒光rt-pcr反應體積不同時,各試劑應按比例調整;使用的儀器不同,應將反應參數作適當調整。3.儀器檢測通道的選擇:在進行熒光rt-pcr反應時,應對所用儀器中反應管熒光信號的收集進行設置,選擇的熒光檢測通道與探針所標記的熒光報告基團一致。具體設置方法因儀器而異,應參照儀器使用說明書。4.優化的rt-pcr條件如下:50℃逆轉錄30min,1個循環;92℃3min,1個循環;92℃10s,55℃-68℃,30s,45個循環;在55℃-68℃復性和延伸階段采集熒光信號。實施例2熒光標記引物的設計和反應體系的建立和優化1.熒光標記引物的設計在實施例1設計得到的一對特異性引物和探針的基礎上,經試驗發現,以taqman探針(熒光標記)為上游引物,和核苷酸序列如seqidno.2所示的下游引物組成引物對,不僅可以實現特異性靶核苷酸的擴增,并且熒光信號量的變化與擴增產物量成正比。因此,本實施例的熒光rt-pcr反應體系僅包括熒光標記的上游引物(hfman引物)和下游引物,核苷酸序列為:hfman引物:5’-bhq1-ggggtacagtgcaggggaaagaa-fam-3’;下游引物(seqidno.2):taaacccgaaaattttgaatt。2.反應體系的建立和優化步驟同實施例1的“2.反應體系的建立和優化”。最后確定采用的熒光rt-pcr反應體系為25μl體系,所需各組分及相應濃度見表2。表2優化后的熒光標記引物rt-pcr反應體系a:2×mastermix含有2×高保真dna酶(在上述反應體系中的終濃度為0.5u)、2×pcr反應緩沖液、2×dntps、mg2+。本領域技術人員應當知曉:在熒光rt-pcr反應體積不同時,各試劑應按比例調整;使用的儀器不同,應將反應參數作適當調整。3.儀器檢測通道的選擇:同實施例1的“3.儀器檢測通道的選擇”。4.優化的rt-pcr條件同實施例1的“4.優化的rt-pcr條件”。實施例3實施例1和實施例2建立的反應體系和實時熒光rt-pcr方法檢測hiv-1病毒的拷貝數的靈敏度試驗使用無rnase的h2o分別對hiv-1病毒體外轉錄得到的rna模板進行梯度稀釋,得到濃度依次為1×107、1×106、1×105、1×104、1×103、1×102、1×101和1×100拷貝/μl的rna模板,分別使用實施例1和實施例2中1-4步驟設計的引物、探針以及建立的優化反應體系和擴增條件,分別在roche(lightcycle96)熒光機器上進行實時熒光rt-pcr檢測。結果表明,rna模板的濃度為1×107、1×106、1×105、1×104、1×103、1×102和1×101拷貝/μl時,實施例1和實施例2的反應體系都出現了擴增曲線,說明兩個反應體系的靈敏度較高。實施例1的反應體系和方法,檢測300個拷貝/反應(3×102拷貝)和30個拷貝/反應(3×101拷貝)時,擴增曲線幾乎一樣,見圖1a。而實施例2的反應體系和方法在cq值<45,熒光閾值0.05以上,出現了明顯的“對數曲線s”形狀擴增曲線,表示hiv-1病毒在該濃度下有擴增;用該方法可以檢測出30個拷貝/反應(3×101拷貝),見圖1b。說明實施例2的反應體系和方法靈敏度比實施例1更高。結果見圖1a和圖1b。另外,從圖1a和圖1b也可以看出,在相同拷貝數下,實施例2的方法檢測出的擴增曲線(圖1b所示出)也明顯好于實施例1的擴增曲線(圖1a所示出)。說明實施例2的方法對hiv-1的擴增效果更好。實施例4本發明設計的引物特異性評估試驗樣品:(1)健康人血液rna(2)hiv3種亞型:hiv-b、hiv-ae、hiv-bc(3)rsva(vr-26)(4)rsvb(vr-1580)(5)ev(6)adenovirus(vr-930)(7)p2v3(8)hcov-229e(vr-740)(9)hcov-oc43(vr-1558)第(2)-(9)的病毒株均由上海巴斯德研究所提供,購自atcc公司。使用實施例2建立的反應體系和實時熒光rt-pcr方法分別在roche(lightcycle96)熒光機器上對上述待測樣品進行檢測。結果見圖2和表3。表3本發明的引物特異性試驗結果圖2和表3都示出,本發明設計的引物僅對hiv的rna發生擴增,在pcr反應結束后,有“s”形擴增曲線,對含其它病毒的檢測樣本均沒有擴增信號,說明本發明所述引物具有很高的特異性。實施例5實施例1和實施例2反應體系定量檢測hiv-1病毒標準曲線的建立使用無rnase的h2o分別對hiv病毒體外轉錄得到的rna模板進行梯度稀釋,得到濃度依次為1×107、1×106、1×105、1×104、1×103、1×102拷貝/μl的rna模板,使用實施例1和實施例2優化好的最佳體系和步驟,分別在roche(lightcycle96)熒光機器上進行檢測,并進行標準曲線制作。實驗結果如圖3所示,兩種方法檢測hivrna在107-102拷貝/μl間都有很好的線性關系。其中,實施例1的實時熒光定量方法檢測hiv標準曲線線性方程為:y=-3.546x+43.596,r2=0.9986。實施例2的實時熒光定量方法檢測hiv標準曲線線性方程為:y=-3.565x+39.599,r2=0.999。兩種方法檢測hiv的線性系數都接近于1,表明線性關系都很好,且兩者的擴增效率分別為1.95和2.01。實施例6本發明的試劑盒在臨床檢測中的應用1.樣本:7份hiv陽性臨床血液樣本。樣本處理:離心分離血漿,-80℃冰箱保存待測。2.檢測條件試劑:本發明提供的試劑盒i,包括:(1)實施例1所述的上游引物和下游引物;(2)taqman探針;(3)dntps(含dutp);(4)pcr反應緩沖液;(5)mg2+;(6)taq酶;(7)反轉錄酶;和(8)hiv-1病毒rna提取試劑,為qiagenviralrnaminikit的rna提取試劑盒。本發明提供的試劑盒ii,包括:(1)hfman引物;(2)實施例1中所述的下游引物;(3)dntps(含dntp);(4)10×pcr反應緩沖液;(5)mg2+;(6)高保真nda聚合酶;(7)反轉錄酶;和(8)hiv-1病毒rna提取試劑,為qiagenviralrnaminikit的rna提取試劑盒。儀器:roche(lightcycle96)熒光定量儀。3.反應模板的提取每個樣品取140μl的血漿,使用qiagenviralrnaminikit對樣本進行hiv病毒rna抽提,最后用60μl的無核酸酶的水進行洗脫,洗脫液即為反應模板。4.檢測程序實時熒光qrt-pcr反應體系為25μl體系,主要組分濃度見表4,其它組分來源于適宜的商購pcr預混液。表4rt-pcr反應體系在roche(lightcycle96)熒光機器上進行檢測。rt-pcr條件為:50℃逆轉錄30min,1個循環;92℃3min,1個循環;92℃10s,55℃-68℃,30s,45個循環;在55℃-68℃復性和延伸階段采集熒光信號。5.檢測結果兩種試劑盒病毒載量檢測結果如圖4所示(病毒載量是指每毫升血漿中病毒顆粒的數量)。從圖4中可看出,試劑盒i檢測出了4個樣本,出現了假陰性結果;試劑盒ii檢測出了全部7個樣本。而且采用試劑盒ii檢測出的病毒載量要稍微高于試劑盒i檢測的結果。上述結果說明,試劑盒的特異性和準確性高于試劑盒i。實施例7試劑盒ii和商業化試劑盒的比較21份hiv陽性臨床樣品(包括b、ae、bc三種hiv類型),每個樣品分為兩份,一份經羅氏cobasampliprep/cobastaqman系統進行自動化抽提和病毒載量測定。另一份經過與實施例6相同的方法抽提rna并制作反應模板,采用實施例6中的試劑盒ii進行病毒載量檢測,將兩次的結果進行如下比較。1.以試劑盒ii檢測的病毒載量結果橫坐標,羅氏商業試劑盒的檢測結果為縱坐標,將兩種方法測定的病毒載量結果進行線性回歸分析,結果見圖5a。兩種方法的線性公式為:y=0.835x+0.707,r2=0.7859;表明兩者相關性較大。2.對兩種方法檢測結果進行bland-altman分析。用橫軸表示兩種方法病毒載量檢測結果的平均值,縱軸表示兩種方法病毒載量檢測結果的差值,結果見圖5b。21份樣品中20份樣品兩種方法測定的差值都在95%一致性界限內。說明兩種方法測定的結果一致性好。以上結果表明,兩種方法的檢測效果相當,說明本發明的rt-qpcr體系和方法的靈敏性、準確率和檢測效果均佳。實施例8試劑盒i和試劑盒ii在abi7900ht熒光定量機器上的應用在abi7900ht熒光定量機器上,分別使用實施例6中的試劑盒i和試劑盒ii,待測樣品為體外轉錄的hiv的rna標準品(107和106拷貝/ul)檢測結果見圖6a和圖6b。圖6示出,兩種試劑盒在abi7900ht熒光定量機器都示出了擴增曲線。說明本發明的rt-qpcr體系和方法適用范圍廣,可以應用于多種熒光定量儀(機器)。在本發明提及的所有文獻都在本申請中引用作為參考,就如同每一篇文獻被單獨引用作為參考那樣。此外應理解,在閱讀了本發明的上述講授內容之后,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落于本申請所附權利要求書所限定的范圍。序列表<110>張夢玲<120>一種用于以實時熒光rt-pcr檢測樣品中hiv-1病毒的引物對和包含其的試劑盒<130>2017140<160>4<170>patentinversion3.3<210>1<211>23<212>dna<213>人工序列<400>1ggggtacagtgcaggggaaagaa23<210>2<211>21<212>dna<213>人工序列<400>2taaacccgaaaattttgaatt21<210>3<211>20<212>dna<213>人工序列<400>3gacagcagtacaaatggcag20<210>4<211>227<212>dna<213>hiv-1病毒基因序列<400>4caggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaaga60aaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagac120atacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattac180agggacagcagagatccagtttggaaaggaccagcaaagctcctctg227-1-當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 一種轉基因鮭魚AquAdvantage品系特異性實時熒光PCR檢測引物、檢測方法和試劑盒與流程
- 犬圓環病毒的實時熒光PCR檢測用引物及檢測方法與流程
- 用于熒光學圖像的檢測和實時顯示的熒光學系統的制作方法與工藝
- 用于熒光學圖像的檢測和實時顯示的熒光學系統的制作方法與工藝
- 利用單拷貝核基因檢測食品和飼料中牛源性成分的實時熒光PCR檢測方法與流程
- H10N7禽流感病毒的實時熒光PCR檢測試劑盒及檢測方法與流程
- 多重實時熒光PCR檢測Cr(VI)還原復合菌群六種功能基因的方法與流程
- 刺莧的實時熒光PCR鑒定方法與流程
- 一種豬肺炎支原體的實時熒光PCR檢測試劑盒及其用途的制作方法與工藝
- 實時熒光PCR特異性檢測遠志的引物及檢測方法與流程
- 一種特異性引物檢測鼠源性成分的方法與制造工藝
- 一組用于驢源性的實時熒光PCR檢測的特異性引物和探針的制造方法與工藝
- 一組用于雞源性實時熒光PCR檢測的特異性引物和探針的制造方法與工藝
- 一種燕窩制品的實時熒光定量PCR鑒定試劑盒及其鑒定方法與制造工藝
- 一種具有移液功能的熒光定量PCR儀的制造方法與工藝
- 一種基于多災種實時耦合的化工園區實時定量風險評估方法與制造工藝
- 一種實時熒光定量PCR檢測方法及其標準品和檢測試劑盒與制造工藝
- 檢測外周血CAR?T細胞的TaqMan實時熒光定量PCR試劑盒的制造方法與工藝
- 一種實時熒光定量PCR檢測土壤西瓜枯萎病菌的方法及引物與制造工藝
- 一種基于反射鏡的熒光定量PCR的檢測系統的制造方法與工藝
- 一種基于熒光定量PCR鑒定嚙齒類螺桿菌的引物、試劑盒及鑒定方法與流程
- 一種檢測包含潛伏期結核感染的試劑盒及其引物對和探針的制造方法與工藝
- 用于甜瓜果實基因PCR表達分析的內參基因及該內參基因的穩定性驗證方法與流程
- 一種特異性引物檢測鼠源性成分的方法與制造工藝
- 一組用于驢源性的實時熒光PCR檢測的特異性引物和探針的制造方法與工藝
- 一組用于雞源性實時熒光PCR檢測的特異性引物和探針的制造方法與工藝
- 一種燕窩制品的實時熒光定量PCR鑒定試劑盒及其鑒定方法與制造工藝
- 一種具有移液功能的熒光定量PCR儀的制造方法與工藝
- 一種基于多災種實時耦合的化工園區實時定量風險評估方法與制造工藝
- 一種實時熒光定量PCR檢測方法及其標準品和檢測試劑盒與制造工藝