一種快速定量檢測芽孢桿菌發酵液中營養體和芽孢體的方法與流程
本發明具體涉及一種快速定量檢測芽孢桿菌發酵液中芽孢體和營養體的方法,特別是基于芽孢體和營養體細胞中NADH的差別實現兩種不同形態細胞的快速定量測定,屬于微生物發酵和檢測技術領域。
背景技術:
芽孢桿菌是一類好氧或兼性厭氧并能夠產生具有抗逆性的內生孢子的桿狀細菌,因為芽孢桿菌的芽孢特性使其能夠對熱、紫外線、輻射等不利條件有很強抗性。芽孢桿菌中具有很多特殊功能的菌株,在實際應用中具有較大價值。有的菌株能分泌多種酶類,是酶制劑的良好來源;大部分菌株與動植物關系密切互惠共生,可以用于益生菌制劑和菌肥;有的還可以用于生產微生物農藥;芽孢桿菌還能在農藥降解、污染凈化等環保領域發揮重要作用。
在應用芽孢桿菌進行發酵生產時,都需要監控芽孢桿菌的生長代謝和菌體細胞累積情況,而基于芽孢桿菌特殊的生理特征,在生長后期、營養缺乏或者產物抑制等情況下芽孢桿菌發酵時伴隨有大量芽孢體產生,某些發酵調控需要盡可能減少芽孢的生產,如酶制劑的擴大生產;而有些則需要創造條件促進芽孢積累,如芽孢類益生菌的制備。無論哪種情況均需要對發酵基質中的芽孢和營養體分別進行定量測定,通常其測定方法也均是參照普通細菌總數的測定方式,即傳統的平板計數法,培養周期長,人為誤差較大,干擾因素比較多。對于芽孢桿菌而言,傳統方法無法特異性將芽孢體和營養體區分開,實際操作時一般根據芽孢的耐熱性通過加熱處死營養體后再進行平板計數來定量測定芽孢,加熱的過程本身亦會促進營養體向芽孢體的轉變,因此,對芽孢桿菌的定量測定而言,常規的測定操作更繁瑣,誤差更大,不適合現場實時檢測。
目前已有其他替代技術應用各種微生物快速檢測,如PCR技術、ELISA法、基因芯片技術、生物傳感法、免疫熒光技術以及基于菌體特定的熒光分子的生物熒光法(ATP、NADH)等。這些手段大大提高了檢測速度,并具有一定的靈敏性,但這些方法缺乏通用性,需要昂貴的儀器及其配套試劑,或者操作過程相對復雜,推廣應用難度較大。尤其對于芽孢桿菌而言,缺乏特異性的區分其營養體和芽孢體的檢測方法和技術。
技術實現要素:
本發明提供了一種從芽孢桿菌發酵液中快速定量檢測芽孢體和營養體的方法,該方法能有效區分芽孢和營養體細胞,而且方法簡單,靈敏度高,重現性好。
實現本發明上述目的所采用的技術方案為:
一種快速定量檢測芽孢桿菌發酵液中營養體和芽孢體的方法,包括以下步驟:(1)將待測的芽孢桿菌發酵液離心、洗滌并重懸到緩沖液中,充分混勻后得到菌懸液;
(2)量取菌懸液,對菌懸液中的NADH進行提取,提取液采用濃度為1.5~2mol/L的KOH乙醇溶液,將提取液與菌懸液按照不小于3:1的體積比充分混合均勻,加熱至80~90℃,在此溫度下處理30~60分鐘,處理完畢后離心取上清液,檢測上清液中NADH的熒光強度,記錄檢測結果;
(3)再次量取步驟(1)中的菌懸液,將其放在含有外在萌發劑的培養基中進行培養,培養至菌懸液中的芽孢體充分萌發變成營養體,然后采用與步驟(2)中相同的方法對培養后的菌懸液中的NADH進行提取,并檢測上清液中NADH的熒光強度,記錄檢測結果;
(4)取已知初始活菌濃度的營養體懸液,分別進行稀釋,然后采用步驟(2)與步驟(2)中相同的NADH提取及熒光強度檢測方法,作出活菌濃度與NADH熒光強度的關系曲線,并以此曲線作為標準曲線分別計算出步驟(2)和步驟(3)中熒光強度檢測結果所對應的活菌濃度值,其中步驟(2)所對應的活菌濃度值即為營養體濃度值,將步驟(3)所對應的活菌濃度值減去步驟(2)所對應的活菌濃度值即為芽孢體濃度值。
所述的熒光強度檢測中的檢測參數為:掃描速度3000nm/min;EX狹縫10.0nm;EM狹縫20.0nm;光電倍增管電壓400V;響應0.08s;激發波長為344nm,發射波長為456nm。
步驟(3)中所述外在萌發劑為含有L-Ala,L-Gln,L-Val等營養性萌發劑的液體培養基。
步驟(4)中標準曲線的具體繪制方法為:取OD600nm為0.8的營養體懸液,采用平板稀釋法進行平板活細胞計數,確定其初始的活菌濃度,以確定活菌濃度的營養體懸液為基礎,分別進行2倍、10倍、20倍、100倍、200倍、1000倍梯度稀釋,對稀釋的菌懸液進行NADH提取和熒光檢測,空白為Tris-HCl緩沖液,從而根據檢測結果作出活菌濃度與NADH熒光強度的關系曲線。
本申請中,由于還原性輔酶煙酰胺腺嘌呤二核苷酸(NADH)廣泛穩定存在于活細胞中,其較強的自發熒光特性常被用作指示物來研究細胞的代謝變化;對于特定活細胞而言,NADH的胞內水平保持恒定,通過測定NADH水平的方法亦可用于反映活細胞的數量。對于芽孢桿菌而言,其孢子中是不存在NADH的,隨著芽孢的萌發產生營養體,細胞內NADH含量隨之上升,直到芽孢徹底萌發成營養體后達到穩定,因此,NADH穩定存在于芽孢的營養體細胞中,通過檢測細胞內的NADH的水平實際上就實現了芽孢桿菌營養體總數水平的測定。因此在本申請中采取芽孢萌發激發的方法,在不改變活細胞濃度的前提下,用萌發劑促使芽孢萌發轉變為營養體,通過檢測細胞從芽孢體萌發生產營養體過程中NADH的變化量來換算成生產的營養體濃度,得到的濃度實際也就能間接反映樣品中芽孢的濃度。與現有技術相比,本發明所提供的檢測方法能有效區分芽孢和營養體細胞,方法簡單,靈敏度高,重現性好,可適用于基于芽孢桿菌純培養的發酵體系,尤其是以芽孢桿菌作為發酵劑生產微生態制劑,能實現發酵過程監控或者終端產品的快速測定。
附圖說明
圖1為1nM-1000nM范圍內NADH濃度與相應熒光強度標準曲線圖;
圖2為芽孢桿菌營養體不同OD值與提取的NADH熒光強度關系曲線;
圖3為芽孢桿菌營養體不同活菌濃度值與提取的NADH熒光強度關系曲線;
圖4為培養時間對芽孢萌發生長的影響;
圖5為芽孢在萌發生長初期受到L-Ala萌發激發后NADH在胞內積累的影響。
具體實施方式
下面結合具體實施例對本發明做詳細具體的說明,但是本發明的保護范圍并不局限于以下實施例。
本申請中首先需要對菌懸液中的營養體細胞進行最大限度提取,經過實驗確定了以下最佳提取方法和條件:用1.5mol/L~2mol/L KOH/乙醇(體積分數50%)的提取液按照3:1的比例與菌體的Tris-HCl菌懸液充分混合,在80℃的水浴鍋處理細胞30min,6000r/min離心20min取上清液,將上清液立即進行NADH的熒光強度檢測即可。
本申請中設定NADH的熒光強度最佳檢測條件參數:掃描速度3000nm/min;EX狹縫10.0nm;EM狹縫20.0nm;光電倍增管電壓400V;響應0.08s;激發波長為344nm,發射波長為456nm。并對此參數進行驗證:準確稱取NADH純品0.071g,用Tris-HCl緩沖液(20mM,pH 8.0;下同)定容至100mL。配制成1mM的NADH母液。用Tris-HCl緩沖液稀釋母液使其濃度為1nM~1000nM之間。在設定的參數基礎上,測定不同標準濃度NADH溶液對應的熒光強度,并做相應的NADH標準曲線,如圖1所示,有圖1可以看出曲線的線性良好,相關系數R2為0.999。
接著驗證OD600nm值與NADH熒光強度的線性關系:
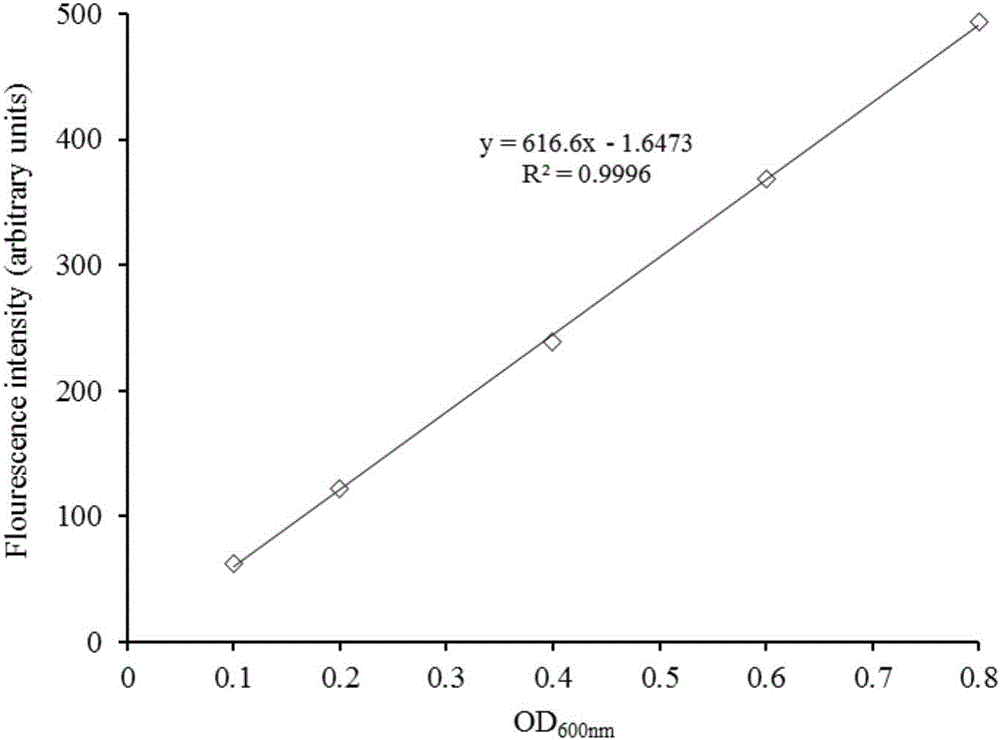
在LB培養基的基礎上添加2g/L谷氨酰胺和50g/L葡萄糖,谷氨酰胺和葡萄糖能最大限度減少芽孢的產生。將活化的芽孢桿菌接種到LB液體培養基中振蕩好氧培養12h,取樣涂片經顯微鏡顯微觀察確保菌懸液均為營養體后,將菌液4℃下經8000r/min離心5min處理,收集菌體,用Tris-HCl緩沖液洗滌兩次后并懸浮在Tris-HCl緩沖液中制成營養體懸液。以高濃度的營養體Tris-HCl懸液為基礎,分別用Tris-HCl做稀釋劑進行稀釋,獲得OD600nm值分別為0.1、0.2、0.4、0.6、0.8五個梯度的菌懸液,分別進行NADH的提取和熒光檢測,空白為Tris-HCl緩沖液,做OD600nm與NADH熒光強度的關系曲線,如圖2所示,從圖2中可以看出其線性良好,相關系數R2為0.9996。
最后對標準曲線進行繪制,取OD600nm為0.8左右的營養體Tris-HCl懸液,采用普通的平板稀釋法進行平板活細胞計數,確定其初始的活菌濃度(CFU/mL),以確定活菌濃度初始菌懸液為基礎,分別進行2倍、10倍、20倍、100倍、200倍、1000倍梯度稀釋,對稀釋的菌懸液進行NADH提取和熒光檢測,空白為Tris-HCl緩沖液,作活菌濃度與NADH熒光強度的關系曲線,如圖3所示,從圖3中可以看出其線性良好,相關系數R2為0.9998。因此,本申請中可以根據營養體細胞的NADH濃度直接對照標準曲線來定量測定活細胞營養體濃度,檢測限為104CFU/mL。
實施例1
本實施例中首先將待測的芽孢桿菌發酵液采用Tris-HCl緩沖液進行稀釋,并充分混勻后得到菌懸液。量取菌懸液,按照上述方法對菌懸液中的NADH進行提取并進行熒光檢測,記錄檢測結果為AU1。
接下來為確保芽孢在萌發處理過程中不至于顯著生長從而影響到最終的結果測定,芽孢首先用100mM的L-Ala的Tris-HCl溶液預處理3h,待其芽孢徹底萌發后離心,用無菌水洗滌兩次后將萌發后的芽孢懸液接種到LB液體培養基中,37℃振蕩培養,每0.5h取樣一次,測定樣品的OD600nm,檢測結果如圖4所示。從圖4中可以看出在萌發生長處理的1.5h內,菌懸液OD600nm未顯著變化,故以此時間作為實現芽孢最大限度萌發的處理時間,立即取菌懸液做NADH的提取和熒光檢測,檢測結果為AU4;并同時采用L-Ala處理芽孢后的NADH的胞內累積(檢測結果AU2)及芽孢的LB培養基溶液(檢測結果AU3)作實驗對照,結果如圖5所示。從圖5中可以看出僅L-Ala處理在1.5h內不能顯著增加NADH水平,LB培養基溶液能夠促使芽孢轉變為營養體細胞并引起NADH的增加,但含有萌發劑L-Ala的LB培養基的增強作用更強,通過計算在1.5h內芽孢經萌發激發增加的NADH的含量正是溶液中從芽孢轉變為營養體的細胞數量,即:ΔAU=AU4-AU1;通過ΔAU的數值在標準曲線上計算對應的細胞濃度就能實現間接測定芽孢濃度。
與此同時,通過常規的芽孢測定的方法對本實施例中的結果予以驗證,即采用芽孢桿菌的樣品懸液置于80℃水浴高溫處理15分鐘,冷卻后稀釋、涂板、培養和計數,獲得耐受高溫處理的芽孢數。兩種方法檢測的結果如下:
- 還沒有人留言評論。精彩留言會獲得點贊!