包含GM?CSF中和化合物的液體制劑的制作方法
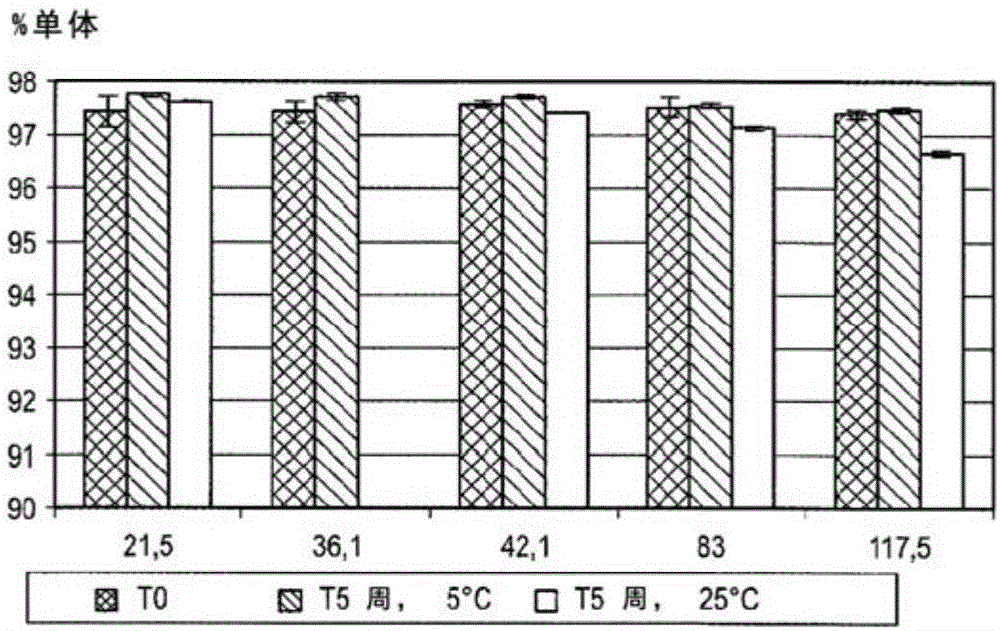
蛋白質在藥品、獸醫產品、化妝品和其他消費品、食品、飼料、診斷、工業化學和去污領域中的廣泛應用中使用。有時,這些用途被蛋白質自身的固有約束所限制,或被它們所應用的環境或介質所迫。這些約束可能導致蛋白質的穩定性差,性能變化或高成本。由于生物技術的出現,可以生產各種用于治療應用的蛋白質。蛋白質藥物在它們被生產后通常在使用前被儲存。由于蛋白質通常比“傳統”藥物更大更復雜這一事實,適合于儲存的蛋白質藥物的配制和加工可能特別具有挑戰性。關于蛋白質藥物制劑和加工設計的綜述,參見Carpenter等人(1997),Pharm.Res.14:969-975;Wang(2000),Int.J.Pharmaceutics203:1-60;以及Tang和Pikal(2004),Pharm.Res.21:191-200。有幾個因素可在設計蛋白質藥物生產的制劑和工藝中予以考慮。首要問題是蛋白質在經過制造、運輸和處理的任意或所有步驟的穩定性,這可以包括所述組合物的制備、冷凍、凍干、干燥、儲存、運輸、重構、凍/融循環,以及最終用戶對其重構后的存儲。其它潛在的考慮事項包括制造、處理和分配的簡易性和經濟性;用于患者施用的最終產品的組成;最終用戶使用的簡易性,其包括凍干制劑在重構時的溶解度。液體制劑可滿足特定目的。液體制劑的潛在優勢包括制造的簡易性和經濟性,以及最終用戶的便利性。通常,當長時間儲存時,多肽在溶液中不穩定(Manning等人(1989),Pham.Res.6:903-918)。因此,已開發額外的加工步驟以允許較長的保質期,包括干燥例如凍干。凍干制劑還可提供某些優勢。凍干的潛在益處包括蛋白質穩定性的改善以及運輸和儲存的簡易性和經濟性的提高。然而,凍干藥物組合物可能對最終用戶不太便利。除了選擇組合物基本形式(如凍干的、液體的、冷凍的等)之外,對蛋白質制劑的最優化通常涉及改變制劑的組分及其各自的濃度以使蛋白質穩定性最大化。多種因素可能影響蛋白質的穩定性,包括離子強度、pH、溫度、凍/融循環、剪切力、冷凍、凍干、干燥、攪拌以及重構。蛋白質的不穩定性可能由物理降解(例如變性、聚集或沉淀)或化學降解(例如脫酰胺作用、氧化或水解)而引起。制劑組分和濃度的最優化僅基于實證研究和/或克服不穩定性來源的合理方法。有時,在含有多肽的藥物組合物(包括水性和凍干制劑)的長期儲存中,活性多肽可能由于聚集和/或降解而丟失。因此,改善多肽穩定性的典型做法可通過改變制劑中要素的濃度或通過加入輔料以改變制劑(美國專利號5,580,856和6,171,586和美國專利申請號US2003/0202972,US2003/0180287)來解決。US5,580,856為公開了可在復水期間或之后添加以穩定干燥蛋白質的試劑的原型專利,所述試劑諸如天然聚合物、表面活性劑、硫酸多糖、蛋白質和緩沖劑。然而,美國專利5,580,856除了給出許多選擇之外,并沒有教導應當為哪種蛋白質添加哪種穩定劑。因此,雖然本領域讀者知道這些選擇,他或她將必須在US5,580,856所描述的許多選項中找出用于他/她的蛋白質的最佳條件。美國專利申請2003/0202972描述了一種抗Her2抗體的穩定的凍干制劑,其中所述穩定劑為糖、海藻糖或緩沖劑。然而,盡管這些穩定劑對抗體可能有用,但它們不能類推至其它蛋白質。美國專利申請2003/0180287類似于US2003/0202972,因為它也描述了一種免疫球蛋白樣蛋白的穩定溶液,即含有Fc結構域的蛋白質。所述穩定劑可以是磷酸鈉、磷酸鉀、檸檬酸鈉或鉀、馬來酸、乙酸銨、Tris-緩沖劑、乙酸鹽、二乙醇胺、組氨酸、賴氨酸或半胱氨酸。在本領域讀者可以選擇的這些化學上不同的穩定劑中,賴氨酸被證明是適合的。然而,如同US2003/0202972,特定穩定劑僅僅適用于特定的蛋白質,在這里是指含Fc結構域的蛋白質,并且本身不能被類推到另一種蛋白質。因此,添加劑的使用不能從特定蛋白質類推到另一種不相關的蛋白質。事實上,添加劑的使用—盡管改善了儲存—仍可導致無活性的多肽。此外,在凍干的情況下,復水步驟可引入通過例如聚集或變性導致多肽失活的條件(Hora等人(1992),Pharm.Res.,9:33-36;Liu等人(1991),Biotechnol.Bioeng.,37:177-184)。實際上,多肽的聚集是不希望的,因為它可能引起免疫原性(Cleland等人(1993),Crit.Rev.TherapeuticDrugCarrierSystems,10:307-377;以及Robbins等人(1987),Diabetes,36:838-845)。在藥物產品的開發和制造過程中,生物活性的維持取決于大分子的固有穩定性,以及所采用的穩定技術。存在一系列的蛋白質穩定技術;包括向蛋白質水溶液或懸浮液中添加化學“穩定劑”。例如,美國專利4,297,344披露了通過添加選定的氨基酸使凝血因子II和VIII、抗凝血酶III、血纖維蛋白溶酶原對熱具有穩定性。美國專利4,783,441披露了一種通過添加表面活性物質來穩定蛋白質的方法。美國專利4,812,557披露了一種通過使用人血清白蛋白來穩定白細胞介素-2的方法。將制備物與冷凍保護劑混合并于非常低的溫度下儲存的凍/融法是穩定蛋白質的另一種選擇。然而,并非所有的蛋白質會在凍/融循環中存活。使用冷凍保護添加劑通常是甘油的冷藏室另一個選擇。還可以采用如美國專利5,098,893所描述的以玻璃形式儲存。這種情況下,蛋白質溶解于無定型態或玻璃態的水溶性或水膨脹性物質中。應用最廣泛的穩定蛋白質的方法是冷凍干燥法或凍干法。每當在水溶液中不能獲得足夠的蛋白質穩定性時,凍干提供了最可行的選擇。凍干法的一個缺點是它需要復雜的加工,耗時且昂貴。此外,如果冷凍干燥不能謹慎實施,大多數制備物通過該技術的冷凍和脫水步驟會至少部分變性。結果是蛋白質分子的一部分經常不可逆聚集,致使制劑對于腸胃外施用上不可接受的。通常而言,文獻中已經詳細描述了蛋白質降解,但是沒有描述中和粒細胞-巨噬細胞集落刺激因子(另稱為GM-CSF)的化合物,特別是多肽和抗GM-CSF抗體的儲存和可溶性。此外,盡管本領域已知蛋白質穩定劑以及允許高濃度蛋白質同時保持穩定的試劑有眾多選擇,但直至本發明,在本領域中沒有意識到包含以高濃度中和GM-CSF的化合物的制劑可能不穩定而因此需要改善。在制備包含蛋白質諸如抗體如單克隆抗體的藥物組合物中,目的在于開發高濃度的液體制劑,這是由于皮下施用具有能使患者更便利的潛力。然而,存在普遍共識,即開發高濃度抗體特別是單克隆抗體制劑對單克隆抗體的物理和化學穩定性提出了嚴峻的挑戰,諸如可溶性以及不溶性聚集體或顆粒的形成的增加會提高免疫源應答的概率并導致低生物活性。液體藥物組合物儲存期間多肽聚集體或顆粒的形成可能會對該多肽的生物活性產生不利影響,導致該藥物組合物治療功效的喪失。此外,聚集體或顆粒的形成可引起其它挑戰,諸如當通過使用輸注系統來施用包含多肽的藥物組合物時造成導管、膜或泵的堵塞。此外,已報道高濃度抗體制劑會導致粘度增加由此給可制造性和注射性造成嚴峻挑戰。高粘度制劑難以制造、吸入注射器和注射。在操作粘性制劑中所使用的力導致過度起沫,這可引起單克隆抗體的變性和失活。因此,非常需要一種穩定的高濃度蛋白質藥物組合物,其包含中和GM-CSF的化合物例如抗體,并具有適合于皮下施用的、低的且可行的粘度,諸如在即用型裝置中。此外,從患者角度看,將非常需要室溫下穩定的產品。目前,尤其是不可能有市售抗體制劑能在藥物產品的整個保質期內于室溫下儲存。典型地,增加的蛋白質聚集的出現導致不可接受的高水平聚集體和蛋白質相關的雜質,這可能引起免疫源性反應。最初被鑒定為造血生長因子的粒細胞-巨噬細胞集落刺激因子(GM-CSF),最近已經被證明是在炎癥和自身免疫中的重要細胞因子。在各種炎癥部位,包括在過敏和銀屑病患者、關節炎和哮喘患者中,測量到GM-CSFmRNA或蛋白質的水平升高。許多體內研究已經表明,在過去幾年中,經由中和抗體來阻斷GM-CSF,可以在多種炎癥模型中預防或甚至治愈促炎性疾病,包括關節炎實驗性自身免疫性腦炎、銀屑病和肺部疾病的模型。因此,非常需要獲得一種含有GM-CSF中和化合物的制劑,即特別是穩定的、包含高含量的GM-CSF中和化合物和/或可以通過皮下途徑施用的制劑。因此,本發明的技術挑戰符合上述需要。本發明滿足了這些需要,并且因此提供了關于制劑以及將這些制劑用于治療患病受試者(將得益于中和GM-CSF的化合物的施用)的方法和用途的實施方案,作為該技術挑戰的一種解決方案。這些實施方案在本文中進行表征并描述,在實施例中闡述并反映在權利要求中。必須注意的是,除非上下文另有明確說明,如本文所用的單數形式“一個”、“一種”以及“該”包括復數指代。因此,例如提及“一種抗體”包括此類不同抗體的一種或多種,提及“該方法”包括指代本領域普通技術人員所公知的可以被修改或替換本文所描述方法的等同步驟和方法。除非另有說明,一系列要素之前的術語“至少”應被理解為是指該系列中的每一個要素。本領域技術人員僅使用常規實驗,將認識到或能夠確定本文所述發明的特定實施方案的許多等同方案。這些等同方案旨在被本發明所涵蓋。貫穿于本說明書和所附權利要求書中,除非上下文另有要求,詞語“包含”及其變體諸如“包括”和“含有”將被理解為暗示包括所述整數或步驟、或整數或步驟的集合,但并不排除任何其它的整數或步驟、或整數或步驟的集合。當在本文中使用時,術語“包含”可被術語“含有”替代,或有時在本文使用時會以術語“具有”替代,或甚至可能被“由…組成”所取代。當在本文中使用時,“由…組成”排除了權利要求要素中未明確提出的任何要素、步驟或成分。當在本文中使用時“基本上由…組成”并不排除實質上不影響權利要求的基本特征和新穎性特征的材料或步驟。在本文的每一個實例中,術語“基本上由…組成”和“由…組成”可互相替換。如本文所使用的在多個所述要素之間的連接術語“和/或”被理解為既包含單獨選項也包含組合選項。例如,當兩個要素通過“和/或”連接時,第一種選項是指不包含第二種要素的第一種元素的適用性。第二種選項是指不包含第一種要素的第二種要素的適用性。第三種選項是指第一種要素和第二種要素結合的適用性。這些選項中的任意一種都被理解為落入該含義內,并因此滿足本文所使用術語“和/或”的要求。多于一種選項的并行適用性也被理解為落入該含義內,因此滿足本文所使用的術語“和/或”的要求。本說明書全文引用了多個文件。本文所引用的每一個文件(包括所有專利、專利申請、科學出版物、制造商說明書、指導書等),無論是上文還是下文,都通過引用整體并入本文。在通過引用并入的材料或與本說明書矛盾或不一致的情況下,本說明書將取代任何這樣的材料。本文中的任何內容不應被解釋為由于在先發明就承認本發明沒有早于此種公開物的權利。考慮到要以提供一種具有高濃度中和GM-CSF的化合物的制劑為目標,本發明人認識到中和GM-CSF的化合物在高濃度下可能不穩定,在長時間儲存中也可能不穩定。實際上,存在很多中和GM-CSF的化合物如蛋白質可能不穩定的方式。例如,蛋白質不穩定性可能由蛋白質聚集或降解造成,也可能由于脫氨基作用、脫酰胺基作用、氧化、二硫鍵斷裂和形成、水解作用、琥珀亞酰胺化、非二硫化物交聯、去糖基化或“酶促褐變”(美拉德反應)或這些現象的任意組合所導致的化學不穩定性造成;參見例如Wang等人(1999),Int.J.Pharm.185:129-188。此外,理化參數諸如溫度、pH值、表面吸附、鹽、金屬離子、螯合劑、物理力如剪切力、蛋白變性劑、非水溶劑、蛋白質濃度、蛋白質來源和純度、蛋白質形態或壓力可影響蛋白質的穩定性。但是,盡管很多因素可影響蛋白質的穩定性,但也可采取很多措施來穩定蛋白質。例如,可以在內部(通過改變氨基酸)或外部穩定蛋白質。外部穩定可以通過添加螯合劑、金屬離子、還原劑、聚合物、聚乙二醇/多元醇、血清白蛋白、表面活性劑、糖和多元醇、脂肪酸和磷脂、氨基酸、緩沖劑等來實現;參見例如Wang,Y和HansonM(1988),J.ParentalSci.&Technology,42,Supplement:4-26;Wang等人(1999)Int.J.Pharm.185:129-188。總之,為了穩定制劑中的GM-CSF中和化合物諸如抗體,技術人員會獲得多種選擇。在本發明的情況下,本發明人觀察到中和GM-CSF的化合物可顯示出聚集和/或可能不以更高的濃度溶解。許多不同因素可引起制劑中蛋白質的聚集。典型的純化和儲存過程可使蛋白質制劑暴露于導致蛋白質聚集成蛋白二聚體、三聚體或多聚體、較大的亞可見顆粒和可見顆粒的條件和組分中。例如,制劑中的蛋白質可由于下述的一種或多種情況而聚集:儲存、暴露于升高的溫度、制劑的pH值、制劑的離子強度、某些表面活性劑和乳化劑的存在。類似地,當暴露于剪切應力如在溶液中重構凍干蛋白質餅、過濾純化蛋白質樣品、凍融、振動或經由注射器轉移蛋白質溶液時,蛋白質可以聚集。聚集還可能由于溶液中和存儲瓶內液態-空氣界面處多肽分子間的相互作用而發生。構象變化可在由于運輸期間的攪動所引起的界面壓縮或延伸的過程中被吸附到空氣-液體、固體-液體界面的多肽中發生。這種攪動還可導致制劑的蛋白質聚集并最終與其它被吸附的蛋白質一起沉淀。亞可見粒子的增長可表明可見粒子的形成趨勢。通常,不同類型聚集體和顆粒的形成可通過不同的測量系統根據聚集體或顆粒的尺寸來進行分析。例如,SEC、DLS、AUC測量納米尺寸范圍內的二聚體、三聚體、多聚體;不透光度、顯微鏡檢查、動態影像、流式細胞術和庫爾特(Coulter)測量大于1μm的亞可見顆粒和小的可見顆粒。此外,將蛋白質制劑暴露于光下可引起蛋白質聚集。因此本發明提供了能實現高濃度的中和GM-CSF的化合物,并減少這些化合物聚集的制劑。在不受理論的束縛下,聚集的減少被認為是通過控制一種或多種上述聚集機制來實現。這可以引起例如改進的產品穩定性,以及制造過程中和儲存條件下的更大的靈活性。本發明人旨在提供一種含有高濃度的中和GM-CSF的化合物的制劑,以便例如實現較低的注射體積而適于減少由于高注射量引起的副作用如疼痛,或允許以低體積進行皮下施用。因為如此,本發明人在他們研究期間已經觀察到了中和GM-CSF的化合物的某種不穩定性,并因此旨在改善這種不希望的觀察結果。因此,他們旨在濃縮中和GM-CSF的化合物,而同時將其保持在溶液中,即處于溶解狀態。在這樣做時,他們有很多種選擇和替代,然而沒有任何跡象顯示這些選擇和替代中的任何一個將適用于解決這個目標問題。“溶解狀態”意指中和GM-CSF的化合物是在溶液中,優選濃度至少為約20mg/ml,也就是說其直接溶解和/或分散在制劑的水溶液中(即在水相中)。優選地,中和GM-CSF的化合物是均質地溶解和/或分散的。“均質地”意指溶解和/或分散于水性制劑中的中和GM-CSF的化合物幾乎是均勻地,優選均勻地分布于水性制劑中,這樣使得在該水溶液體積(“v”)下(或中)的中和GM-CSF的化合物的濃度(“c”)(在摩爾質量的情況下為“n”或在質量的情況下為“m”)是幾乎完全相同的,優選完全相同的,即c=n/v或c=m/v分別是幾乎恒定的,優選為恒定的。優選地,所述制劑中不存在濃度梯度。因此,本發明所述包含中和GM-CSF的化合物的穩定制劑可優選地被認為是一種水溶液,其中中和GM-CSF的化合物直接溶解和/或分散于該水溶液中。“溶液”是兩種或多種物質/組分的均質混合物。在這樣的混合物中,一種溶質(在本發明中是中和GM-CSF的化合物)溶解于(如上所述)另一種物質(本在發明中優選為水性制劑)中,也被稱為溶劑。鑒于以上所述,中和GM-CSF的化合物優選非異質地溶解和/或分散在水溶液中。術語“溶解狀態”還包括中和GM-CSF的化合物優選為在水溶液中是基本上不乳化的,或更優選為是完全不乳化的。此外,術語“溶解狀態”包括中和GM-CSF的化合物優選為例如在脂質體、多層脂質體或諸如此類中是基本上不封裝和/或包埋的(優選少于2%、1%或0.5%的中和GM-CSF的化合物可被封裝和/或包埋),或更優選為完全不封裝和/或包埋的。因此,本發明的一個優選實施方案是含有中和GM-CSF的化合物的液體制劑,其在長期儲存中是穩定的并且沒有形成綴合物/聚集體/顆粒或片段/降解產品,適合于皮下施用。具體而言,在測試過多種不同穩定劑后,本發明人發現如果將張力調節劑添加至待儲存的溶液中,可以穩定中和GM-CSF的化合物。張力調節劑的實例包括但不限于糖和糖醇。簡單的糖類被稱為單糖,包括葡萄糖、果糖、半乳糖、木糖、核糖、甘露糖、乳果糖、阿洛糖、阿卓糖、古洛糖、艾杜糖、塔羅糖、阿拉伯糖和來蘇糖。本發明更優選二糖,其包括例如蔗糖、麥芽糖、乳糖、異麥芽糖、海藻糖和纖維二糖。糖醇包括山梨醇、甘露醇、甘油、赤蘚糖醇、麥芽糖醇、木糖醇、聚葡萄糖醇(polyglycitol)。在一個優選實施方案中,所述糖是非還原糖諸如蔗糖或海藻糖。非還原糖的特征在于不存在開鏈結構,因此它們不易受到氧化還原反應的影響。因此,一種或多種非還原糖諸如蔗糖或海藻糖,或一種或多種糖醇諸如甘露醇或山梨醇,可以加入至包含中和GM-CSF的化合物的制劑中。非還原糖和糖醇的組合也可以加入至該溶液中,諸如蔗糖和甘露醇、蔗糖和山梨醇、海藻糖和甘露醇,或海藻糖和山梨醇。更優選加入糖醇甘露醇和/或山梨醇,優選其D-型,最優選將山梨醇加入至該溶液。張力調節劑優選山梨醇的濃度為約1%和約15%(w/v)之間,優選為約2%和約10%(w/v)之間,更優選為約3%至約7%(w/v)之間,優選為4%和約6%(w/v)之間,最優選為約5%(w/v)。另一種用來在長期儲存時穩定高濃度的中和GM-CSF的化合物的具體優選物質為緩沖體系,其pH為約4和約10之間,優選為約4和約7之間,更優選為約4和約6之間或約5和約7之間,甚至更優選為約5.5和約6.5之間,最優選pH為約5.8。緩沖液可優選地選自組氨酸緩沖液、乙酸鹽緩沖液和檸檬酸鹽緩沖液。當文本提及氨基酸時,其意為L-氨基酸或D-氨基酸,其中優選L-氨基酸。優選組氨酸及其鹽用于緩沖體系。優選地,所述鹽是氯化物、磷酸鹽、乙酸鹽或硫酸鹽,更優選地,所述鹽是氯化物。組氨酸緩沖體系的pH為約5和約7之間,優選為約5.5和約6.5之間,更優選pH為約5.8或正好5.8。可以通過使用常規使用的堿和酸來調節pH,優選地,可以使用NaOH或組氨酸和組氨酸鹽的混合物,這樣劑不需要調節pH。緩沖體系優選組氨酸緩沖體系的濃度為約10mM和約50mM之間,優選為約20mM和約40mM之間,更優選為約30mM。此外,本發明人發現,如果向待儲存的溶液中添加表面活性劑、氨基酸、抗氧化劑和/或螯合劑中的一種或多種,可以穩定中和GM-CSF的化合物。根據優選的實施方案,為了在長期儲存和/或一個或多個凍/融循環中預防聚集并使該試劑足夠穩定,將緩沖劑體系、張力調節劑、表面活性劑和/或泊洛沙姆的組合用于穩定溶液中的中和GM-CSF的化合物,其中所述緩沖體系優選組氨酸緩沖劑;所述張力調節劑優選糖醇,更優選甘露醇或甚至更優選山梨醇;所述表面活性劑優選聚山梨醇酯20(PS20;20)、聚山梨醇酯80(PS80;80)。已經表明,就穩定性而言,所述制劑中優選具有約6%(w/v)和更高的糖醇,優選山梨醇。然而,將所述制劑的滲透壓上限設定為約500mOsm/kg,其仍然是高滲的,但是類似于批準產品(Synagis;Lm.administration)的滲透壓。正如本發明實施例所描述的,發現了中和GM-CSF的化合物的最佳穩定性、張力和濃度之間的折中。因此,糖醇優選山梨醇的優選濃度在約3%和約7%(w/v)之間,更優選在約4%和約6%(w/v)之間,最優選約5%(w/v)。本發明的一些實施方案中,本發明的包含中和GM-CSF的化合物的制劑或組合物不含或基本上不含氯化鈉。“基本上不含”意指氯化鈉的濃度為或非常接近0(零)mM,例如低于約50mM,優選低于約20mM,更優選低于約10mM,甚至更優選為低于約5mM,最優選低于約2mM,或甚至低于約1mM。在待儲存、冷凍/解凍和/或即可使用的液體制劑中,所使用的中和GM-CSF的各化合物的濃度為至少約20mg/ml,優選至少約50mg/ml,更優選為至少約60mg/ml。本發明所使用的濃度為約20mg/ml至約200mg/ml,優選約40mg/ml至約200mg/ml,更優選約50mg/ml至約180mg/ml,甚至更優選約70mg/ml至約170mg/ml,甚至更優選約75mg/ml至約165mg/ml,最優選約80mg/ml或約150mg/ml。所生產的液體制劑的保質期的優選最低要求為2-8℃下24個月,優選2-8℃下36個月,更優選2-8℃下48個月,最優選2-8℃下60個月,或室溫下(25℃±2℃)至少28天。本發明涉及穩定的制劑,優選穩定的液體制劑,該制劑令人驚訝地允許中和GM-CSF的化合物的長期儲存。該制劑部分是有用的,因為其更便于對患者使用,該制劑的中和GM-CSF的化合物是高度濃縮的從而減少了由于高體積注射所引起的類似疼痛的副作用。因此,本發明的一個方面是基于發現包含以下項的制劑對于長期儲存和/或凍/融循環和/或剪切應力(振動/攪拌穩定性)具有足夠的穩定性:-中和GM-CSF的化合物,-緩沖體系,其優選自pH優選為5和7之間的組氨酸緩沖液、乙酸鹽緩沖液和/或檸檬酸鹽緩沖液,-張力調節劑,其優選自非還原糖諸如蔗糖或海藻糖,或糖醇諸如甘露醇或山梨醇,-以及表面活性劑、氨基酸、抗氧化劑和/或螯合劑中的一種或多種,優選表面活性劑,所述表面活性劑優選為聚山梨醇酯20、聚山梨醇酯80或泊洛沙姆中的一種或多種。本發明的制劑相對于標準緩沖制劑具有許多優點。一方面,該制劑顯示出經長期儲存后最小的聚集行為,并且沒有對高蛋白制劑所預期的有害作用。根據本發明,該制劑的其它優點在于:所述中和GM-CSF的化合物的片段化最少;長期儲存后所述中和GM-CSF的化合物的生物活性沒有顯著影響;所述組合物的粘度低。本發明第一方面的優選實施方案如下:根據本發明所述的制劑,其中所述中和GM-CSF的化合物是多肽、擬肽、核酸或小分子。在一個優選的實施方案中,所述中和GM-CSF的化合物(優選為多肽,更優選為抗體或其功能片段)與GM-CSF或GM-CSF受體結合或特異性結合。據設想,所述GM-CSF或GM-CSF受體是動物的,包括但不限于哺乳動物諸如實驗動物(嚙齒類諸如大鼠、豚鼠、倉鼠或小鼠;非人靈長類動物諸如食蟹猴(cynomolgusmonkey)或獼猴(macaquemonkey)、家養或寵物動物(例如狗和貓)、農場或農業動物(例如牛、綿羊、山羊和豬的動物)和/或人。優選地,所述GM-CSF或GM-CSF受體分別為人GM-CSF(智人,Homosapiens)或人GM-CSF受體,或分別為非人靈長類GM-CSF或非人靈長類GM-CSF受體。非人靈長類GM-CSF或非人靈長類GM-CSF受體的特別優選的變體(同源物)包括長臂猿(Nomascusconcolor,也稱為西部黑冠長臂猿)的變體、獼猴科的猴子例如恒河猴(Macacamulatta)和食蟹猴(Macacafascicularis)的變體。根據本發明的一個特別優選的實施方案,與GM-CSF或GM-CSF受體結合的化合物(優選抗體或其片段)表現出對人和至少一種上述猴種兩者的交叉反應性。例如,抗體或其片段能夠結合(并且中和)人GM-CSF和食蟹猴(Macacafascicularis)兩者。這對于旨在用于人類受試者的治療性施用的抗體分子是特別有利的,因為這樣的抗體通常必須在獲得監管批準之前經過大量試驗,其中某些早期試驗涉及非人動物物種。在進行這樣的試驗中,通常期望使用與人具有高度遺傳相似性的物種作為非人物種(例如,非人靈長類動諸如食蟹猴),因為如此獲得的結果通常將是對人施用相同分子時可預期的相應結果的高度預測。然而,此種基于動物試驗的預測能力至少部分取決于分子的可比性,由于種間反應性,當同樣的治療分子可被施用于人和動物模型時,該預測能力非常高。如在本發明這個實施方案中,當抗體分子對人類和另一個緊密相關物種的同一種抗原具有交叉反應性時,可使用人和所述另一個緊密相關物種(例如上述猴種中的一種)的同一種抗體分子進行試驗。這提高了試驗本身的效率以及由這種關于人類(從治療的立場看最終感興趣的物種)中這種抗體行為的試驗所提供的預測能力。優選地,與GM-CSF或GM-CSF受體結合的抗體或其功能片段是單克隆抗體或其功能片段。這同樣適用于中和GM-CSF的化合物的替代實施方案,該化合物不是抗體或不是衍生自抗體。優選地,該中和GM-CSF的化合物是人單克隆抗體或其功能片段。中和GM-CSF的化合物可以是與人和非人靈長類GM-CSF的表位結合的抗體或其功能片段。所述表位優選包含第23-27位氨基酸(RRLLN)和/或第65-77位氨基酸(GLR/QGSLTKLKGPL)。第65-77位氨基酸序列延伸中第67位上的變異性反應了這部分GM-CSF在一方面是人和長臂猿GM-CSF(其中第67位為R)和另一方面是獼猴科的猴諸如獼猴和恒河猴(其中第67位為Q)之間的異質性。如果表位包含兩個非相鄰的氨基酸序列延伸,諸如第23-27位(RRLLN)和第35-77位(GLR/QGSLTKLKGPL),那么該表位還可稱為“不連續”表位。所述GM-CSF表位或所述GM-CSF不連續表位可進一步包含第28-31位氨基酸(LSRD)、第32-33位氨基酸(TA)和/或第21-22位氨基酸(EA)。所述人單克隆抗體或其功能片段優選在其重鏈可變區包含含有選自如SEQIDNO:1-13和56所示氨基酸序列的CDR3;優選地,所述重鏈可變區CDR3包含如SEQIDNO:2所示的氨基酸序列。任意的所述重鏈可變區CDR3序列可進一步與包含如SEQIDNO:14所示氨基酸序列的重鏈可變區CDR1以及包含如SEQIDNO:15所示的氨基酸序列的重鏈可變區CDR2一起存在于重鏈可變區。進一步地,所述人單克隆抗體或其功能片段可在其輕鏈可變區包含含有如SEQIDNO:16所示氨基酸序列的CDR1、含有如SEQIDNO:17所示氨基酸序列的CDR2和含有如SEQIDNO:18所示氨基酸序列的CDR3。在本發明特別優選的一個方面,所述人單克隆抗體或其功能片段在其輕鏈可變區包含含有如SEQIDNO:16所示氨基酸序列的CDR1、含有如SEQIDNO:17所示氨基酸序列的CDR2和含有如SEQIDNO:18所示氨基酸序列的CDR3;在其重鏈可變區包含含有如SEQIDNO:14所示氨基酸序列的CDR1、含有如SEQIDNO:15所示氨基酸序列的CDR2和含有選自如SEQIDNO:1-13和56所示、最優選為如SEQIDNO:2所示氨基酸序列的CDR3。根據一個優選的實施方案,所述人單克隆抗體或其功能片段在其輕鏈可變區包含選自如SEQIDNO:19、54和55所示的氨基酸序列。根據另一個優選的實施方案,所述人單克隆抗體或其功能片段在其重鏈可變區包含選自如SEQIDNO:20-33、52和53所示的氨基酸序列。在另一個優選的實施方案中,所述人單克隆抗體或其功能片段包含如SEQIDNO:34所示的輕鏈氨基酸序列,和/或如SEQIDNO:35-48任一項所示的、最優選為如SEQIDNO:35所示的重鏈氨基酸序列。所述人單克隆抗體或其功能片段可包含一個或多個與如SEQIDNO:1-48和52-56的任一項所示的相應氨基酸序列、優選如SEQIDNO:1-18和56中的任一項所示的相應氨基酸序列、和/或如SEQIDNO:19-48和52-55中的任一項所示的氨基酸序列中框架區(FR)氨基酸序列具有至少70%、80%、90%、95%、98%或99%同源性的氨基酸序列。因此,在一個優選的實施方案中,所述人單克隆抗體或其功能片段可包含一個或多個與如SEQIDNO:1-18和56中的任一項所示的相應氨基酸序列具有至少70%、80%、90%、95%、98%或99%同源性的氨基酸序列。可選擇地,在如SEQIDNO:1-18和56中任一項所示的CDR的任一氨基酸序列中,一個、兩個、三個、四個、五個、七個、八個、九個或十個氨基酸可被取代。優選地,這種具有取代的CDR仍然能夠與本文所述GM-CSF結合。或者或另外,優選地,所述人單克隆抗體或其功能片段可包含一個或多個分別與如SEQIDNO:19-48和52-55中任一項所示的VH、VL、H或L區的相應氨基酸序列具有至少70%、80%、90%、95%、98%或99%同源性的氨基酸序列。優選地,所述同源性是相對于整個VH、VL、H或L氨基酸序列。更優選地,所述同源性在前述CDR內,或者所述同源性在如SEQIDNO:19-48和52-55中的任一項所示的VH、VL、H或L區的FR(或非CDR)內。因此,在每一個FR中,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25個氨基酸可被取代。這樣的FR取代型變體仍然能夠結合本文所述的GM-CSF。由于SEQIDNO:1-18和56示出了一個或多個如SEQIDNO:19-48和52-55所示的VH、VL、H或L序列中包含的CDR序列,因此技術人員可容易地確定SEQIDNO:19-48和52-55中的FR(或非CDR)。也就是說,序列表在序列標識符<223>中提供了每一個氨基酸序列的名稱。相同的名稱表明這些氨基酸序列是“屬于”一起的,意指CDR被包含在VH、VL、H或L區中,例如SEQIDNO:16、17、18是被包含在如SEQIDNO:19所示氨基酸序列中的CDR氨基酸序列(因為它們均被稱為(5-306))。作為進一步的說明,如果重鏈和/或輕鏈的一個或多個或所有CDR或FR中的氨基酸被替代,那么優選隨后獲得的“取代”序列與“原始”CDR或FR序列有至少70%、更優選80%、甚至更優選90%、特別優選95%、更特別優選98%或99%的同一性。這意味著其與“取代”序列的同源性程度取決于CDR或FR的長度。同源性通過標準序列比對程序來確定,諸如VectorNTI(InforMaxTM,Maryland,USA),或更優選通過程序BLASTP來確定,優選版本blastp2.2.5(2002年11月16日;參見Altschul,S.F.等人(1997)Nucl.AcidsRes.25,3389-3402)。同源性百分比基于對整個多肽序列的比對(矩陣:BLOSUM62;空位罰分:11.1;臨界值設為10-3),使用CDR、VH、VL、H或L氨基酸序列中的任一個作為成對比較的參照。計算BLASTP程序輸出中表示為“正數”(同源氨基酸)的數量除以比對程序所選的氨基酸總數的百分比。當在本文中使用時,氨基酸或核苷酸序列的同源性可以與術語“同一性”互換使用。本發明所使用的術語“同源性”意為成對相同殘基—在對本發明的氨基酸序列或核苷酸序列的序列與所討論的序列進行同源性比對之后—相對于這兩個序列中較長者的殘基數量的百分比。如上所述,用于確定同源性(或同一性)的程序對在一個氨基酸接著一個氨基酸的基礎上比對的序列進行比較,并且可被設置成不同的嚴格性水平用于比較(例如相同氨基酸、保守氨基酸取代等)。如本文所使用的術語,如果所討論的兩個氨基酸的每一個屬于相同的化學種類,即酸性、非極性/疏水性、不帶電的極性和堿性,它們就被視為是彼此“保守取代”。作為非限制性實例,屬于非極性氨基酸種類的兩個不同氨基酸會被視為彼此的“保守取代”,即使這兩個氨基酸不是同一種,然而,一方面的非極性氨基酸和另一方面的堿性氨基酸則不會被視為彼此的“保守取代”。Alberts,Johnson,Lewis,Raff,Roberts和Walter所著的“MolecularBiologyoftheCell”,第四版(2002),第3.1面板中將氨基酸分成四個主要類型:酸性、非極性、不帶電的極性和堿性。本發明上下文中,這種分類可用于確定特定氨基酸是否是所討論的另一個氨基酸的保守取代的目的。上述的主要類型可進一步被細分為例如小非極性和大非極性氨基酸、大芳香族氨基酸等。術語“保守氨基酸取代”還指給定氨基酸殘基的任意氨基酸取代,其中所述取代殘基在化學上非常類似于所給定的殘基,以致于并未導致多肽功能(例如結合)的實質性降低。中和GM-CSF的化合物通常地被配制成用于向受試者腸胃外施用的藥物組合物,例如靜脈內、腹膜內、皮下、肌肉內、外用或皮內施用,其中優選皮下施用。在某些實施方案中,所述藥物組合物為液體組合物,優選水性組合物。在一個實施方案中,在待儲存、凍/融和/或即可使用的液體制劑中,液體藥物組合中所述中和GM-CSF的化合物的濃度至少20mg/ml,優選至少約50mg/ml,更優選至少約60mg/ml。本發明所使用的濃度為約20mg/ml至約200mg/ml,優選約40mg/ml至約200mg/ml,更優選為約50mg/ml至約180mg/ml,甚至更優選為約70mg/ml至約170mg/ml,甚至更優選為約75mg/ml至約165mg/ml,最優選約80mg/ml或約150mg/ml。在一些實施方案中,例如當所述組合物旨在用于皮下遞送時,可以使用更高濃度的中和GM-CSF的化合物。如上所述,本發明所述組合物包含緩沖液。如本文使用的術語“緩沖液”是指添加的允許液體制劑抵抗pH變化的組合物。在某些實施方案中,所添加的緩沖液通過其酸堿共軛組分的作用允許液體制劑抵抗pH的變化。合適的緩沖液的實例包括但不限于:緩沖的組氨酸、乙酸鹽或檸檬酸鹽系統。如本文所使用的術語“特異性地結合”或相關表達諸如“特異性的結合”、“特異性結合”、“特異性結合劑”等是指所述GM-CSF-中和化合物,優選(人)(單克隆)抗體或其功能片段對其標靶(例如GM-CSF或GM-CSF受體)與任意其它不同于GM-CSF或GM-CSF受體的潛在抗原進行區別到這種程度的能力,即從多種不同的抗原作為潛在的結合配偶體中,只有GM-CSF/GM-CSF受體被結合或被顯著結合。在本發明的含義內,從等同可接近的作為潛在結合配偶體的多種不同抗原中,當靶標比任意其它不同于該靶標的抗原頻繁(在動力學意義上)至少10倍、優選至少50倍、最優選至少100倍或更頻繁地被結合時,靶標是被“顯著”結合的。可以通過例如使用SPR技術諸如Biacore儀器來進行這種動力學測量。如本文所使用的術語“與……(特異性)結合”或相關術語諸如“(特異性)識別”、“針對”、“(特異性地)相互作用”以及“(特異性地)與...…發生反應”意指根據本發明,中和GM-CSF的化合物(例如抗體)表現出對其靶標(例如GM-CSF或該GM-CSF受體)有可觀的親和力,而通常不表現出與除前述靶標以外的蛋白質或抗原有顯著反應性。“可觀的親和力”包括以約10-6M(KD)或更強,諸如10-7M或更強的結合親和力結合。優選地,當結合親和力為約10-11至10-8M、優選約10-11至10-9M、更優選約10-11至10-10M時,認為結合是特異性的。通過尤其是將所述化合物與其靶蛋白或抗原的反應和所述化合物與除其標靶之外的蛋白或抗原的反應進行比較,可很容易檢測出化合物(例如抗體)與其靶標是否發生特異性反應或結合。優選地,根據本發明所述的化合物基本上不結合或不能夠結合除GM-CSF或GM-CSF受體之外的蛋白質或抗原。術語“基本上不結合”或“不能夠結合”意指本發明的化合物顯示出與除GM-CSF或GM-CSF受體之外的蛋白質或抗原的反應性不多于30%,優選不多于20%,更優選不多于10%,特別優選不多于9%、8%、7%、6%或5%。如本文所使用的,“中和作用”、“中和劑”、“中和”及其語法相關變形是指GM-CSF生物效應的部分或完全衰減。GM-CSF生物學效應的這種部分或完全衰減是由修飾、中斷和/或消除GM-CSF介導的過程造成的,諸如信號轉導,例如在細胞內信號傳導、細胞增殖、可溶性物質釋放、細胞內基因激活的上調或下調所顯示的,這引起例如除GM-CSF之外的配體的表面受體表達。正如本領域技術人員所理解的,存在多種模式可確定化合物例如抗體或其功能片段是否會被歸類為中和劑。作為一個實例,這可以通過通常如下進行的標準體外測試來實現:在第一次增殖實驗中,將已知其增殖程度取決于GM-CSF活性的細胞系與不同濃度的GM-CSF的一系列樣品一起孵育,隨后測量其孵育后的細胞系增殖程度。從該測量中,確定允許細胞最大半數增殖的GM-CSF的濃度。然后進行第二次增殖實驗,該實驗所使用的一系列樣品中的每一個使用與第一次增殖實驗相同數量的細胞,使用上述確定的GM-CSF濃度,但這次試驗中使用不同濃度的疑似為GM-CSF的中和劑的化合物。再次測量細胞增殖來確定所分析的化合物足以引起最大半數生長抑制的濃度。如果所得到的相對于所分析的化合物濃度的生長抑制圖是S形狀,導致細胞增殖隨著所分析的化合物濃度升高而減少,那么生長抑制已在一定程度上受到了影響,即GM-CSF活性在一定程度上被中和。在這個情況下,所討論的化合物可被視為本發明意義上的“中和劑”。已知增殖程度取決于GM-CSF活性的細胞系的一個實例是TF-1細胞系,正如Kitamura,T.等人(1989).JCellPhysiol140,323-34中所描述。正如本領域普通技術人員所理解的,細胞增殖的程度不是可確定GM-CSF中和能力的唯一參數。例如對信號分子水平(例如細胞因子)的測量、其分泌水平取決于GM-CSF,可被用于識別疑似的GM-CSF中和劑/GM-CSF抑制化合物。可用于確定所討論的化合物諸如抗體或其功能片段是否是GM-CSD活性中和劑的細胞系的其它實例包括AML-193(Lange,B.等人(1987).Blood70,192-9)、GF-D8(Rambaldi,A.等人(1993).Blood81,1376-83)、GM/SO(Oez,S.等人(1990),ExperimentalHematology18,1108-11)、MO7E(Avanzi,G.C.等人(1990).JournalofCellularPhysiology145,458-64)、TALL-103(Valtieri,M.等人(1987).JournalofImmunology138,4042-50)以及UT-7(Komatsu,N.等人(1991).CancerResearch51,341-8)。應當理解,根據本發明,GM-CSF的中和可在帶有GM-CSF受體的細胞外或者在所述細胞內進行。因此,化合物對GM-CSF的中和,可以是抑制或預防GM-CSF與其特異性受體的結合,或者抑制由細胞因子與其受體的結合所誘導的細胞內信號。中和GM-CSF的化合物可以例如與GM-CSF直接結合或與GM-CSF受體結合,由此在兩種情況下干擾GM-CSF的生物學效應。如上文所定義,GM-CSF的抑制劑可選自多肽、擬肽、核酸分子和小分子。本文使用的術語“多肽”描述了一組分子,其通常由至少30個經共價肽鍵相互耦合的氨基酸組成。根據本發明,該組多肽包含由單一多肽或多于一個多肽所組成的“蛋白質”。術語“多肽”還描述蛋白質片段,只要這些片段是由至少30個氨基酸組成的。本領域眾所周知,多肽可形成多聚體諸如二聚體、三聚體和更高的低聚體,即由多于一個多肽分子組成的。這樣的多聚體也包括在術語“多肽”的定義中。形成這樣的二聚體、三聚體等的多肽分子可以相同或不同。這樣的多聚體的相應更高級結構因此被稱為同二聚體或異二聚體、同三聚體或異三聚體等。異多聚體的實例為抗體分子,其以天然存在的形式是由兩個相同的輕多肽鏈和兩個相同的重多肽鏈組成。術語“多肽”和“蛋白質”也指天然或非天然修飾的多肽/蛋白質,其中所述修飾的實現是例如通過翻譯后修飾如糖基化、乙酰化、磷酸化、二硫鍵形成諸如此類或通過化學修飾如聚乙二醇化。這樣的修飾是本領域熟知的。術語“核酸”或“多核苷酸”在本發明上下文中限定了由磷酸、糖、嘌呤和嘧啶堿基的多個重復單元組成的聚合大分子。這些分子的實施方案包括DNA、RNA和PNA。核酸可以是單鏈或雙鏈、線性或環狀的。本發明上下文中,核酸的特別優選實施方案為適體。核酸適體是從基于其結合其它分子能力的隨機池中選擇的DNA或RNA分子。已經選擇了結合核酸、蛋白質、小的有機化合物和甚至整個生物體的適體。它們通常由短鏈寡核苷酸組成,通常為50個堿基或更少。術語“小分子”限定了一組具有分子量小于1000道爾頓、優選高達800道爾頓、更優選300-700道爾頓的有機藥物化合物。小分子的分子量上限允許快速擴散穿過細胞膜的可能性,使得它們可以到達細胞內作用位點。相應的小分子可以源自至少是部分隨機化的肽文庫。根據本發明所述的合適的小分子文庫是本領域所熟知的,和/或可以從商業分銷商處購買。術語“擬肽”描述了設計用于模擬肽的小蛋白樣鏈。這種類型的分子是通過修飾現有的肽以改變分子的性質從而人工衍生的。例如,對親本存在的肽進行修飾以改變分子的穩定性或生物活性。這些修飾包括主鏈的改變和非天然氨基酸的摻入。術語“GM-CSF受體”是指GM-CSF的生理學細胞表面受體,其在本領域被描述為α鏈(CD116)和共同β(β-c)亞基的異聚體。中和多肽的一個優選實施方案是抗體或其功能片段,更優選人抗體或其功能片段。用于抗體生產的技術是本領域熟知,并在例如Harlow和Lane的“Antibodies,ALaboratoryManual”,ColdSpringHarborLaboratoryPress,1988,Harlow和Lane“UsingAntibodies:ALaboratoryManual”ColdSpringHarborLaboratoryPress,1999中有所描述。術語“抗體”的定義包括諸如單克隆的、嵌合的、單鏈的、人源化的和人抗體的實施方案。除了全長抗體之外,該定義還包括抗體衍生物和抗體抗體片段,例如尤其是Fab片段。抗體片段或衍生物進一步包括F(ab')2、Fv、scFv片段或單結構域抗體,例如結構域抗體、納米抗體、單可變結構域抗體或免疫球蛋白單可變結構域,所述單結構域抗體包含僅一個可能是VHH、VH或VL的可變結構域,其不依賴于其它V區或結構域地與抗原或表位特異性結合;參見,例如如上文所述的Harlow和Lane(1988)和(1999);Kontermann和Dübel,AntibodyEngineering,Springer,第二版,2010和Little,RecombinantAntibodiesforImmunotherapy,CambridgeUniversityPress2009。該術語也包括雙抗體(diabody)或雙親和性重新靶向(Dual-AffinityRe-Targeting,DART)抗體。進一步設想,(雙特異性)單鏈雙特意抗體、串聯雙抗體(Tandab),“微抗體”的例證為如下結構:(VH-VL-CH3)2、(scFv-CH3)2或(scFv-CH3-scFv)2、“FcDART”和“IgGDART”,多抗體諸如三鏈抗體。免疫球蛋白單可變結構域不僅包括分離抗體單可變結構域多肽,還包括較大多肽,該大多肽包含抗體單可變結構域多肽序列的一個或多個單體。此外,本文所使用的術語“抗體”還涉及本文所述抗體的衍生物或變體,其顯示出與所述抗體相同的特異性。“抗體變體”的實例包括非人抗體的人源化變體、“親和力成熟的”抗體(參見例如Hawkins等人J.Mol.Biol.254,889-896(1992)和Lowman等人,Biochemistry30,10832-10837(1991))和具有改變的效應子功能的抗體突變體(參見例如美國專利5,648,260、如上文所述的Kontermann和Dübel(2010)以及如上文所述的Little(2009))。術語“抗體”還包括不同類的免疫球蛋白(Ig’s)(即IgA、IgG、IgM、IgD和IgE)和不同亞類的的免疫球蛋白(Ig’s)(諸如IgG1、IgG2等)。抗體衍生物也屬于本發明含義中的術語抗體的定義,包括例如糖基化、乙酰化、磷酸化、二硫鍵形成、法尼基化、羥基化、甲基化或酯化的分子的修飾。抗體的功能片段包括F(ab’)2片段、Fab片段、scFv或含有單個免疫球蛋白可變域或單域抗體多肽構建體的結構域,例如單重鏈可變域或單輕鏈可變域結構域以及如上文所述的其它抗體片段。F(ab')2或Fab可被工程化以最小化或完全去除CH1和CL結構域之間發生的分子間二硫鍵相互作用。本文所使用的術語“人”抗體被理解為意指抗體或其功能片段包含人種系全套抗體庫所含的氨基酸序列。出于本文定義的目的,如果抗體或其片段由這樣的人種系氨基酸序列組成,即如果所討論的抗體或其功能片段的氨基酸序列與所表達的人種系氨基酸序列相同,那么該抗體或其功能片段可以由此被視為是人的。如果抗體或其功能片段是由與其最近的人種系序列偏離不超過由于體細胞超變印記而預期的序列所組成,那么該抗體或其功能片段也可被認為是人的。此外,很多非人哺乳類的抗體(例如嚙齒類如小鼠和大鼠)包含VHCDR3氨基酸序列,其也可預期存在于所表達的人全套抗體庫中。出于本發明的目的,可預期存在于所表達的人源庫中的任何這樣的人或非人源序列也可被認為是“人”的。因此術語“人抗體”包括具有基本上與本領域公知的人種系免疫球蛋白序列相對應的可變區和恒定區的抗體,其包括例如那些如Kabat等人(參見如上文所述的Kabat等人(1991))所描述的抗體。本發明的人抗體例如在CDR中特別是CDR3中可包括不是由人種系免疫球蛋白序列編碼的氨基酸殘基(例如通過體外隨機或位點特異性誘變或體內體細胞突變引入的突變)。所述人抗體可具有至少一個、兩個、三個、四個、五個或更多個位點被替換成不是由人種系免疫球蛋白序列編碼的氨基酸殘基。所述非人和人抗體或其功能片段優選是單克隆的。制備單克隆的人抗體特別困難。與鼠B細胞和無限增殖化細胞的融合相反,人B細胞和無限增殖化細胞的融合是不可行的。因此,人單克隆抗體是克服了通常公認為存在于抗體
技術領域:
的重大技術障礙的結果。抗體的單克隆性質使得它們非常適合用作治療劑,因為這樣的抗體將會以可以被充分表征并且可重復地制備和純化的單一同質分子種類存在。這些因素導致產品的生物活性可以以高精度水平預測,如果這樣的分子獲得用于人的治療性施用的監管批準,那么這將是非常重要的。本文使用的術語“單克隆抗體”是指從基本同質的抗體群中獲得的抗體,即構成該群的單個抗體是完全相同的,除了可少量存在的可能自然發生的突變和/或翻譯后修飾(例如異構化、酰胺化)。單克隆抗體是針對單個抗原位點的高度特異性抗體。此外,與包括通常針對不同決定簇(表位)的不同抗體的常規(多克隆)抗體制劑相反,每種單克隆抗體是針對抗原上的單一決定簇。除了它們的特異性之外,單克隆抗體的優點在于它們是通過雜交瘤培養物合成的,不被其它免疫球蛋白污染。修飾語“單克隆的”表明抗體的特征在于其是從基本同質的抗體群中獲得的,其不應被解釋為需要通過任何特定方法產生抗體。例如,根據本發明所使用的單克隆抗體可通過首先由Kohler等人,Nature,256:495(1975)描述的雜交瘤方法制備,或者可通過重組DNA方法(參見例如美國專利號4,816,567)制備。所述“單克隆抗體”也可通過使用在例如Clackson等人,Nature,352:624-628(1991)和Marks等人,J.Mol.Biol.,222:581-597(1991)中所描述的技術從噬菌體抗體庫中分離出來。特別優選地,單克隆抗體或相應的功能片段是人抗體或相應的功能片段。在考慮旨在用于治療性施用于對人的抗體試劑時,非常有利的是,所述抗體是人源的。在向人患者施用后,人抗體或其抗體片段將很有可能不會引起患者免疫系統的強烈的免疫源應答,即其將不被認為是非人蛋白質的外來物。這意味著不會產生針對治療性抗體的宿主即患者抗體,否則這將阻斷治療性抗體的活性和/或加速治療性抗體從患者體內的消除,從而阻止其發揮所期望的治療效果。根據本發明的一個優選實施方案,用于藥物用途的人單克隆抗體或其功能片段表現出對人和至少一個猴物種之間的反應性。對于所有其它非抗體或非抗體衍生的GM-CSF中和/抑制化合物,相同的種間反應性也是優選的。根據本發明的另一個實施方案,抗體可以是IgG抗體。IgG同種型不僅包含負責高度辨別性抗原識別和結合的重鏈和輕鏈的可變抗體區,還包含重抗體多肽鏈和輕抗體多肽鏈的恒定區,其通常存在于“自然”產生的抗體中,甚至在某些情況下在一個或多個位點經糖修飾。這種糖基化通常是IgG形式的標志且位于恒定區,該恒定區包含所謂已知在體內引起各種效應子功能的完整抗體的Fc區。此外,Fc區介導IgG與Fc受體的結合,以及促進IgG歸巢到Fc受體存在增多的位置—例如,發炎的組織。有利的是,所述IgG抗體是IgG1抗體或IgG4抗體,這是優選的形式,因為其體內作用機制是特別好理解并表征的。對于IgG1抗體尤其如此。根據本發明的另一個實施方案,抗體的功能片段可優選為scFV、單域抗體、Fv、VHH抗體、雙抗體、串聯雙抗體、Fab、Fab'或F(ab)2。這些形式通常可以分為兩個亞類,即那些由單個多肽鏈組成的,以及那些包含至少兩個多肽鏈的。前一亞類的成員包括scFv(包含一個VH區和一個VL區通過多肽接頭連接成單個多肽鏈)、單域抗體(包含單個抗體可變區)諸如VHH抗體(包含單個VH區)。后一亞類的成員包括Fv(包含作為單獨多肽鏈的一個VH區和一個VL區,其彼此非共價相連)、雙抗體(包含兩個非共價相連的多肽鏈,其中每個多肽鏈包含兩個抗體可變區—通常是每個多肽鏈包含一個VH和一個VL—這兩個多肽鏈以頭-尾構象排列,結果得到二價抗體分子)、串聯雙抗體(雙特異性單鏈Fv抗體,其包含共價連接的四個具有兩種不同特異性的免疫球蛋白可變區—VH區和VL區,這形成為上述雙抗體的兩倍大的同源二聚體)、Fab(包含其本身含有VL區和整個輕鏈恒定區的完整抗體輕鏈作為一個多肽鏈,以及含有完整VH區和部分重鏈恒定區的抗體重鏈的一部分作為另一個多肽,所述兩條多肽鏈通過鏈間二硫鍵而分子間連接)、Fab'(如上所述的Fab,除了包含在抗體重鏈上的額外的還原二硫鍵)和F(ab)2(包含兩個Fab'分子,每個Fab'分子通過鏈間二硫鍵與相應的另一個Fab'分子連接)。一般而言,本文以上所描述類型的功能抗體片段允許在調整例如即將發生的特別緊急情況下治療性施用中所需的抗體的藥代動力學性質方面具有很大的靈活性。例如,可能希望減小所施用的抗體尺寸,以便在治療已知是血管化較差的組織(例如關節)時增加組織穿透的程度。在某些情況下,還可能需要增加從體內消除治療性抗體的速率,所述速率通常可通過減小所施用抗體的尺寸來加速。在本發明的上下文中,抗體片段被限定為功能性抗體片段,只要該片段保持對親本抗體的表位/靶標的特異性結合特征,即只要其特異性結合GM-CSF或GM-CSF受體。根據本發明的另一個實施方案,所述抗體或其功能片段可以以下形式存在:單價單特異性;多價單特異性,特別是二價單特異性;或多價多特異性的,特別是二價雙特異性。一般而言,多價單特異性的,特別是二價單特異性的抗體,諸如上文所述的完整人IgG,可給其帶來治療優勢,即由這種抗體實現的中和作用通過親合效應加強,即通過相同抗體結合多個相同抗原分子,在此是GM-CSF或GM-CSF受體。上文已描述了抗體片段的幾種單價單特異性形式(例如scFv、Fv、VHH或單域抗體)。抗體的多價多特異性形式,特別是二價雙特異性形式可包括完整的IgG,其中一個結合臂與靈長類動物的GM-CSF/GM-CSF受體結合,而另一個結合臂與另一種不同于GM-CSF/GM-CSF受體的抗原結合。另一種多價多特異性形式,特別是二價雙特異性形式可以有利地是人單鏈雙特異性抗體,即包含兩個如上所述的scFv實體的重組人抗體構建體,其通過本領域公知的短插入多肽間隔區而連接成一個連續多肽鏈(參見例如針對抗CD19x抗CD3雙特異性單鏈抗體的WO99/54440)。在此,包含于雙特異性單鏈抗體內的雙特異性單鏈抗體的一個scFv部分將如上所述地與GM-CSF/GM-CSF受體特異性結合,而該雙特異性單鏈抗體的相應其它scFv部分將與被確定為具有治療益處的另一抗原結合。根據另一個的實施方案,抗體或其功能片段可以例如用有機聚合物衍生化,例如用一個或多個聚乙二醇(“PEG”)和/或聚乙烯吡咯烷酮(“PVP”)分子。如本領域已知的,這種衍生化可有利于調節抗體或其功能片段的藥效學特性。特別優選的是PEG分子衍生化為PEG-馬來酰亞胺,這使得能夠通過半胱氨酸的巰基基團以位點特異性方式與抗體或其功能片段綴合。其中,特別優選的是支鏈或者直鏈形式的20kD和/或40kD的PEG-馬來酰亞胺。通過使后者與一個或多個PEG分子特別是PEG-馬來酰亞胺偶聯來增加較小的人抗GM-CSF抗體片段(諸如scFV片段)的有效分子量,可能是特別有利的。本發明的抗體還包括“嵌合”抗體(免疫球蛋白類),其中一部分重鏈和/或輕鏈與衍生自特定物種的或屬于特定抗體類或亞類的抗體中的相應序列相同或同源,上述鏈的其余部分與下列抗體中的相應序列相同或同源:衍生自另一物種的抗體,或者屬于另一抗體類或亞類的抗體,以及此類抗體的片段,只要它們顯示出所期望的生物活性(美國專利號4,816,567;Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))。本文感興趣的嵌合抗體包括“靈長源化的”抗體,其包含衍生自非人靈長類動物(例如舊大陸猴、猿等)的可變結構域抗原結合序列和人恒定區序列。非人(例如鼠)抗體的“人源化”形式是主要是人序列的嵌合免疫球蛋白、免疫球蛋白鏈或其片段(諸如Fv、Fab、Fab′、F(ab′)2或抗體的其它抗原結合子序列),其包含衍生自非人免疫球蛋白的最小序列。在大多數情況下,人源化抗體是人類免疫球蛋白(受體抗體),其中來自受者高變區(也是CDR)的殘基被來自具有所需特異性、親和力和能力的非人物種(諸如小鼠、大鼠或兔)高變區(供體抗體)的殘基替換。在某些情況下,人免疫球蛋白的Fv框架區(FR)殘基被相應的非人殘基替換。此外,本文所使用的“人源化抗體”還可以包含受體抗體和供體抗體中均未發現的殘基。進行這些修飾以進一步改進和優化抗體性能。最佳地,所述人源化抗體還將包含至少一部分免疫球蛋白恒定區(Fc),通常是人免疫球蛋白的恒定區。更多細節參見Jones等人,Nature,321:522-525(1986);Reichmann等人,Nature,332:323-329(1988);以及Presta,Curr.Op.Struct.Biol.,2:593-596(1992)。如本文所用,人和非人靈長類GM-CSF的氨基酸殘基或位點的編號是指成熟GM-CSF的編號,即沒有其17個氨基酸信號序列的GM-CSF的編號(上述人和非人靈長類物種中成熟GM-CSF的總長度是127個氨基酸)。人GM-CSF和長臂猿GM-CSF的序列如下:SEQIDNO:49APARSPSPSTQPWEHVNAIQEARRLLNLSRDTAAEMNETVEVISEMFDLQEPTCLQTRLELYKQGLRGSLTKLKGPLTMMASHYKQHCPPTPETSCATQIITFESFKENLKDFLLVIPFDCWEPVQE獼猴科的某些成員例如恒河猴和食蟹猴中GM-CSF的序列如下:SEQIDNO:50APARSPSPGTQPWEHVNAIQEARRLLNLSRDTAAEMNKTVEVVSEMFDLQEPSCLQTRLELYKQGLQGSLTKLKGPLTMMASHYKQHCPPTPETSCATQIITFQSFKENLKDFLLVIPFDCWEPVQE人GM-CSF的序列也在SEQIDNO:57中示出。長臂猿GM-CSF的序列也在SEQIDNO:58中示出:(SEQIDNO:57和58)獼猴科的某些成員例如恒河猴(SEQIDNO:59)和食蟹猴(SEQIDNO:60)中GM-CSF的序列也如下:(SEQIDNO:59和60)與抗體結合的最小表位,有利地是如本文所述的不連續表位,優選人單克隆抗體(或其功能片段)在上述GM-CSF序列以粗體示出。根據一個優選的實施方案,所述中和GM-CSF的化合物是與GM-CSF結合的抗體(優選人單克隆抗體)或其功能片段。更優選地,它與優選包含第23-27位氨基酸(RRLLN)和/或第65-77位氨基酸(GLR/QGSLTKLKGPL)的GM-CSF的表位結合。這些氨基酸序列延伸在上述GM-CSF序列中以粗體顯示。術語“表位”是指抗原或靶標(例如GM-CSF)上與化合物例如抗體或其功能片段特異性結合的位點。所述結合/相互作用也被理解為定義了“特異性識別”。“表位”可以由連續的氨基酸形成,或由蛋白質三級折疊并置的不連續氨基酸形成。“線性表位”是其中氨基酸一級序列包含所識別表位的表位。線性表位在獨特的序列中通常包括至少3個或至少4個、更通常為至少5個或至少6個和或至少7個氨基酸,例如約8個至約10個或更多個氨基酸。在本發明的上下文中,優選GM-CSF表位是不連續表位。在抗體與第23-27位和第65-77位兩個序列延伸結合的情況下,所述表位可被稱為“不連續的”。在人GM-CSF的二級結構中,第15-35位氨基酸位于螺旋A中,而于第65-77位相對應的殘基是位于螺旋C和D之間的環狀結構的一部分。分子折疊的三維模型顯示這些位點相對于彼此緊密空間接近(也參見WO2006/111353)。如本文所用的術語“不連續表位”應理解為給定多肽鏈內的至少兩個非相鄰氨基酸序列延伸,這里是指成熟的人和非人靈長類GM-CSF,其同時與抗體特異性結合。根據該定義,這種同時特異性結合可能是線性形式的GM-CSF多肽。在這里,可以想象成熟的GM-CSF多肽形成延伸的環,在其一個區域中,上述粗體顯示的兩個序列例如或多或少地平行且彼此接近地排列在一起。在這種狀態下,它們特異性地并同時與抗體片段結合。根據該定義,如上所示成熟GM-CSF的兩個序列延伸的同時特異性結合也可采取抗體與構象表位結合的形式。在這里,成熟的GM-CSF已經形成了其通常存在于體內的三級構象。在這種三級構象中,成熟GM-CSF的多肽鏈以這樣的方式折疊,即,使得如上所示的兩個序列延在空間上接近,例如在成熟的折疊GM-CSF的特定區域的外表面上,其中它們然后憑借其在周圍多肽序列環境中的三維構象而被識別。在一個進一步優選的實施方案中,GM-CSF的上述表位或上述不連續表位進一步包括:●第28-31位氨基酸(LSRD),如上述人和非人靈長類GM-CSF的序列中斜體所示;●第32-33位氨基酸(TA),如上述人和非人靈長類GM-CSF的序列中下劃線所示;和/或●第21-22位氨基酸(EA),如上述人和非人靈長類GM-CSF的序列中下劃線所示。優選的人單克隆抗GM-CSF抗體或其功能片段是如WO2006/111353中所具體公開的那些,引用了SEQIDNO:1至48和52至56,其示出了重鏈和輕鏈互補決定區(complementarydeterminingregions,CDRs)1-3、以及重鏈和輕鏈的可變區和全長重鏈和輕鏈的氨基酸序列。特別優選的是包含以下項的抗GM-CSF抗體或其功能片段:如包含SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:1所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:2所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:3中所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:4所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:5所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:6所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:7所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:8所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:9所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:10所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:11所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:12所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:13所示的重鏈可變區CDR3序列;或包含如SEQIDNO:14所示的重鏈可變區CDR1序列,如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:56所示的重鏈可變區CDR3序列。更加優選地,重鏈CDR1、CDR2和CDR3序列的上述14種組合中的任一種存在于其輕鏈可變區中進一步下列項的抗體或其功能片段中:包含如SEQIDNO:16所示氨基酸序列的CDR1、包含如SEQIDNO:17所示氨基酸序列的CDR2和包含如SEQIDNO:18所示氨基酸序列的CDR3。特別優選的抗GM-CSF抗體或其功能片段包含如SEQIDNO:14所示的重鏈可變區CDR1序列、如SEQIDNO:15所示的重鏈可變區CDR2序列和如SEQIDNO:2所示的重鏈可變區CDR3序列,并且在其輕鏈可變區中還進一步包含包含如SEQIDNO:16所示氨基酸序列的CDR1、包含如SEQIDNO:17所示氨基酸序列的CDR2和包含如SEQIDNO:18所示氨基酸序列的CDR3。該抗GM-CSF抗體是用于中和GM-CSF的最優選化合物,而且也在WO2006/111353有所描述。根據另一個實施方案,抗GM-CSF抗體或其片段在其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列。優選的是抗體或其片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:20所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:21所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:22所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:23所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:24所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:25所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:26所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:27所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:28所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:29所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:30所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:31所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:32所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:33所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:52所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.19所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:53所示的氨基酸序列。根據另一個實施方案,所述抗GM-CSF抗體或其功能片段在其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列。優選的是抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:20所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:21所示氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:22所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:23所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:24所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:25所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:26所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:27所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:28所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:29所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:30所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:31所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:32所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:33所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:52所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.54所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:53所示的氨基酸序列。根據另一個實施方案,抗GM-CSF抗體或其功能片段在其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列。優選的是抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:20所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:21所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:22所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:23所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:24所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:25所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:26所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:27所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:28所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:29所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:30所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:31所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:32所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:33所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:52所示的氨基酸序列;或抗體或其功能片段,其輕鏈可變區包含如SEQIDNO.55所示的氨基酸序列,且重鏈可變區包含如SEQIDNO:53所示的氨基酸序列。優選的抗GM-CSF抗體或其功能片段在其輕鏈可變區含有包含如SEQIDNO.16所示氨基酸序列的CDR1、包含如SEQIDNO.17所示氨基酸序列的CDR2和包含如SEQIDNO.18所示氨基酸序列的CDR3,并且在其重鏈可變區含有包含如SEQIDNO.14所示的氨基酸序列的CDR1、包含如SEQIDNO.15所示氨基酸序列的CDR2和包含如SEQIDNO.1、2、3、4、5、6、7、8、9、10、11、12、13或56中任一所示的氨基酸序列的CDR3。在進一步優選的實施方案中,所述抗體在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:35所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:36所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:37所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:38所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:39所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:40所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:41所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:42所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:43所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:44所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:45所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:46所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:47所示的氨基酸序列;或在其輕鏈包含如SEQIDNO:34所示的氨基酸序列,并且在其重鏈包含如SEQIDNO:48所示的氨基酸序列。在其輕鏈包含如SEQIDNO:34所示氨基酸序列、并且在其重鏈包含如SEQIDNO:35所示氨基酸序列的抗GM-CSF抗體是用于中和GM-CSF的最優選化合物,其在WO2006/111353中也有所描述。上述優選的實施方案提供了抗體分子和/或其功能片段,優選人單克隆抗體分子和/或其功能片段,其作為靈長類和人GM-CSF的活性的中和劑是特別有利的。根據這些特別優選的實施方案的抗體或其功能片段出于幾個原因是非常有利的。首先,它們以高特異性識別靈長類和人GM-CSF。也就是說,從靈長類GM-CSF和其他靈長類集落刺激因子(例如靈長類動物G-CSF和M-CSF)的混合物中,根據這些特別優選的實施方案所述的結合分子對于靈長類GM-CSF是高度識別的,而在相同環境中其它集落刺激因子不被識別。這同樣適用于人GM-CSF。這意味著根據這些實施方案所述的抗體或其功能片段,當施用于人時,將預期其僅特異性結合并中和所期望的靶標,而其它不期望的靶標既不被結合也不被中和。最終,這導致關于體內治療作用方式具有高度可預測性。其次,根據這些特別優選的實施方案所述的結合物以可觀的親和力與靈長類和人GM-CSF結合。“可觀的親和力”包括以約10-6M(KD)或更強的親和力的結合。優選地,當結合親和力為約10-12至10-8M、10-12至10-9M、10-12至10-10M、10-11至10-8M,優選約10-11至10-9M時,其被視為是可觀的(或高的或特異性的)。因此,本發明的結合物優選具有在上述范圍內的KD。鑒于已經觀察到本發明所述的抗體分子的KD值為約4×10-9M至低至約0.04×10-9M的事實,后者對應于約40pM,本發明的抗體分子優選具有該范圍內的KD。然而,本發明的抗體分子還優選具有如上文所述的KD。由于這樣的分子在水性介質中的動力學結合速率主要是受擴散控制,因此不能高過生理條件下局部擴散條件所允許的,所以低KD的升高主要是動力學解離速率(即koff)的結果,對于最高親和力的抗體結合物而言,其為約10-5s-1。這意味著,一旦形成一方面是根據這些實施方案中任一個所述的人單克隆抗體或其功能片段與另一方面是GM-CSF之間的復合物,其不容易或至少不快速分離。對于旨在作為生物活性中和劑的結合分子而言,這些特性是非常有利的,這是由于通常只有當待中和生物活性的分子(此處為靈長類和人GM-CSF)與中和結合分子保持結合時所期望的中和效應才能持續。因此,長時間保持與其預定靶標結合的中和分子將繼續中和相應長的時間。抗體或其功能片段對靈長類和人GM-CSF的高結合親和力具有另外的優點。通常,抗體或其功能片段將以尺度依賴性方式從患者的血流中消除,較小分子在較大分子之前被排出和消除。由于所述兩個多肽(抗體或抗體片段和所結合的GM-CSF)的復合物明顯大于單獨的抗體,因此上述低koff具有這樣的效果,即治療中和劑從患者體內排出和消除的速率比其不與GM-CSF結合的情況更慢。因此,不僅中和活性的大小增加了,而且其在體內的持續時間也增加了。根據上述實施方案所述的結合物,其經確定的中和活性驚人地高。如下文更詳細描述的,GM-CSF中和活性在體外用TF-1生長抑制試驗進行測量(Kitamura,T.等人(1989).J.CellPhysiol.140,323-34)。作為中和潛能的指征,測量了IC50值,IC50表示根據這些實施方案中任一個所述的抗體或其功能片段引起TF-1細胞增殖所需的最大半數抑制的濃度。對于上文詳述的人單克隆抗GM-CSF抗體或其功能片段,測定其IC50值為大約3×10-10M或約0.3nM。因此,所述結合分子是靈長類和人GM-CSF活性的高度有效的中和劑。中和抗GM-CSF抗體的其它實例是如Li等人,(2006)PNAS103(10):3557-3562中所描述的人E10抗體和人G9抗體。E10和G9是IgG類抗體。E10對GM-CSF具有870pM的結合親和力,G9對GM-CSF具有14pM的親和力。兩種抗體對于結合人GM-CSF是特異性的,并且顯示出了很強的中和活性,正如用TF-1細胞增殖試驗所評估的。其它實例是如WO2006/122797中所公開的人抗GM-CSF抗體。作為抗GM-CSF受體抗體的GM-CSF拮抗劑或中和劑也可以用于本發明。這樣的GM-CSF拮抗劑包括對GM-CSF受體α鏈或β鏈的抗體。用于本發明的抗GM-CSF受體抗體可以是如上說明的任何抗體形式,例如完整的、嵌合的、單克隆的、多克隆的、抗體片段或衍生物、單鏈、人源化的、人造的,諸如此類。適用于本發明的抗GM-CSF受體抗體的實例,例如中和高親和力抗體是本領域已知的(參見例如,美國專利5,747,032和Nicola等人,Blood82:151724,1993)。在申請中提供了合適抗體的另外的序列,其通過引用整體并入本文。WO2006/122797、WO2007/049472、WO2007/092939、WO2009/134805、WO2009/064399、WO2009/038760中提供了抗GM-CSF抗體。WO2007/110631中提供了針對GM-CSF受體的抗體。總之,抗GM-CSF抗體或其功能片段顯示出其對所期望抗原的高度識別力,其極其緊密并長時間地與該抗原結合,并在其保持結合的長時間內表現出高度有效的中和活性。同時,結合物-抗原復合物的長持久性使該結合物從體內消除減緩,由此延長了所期望的體內治療效果的持續時間。如上所述,所述相同的特征優選也適用于識別GM-CSF受體的抗體。根據本發明所述的組合物優選為藥物組合物。根據本發明的實施方案,術語“藥物組合物”涉及向患者施用的組合物,優選人患者。藥物組合物或制劑通常是這樣的允許活性成分的生物活性起作用的形式,因此可以出于如本文所述的治療用途向受試者施用。通常藥物組合物包含載體、穩定劑和/或賦形劑的合適(即藥學上可接受的)制劑。在一個優選的實施方案中,藥物組合物是用于腸胃外、經皮、腔內、動脈內、鞘內和/或鼻內施用或直接注射到組織中的組合物。特別設想的是,所述組合物通過輸注或注射向患者施用。合適的組合物的施用可以通過不同的方式實現,例如通過靜脈內、腹膜內、皮下、肌肉內、外用或皮內施用。本發明的組合物可進一步包含藥學上可接受的載體。合適的藥物載體的實例是本領域眾所周知的,其包括緩沖鹽溶液、水、乳液如油/水乳液、各種類型的濕潤劑、無菌溶液、脂質體等。包含這種載體的組合物可以通過公知的常規方法配制。根據本發明的實施方案,術語“有效量”是指用于有效治療與GM-CSF相關的疾病(如炎性和自身免疫性疾病)的中和GM-CSF的化合物的量。優選的劑量和優選的施用方法為使得施用后中和GM-CSF的化合物以有效劑量存在于血液中。施用方案可以通過觀察疾病狀況并在實驗室試驗中分析中和GM-CSF的化合物的血清水平來進行調整,隨后或者是延長使用間隔如從每周兩次或每周一次延長至每兩周一次、每三周一次、每四周一次等,或者是相應地縮短施用間隔。藥物組合物可以以合適的劑量向受試者施用。該劑量方案將由主治醫師和臨床因素確定。如醫學領域中眾所周知的,對任何一名患者的劑量取決于許多因素,包括患者的體型、體表面積、年齡、待施用的具體化合物、性別、施用時間和途徑、一般健康狀況以及同時施用的其它藥物。用于腸胃外施用的制劑包括無菌水性或非水性溶液、懸浮液和乳液。非水溶劑的實例是丙二醇、聚乙二醇、植物油如橄欖油以及可注射的有機酯類如油酸乙酯。水性載體包括水、醇/水溶液、乳液或懸浮液,包括鹽水和緩沖介質。腸胃外載體包括氯化鈉溶液、林格氏葡萄糖、葡萄糖和氯化鈉、乳酸林格氏液或不揮發油。靜脈內載體包括流體和營養補充劑、電解質補充劑(諸如那些基于林格氏葡萄糖的)諸如此類。還可以存在防腐劑和其它添加劑,諸如抗菌劑、抗氧化劑、螯合試劑、惰性氣體等。此外,根據本發明的藥物組合物可包含蛋白質載體,例如血清白蛋白或免疫球蛋白,優選人源的。設想根據本發明的藥物組合物除了上述化合物之外還可進一步包含另外的生物活性劑,這取決于該藥物組合物的預期用途。這些試劑可以是作用于胃腸系統的藥物、作為細胞抑制劑的藥物、預防高尿酸血癥的藥物、抑制免疫反應的藥物(例如皮質類固醇)、調節調節炎癥反應的藥物、作用于循環系統的藥物和/或本領域已知的例如細胞因子的試劑。為了分析GM-CSF中和化合物對例如類風濕性關節炎(RA)的作用,結果度量可選自例如藥代動力學、免疫原性、經DAS28、ACR20/50/70和/或EULAR反應標準所測量的改善RA臨床體征和癥狀的潛力、滑膜炎和骨水腫的MRI成像以及患者報告的結果。ACR是一種度量,其匯總了軟弱和腫脹關節數量的改善、疼痛等級、患者和醫生對改善的評估以及某些實驗室檢測指標。ACR20描述了在臨床體征和癥狀方面有20%改善的研究參與者的百分比,例如,軟弱和腫脹關節數改善了20%以及其他三個疾病相關標準改善了20%。在開發諸如根據本發明藥物組合物的藥物中的另一個主要挑戰是藥代動力學特性的可預測調節。為此,建立了候選藥物的藥代動力學譜,即影響特定藥物治療給定病狀的能力的藥代動力學參數譜。影響藥物治療某種疾病實體的能力的藥物藥代動力學參數包括但不限于:半衰期、分布體積、肝首過代謝和血清結合程度。給定的藥物試劑的功效可以受到上述每一個參數的影響。“半衰期”意指50%的所施用藥物通過生物過程例如新陳代謝、排泄等而被消除的時間。“肝首過代謝”意指藥物首次與肝接觸即在其首次通過肝臟期間被代謝的傾向。“分布體積”是指藥物在整個身體各個區室(例如細胞內和細胞外空間、組織和器官等)中的保留程度以及藥物在這些區室內的分布。“血清結合程度”意指藥物與血清蛋白(例如白蛋白)相互作用并結合的傾向,這導致藥物生物活性的降低或喪失。藥代動力學參數還包括給定量的所施用藥物的生物利用度、滯后時間(Tlag)、Tmax、吸收速率和/或Cmax。“生物利用度”意指血液區室中的藥物量。“滯后時間”意指藥物施用和其在血液或血漿中的檢測和可測量性之間的時間延遲。“Tmax”是達到藥物的最大血液濃度之后的時間,“吸收”被定義為藥物從施用位點移動到體循環中,“Cmax”是使用給定藥物所獲得的最大血液濃度。達到其生物學效應所需的藥物血液或組織濃度(藥物的)的時間受所有參數的影響。本文所用的術語“毒性”是指在不良事件或嚴重不良事件中表現出的藥物的毒性作用。這些負面事件可能是指在施用后藥物一般缺乏耐受性和/或缺乏局部耐受性。毒性還可包括由藥物引起的致畸或致癌作用。本文所用的術語“安全性”、“體內安全性”或“耐受性”定義了這樣的藥物施用,即并沒有直接在施用后(局部耐受性)以及藥物應用的較長時期內引起嚴重不良事件。“安全性”、“體內安全性”或“耐受性”可在例如治療和隨訪期間定期進行評價。測量包括臨床評價,例如器官表現以及實驗室異常情況篩查。可進行臨床評價,其可能偏離于根據NCI-CTC和/或MedDRA標準所記錄/編碼的常規發現。器官臨床表現可包括例如過敏/免疫、血液/骨髓、心律失常、凝血等的標準,如在不良事件通用術語標準(CommonTerminologyCriteriaforadverseevents,CTCAE)v3.0中所述。可檢測的實驗室參數包括例如血液學、臨床化學、凝血分布和尿液分析以及其它體液如血清、血漿、淋巴液或脊髓液、液體等的檢查。因此可通過例如體格檢查、成像技術(即超聲、x射線、CT掃描、磁共振成像(MRI))、采用技術裝置的其它測量(即心電圖)、生命體征,通過測量實驗室參數和記錄不良事件來評估安全性。本文所用的術語“有效且無毒的劑量”是指中和GM-CSF的化合物(優選如本文所定義的抗體)的可耐受劑量,其足夠高以治愈或穩定感興趣的疾病而沒有或基本上沒有主要的毒性作用。這種有效且無毒的劑量可以通過例如本領域描述的劑量遞增研究來確定,并且應當低于引起嚴重不良負面事件的劑量(劑量限制性毒性,DLT)。本發明的制劑(本文中有時也稱為“物質組合物”或“組合物”或“溶液”)可優選處于各種物理狀態,諸如液體、冷凍、凍干、冷凍干燥、噴霧干燥和重構制劑,其中優選液體和冷凍制劑。本文所使用的“液體制劑”是指為被發現為液體的物質組合物,其特征在于室溫下所述構成分子自身之間的自由移動但沒有分離傾向。液體制劑包括水性和非水性的液體,優選水性制劑。水性制劑是一種其溶劑或主要溶劑是水優選是注射用水(WFI)的制劑。中和GM-CSF的化合物在制劑中的溶解可以是均質的或異質的,如上所述優選是均質的。可以使用任何合適的非水性液體,只要其為本發明的制劑提供穩定性即可。優選地,非水性液體是親水性液體。合適的非水液體的示例性實例包括:甘油;二甲亞砜(DMSO);聚二甲基硅氧烷(PMS);乙二醇類,諸如乙二醇、二乙二醇、三乙二醇、聚乙二醇(“PEG”)200、PEG300和PEG400;丙二醇,諸如二丙二醇、三丙二醇、聚丙二醇(“PPG”)425和PPG725。本文所用的“混合的水性/非水性液體制劑”是指含有水(優選WFI)和另外液體組合物的混合物的液體制劑。當在本文中使用時,“制劑”或“組合物”是中和GM-CSF的化合物(即,活性藥物/物質)與優選為液體狀的藥物產品所需的其它化學物質和/或添加劑的混合物。本發明的制劑包括藥物制劑。所述制劑的制備包括將不同的化學物質包括活性藥物進行組合以產生最終藥用產品例如藥物組合物的過程。本發明制劑的活性藥物是中和GM-CSF的化合物。在某些實施方案中,待配制的中和GM-CSF的化合物基本上是純的和/或基本上是均質的(即基本上不含污染物質如蛋白質等,該污染物質可以是產品相關的和/或過程相關的雜質)。術語“基本上是純的”意指組合物包含至少約80%、優選約90%重量的化合物,優選至少約95%重量的化合物,更優選至少約97%重量的化合物,或最優選至少約98%重量的化合物,優選單體狀態的化合物。術語“基本上均質的”意為組合物包含至少約99%重量的化合物,優選單體狀態的化合物,其中排除溶液中各種穩定劑和水的質量。當在本文中使用時,術語“約”應理解為意指可以在各自的值或范圍(例如pH、濃度、百分比、摩爾濃度、氨基酸數、時間等)內存在變化,其可以比給定數值的高至5%、高至10%、高至15%或高至且包括20%。例如,如果制劑包含約5mg/ml的化合物,那么這被理解為意指制劑可具有在4mg/ml和6mg/ml之間的化合物,優選在4.25mg/ml和5.75mg/ml之間,更優選在4.5mg/ml和5.5mg之間/ml之間,甚至更優選在4.75mg/ml和5.25mg/ml之間,最優選為5mg/ml。如本文所使用的,定義為“(從)X到Y”的間隔等同于定義為“X和Y之間”的間隔。這兩個間隔具體包括上限以及下限。這意味著例如“5mg/ml至10mg/ml”或“5mg/ml和10mg/ml之間”的間隔包括5、6、7、8、9和10mg/ml的濃度以及任意給定的中間值。“穩定的”制劑是一種制劑,其中的中和GM-CSF的化合物在儲存時基本保持其物理穩定性和/或化學穩定性和/或生物活性,和/或與對照樣品相比未顯先出聚集、沉淀、破碎、降解和/或變性的顯著跡象,優選通過肉眼檢查顏色和/或透明度,或者通過UV光散射或通過尺寸排阻色譜法測量。用于測量蛋白質穩定性的各種其他分析技術是本領域中可獲得的,并且在PeptideandProteinDrugDelivery,247-301,VincentLeeEd.,MarcelDekker,Inc.,NewYork,N.Y.,Pubs.(1991)和Jones,A.Adv.DrugDeliveryRev.10:29-90(1993)中進行了綜述。本文所用的“儲存期間”意指制備卻不立即使用的制劑;而是在制備之后將包裝儲存,或是以冷凍狀態的液體形式,或是以用于以后重構成液體形式或其它形式的干燥形式。設想中和GM-CSF的化合物優選是穩定的,因為其在儲存期間、和/或在凍/融期間或之后、和/或在剪切應力(例如來自振蕩或來自過濾步驟)期間或之后基本不形成聚集體或亞可見/可見顆粒或片段/降解產物(例如,由于一種或多種上述原因)。因此,優選設想,相對于在儲存開始時或在進行一個或多個凍/融循環之前或在進行振蕩研究之前的所述中和GM-CSF化合物的量,不超過10%的中和GM-CSF的化合物,更優選不超過8%、甚至更優選不超過5%、特別優選不超過2%的中和GM-CSF的化合物形成聚集體、顆粒和/或片段。該穩定性優選適用于至少1個月的時間范圍、至少2個月或至少3個月;優選至少4個月、至少5個月或至少6個月;更優選至少9個月或至少12個月;甚至更優選至少18個月或至少24個月;最優選至少30個月或至少36個月或至少48個月或至少54個月或至少60個月。優選的儲存溫度條件為高達室溫(約20℃至約25℃),更優選約2-8℃,最優選的時間范圍為至少3年或甚至至少4年。在一些實施方案中,中和GM-CSF的化合物在溫暖氣候中的室溫(例如約30℃)下是穩定的。凍/融循環期間所述化合物根據上述參數優選是穩定的,這樣的凍/融循環的次數為至少一個循環,優選至少2、3或4個循環,更優選至少5、6或7個循環,最優選至少8、9或10個循環中。振蕩(例如在運輸中和GM-CSF的化合物期間的振蕩)期間所述化合物根據上述參數(例如在+5℃±3℃的溫度下,也參見實施例12d)優選是穩定的,這樣的振蕩的天數為至少1天,優選至少2、3或4天,更優選至少5、6或7天,甚至更優選至少8、9、10或11天,最優選至少12、13或14天。在替代方案中,設想中和GM-CSF的化合物優選在其不形成二聚體、寡聚物或片段的情況下是穩定的。換句話說,中和GM-CSF的化合物的穩定性可根據溶液中單體蛋白質的百分比確定,其中降解的(例如,片段化的)、顆粒的(例如,具有可見和/或亞可見顆粒)和/或聚集的蛋白質的百分比低。例如,包含GM-CSF中和化合物例如抗體的本發明制劑可包含至少90%、更優選至少92%、甚至更優選至少95%、特別優選至少98%、最優選至少99%的中和GM-CSF的化合物的單體。“聚集體”意指蛋白質分子之間的物理相互作用,其導致形成可能保持可溶性的共價或非共價二聚體或寡聚物(即高分子量實體,諸如三聚體或多聚體)。“聚集體”還包括降解的和/或片段化的蛋白質。聚集體例如可溶性聚集體的尺寸一般小于1μm。“亞可見顆粒”意指蛋白質分子(包括降解的或片段化的蛋白質)的物理相互作用,其形成導致尺寸大于1μm并且尺寸高達大約100μm的可逆或不可逆蛋白顆粒。可溶性聚集體和/或蛋白質分子(包括降解的或片段化的蛋白質)可接合在一起形成亞可見顆粒。“可見顆粒”在尺寸上通常大于100μm,并且可以是例如由較小亞可見顆粒、聚集體或蛋白質分子(包括降解的或片段化的蛋白質)形成的內在蛋白質可見顆粒,又或者是例如包含如來自儲存容器或運輸裝置的外來物質的外來可見顆粒。一些源自組合產品(例如硅膠滴)的外來或內在顆粒是液體而不是顆粒,但在一些試驗中可能被檢測為顆粒。如上文所述,許多不同的分析方法能夠用于檢測包含中和GM-CSF的化合物的制劑中聚集體的存在及其水平。這些包括但不限于,例如天然聚丙烯酰胺凝膠電泳(PAGE)、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)、基質輔助激光解吸電離飛行時間質譜(MALDI-TOFMS)、毛細管凝膠電泳(CGE)、尺寸排阻色譜(SEC)、分析超速離心(AUC)、場流分級(FFF)、沉降速度、UV光譜、差示掃描量熱法、比濁法、濁度法、尺寸排阻-高效液相色譜法(SE-HPLC)、反相高效液相色譜(RP-HPLC)、電噴霧離子化串聯質譜(ESI-MS)和串聯RP-HPLC/ESI-MS、流場流分離技術(flowfield-flowfractionationtechnique)和靜態和/或動態光散射。這些方法可以單獨使用,也可以組合使用。優選地,檢測包含中和GM-CSF的化合物的制劑中的聚集體和/或片段的存在和水平的分析方法是諸如SE-HPLC的尺寸排阻色譜法、分析超速離心法和不對稱場流分級法。測定中和GM-CSF化合物生物活性的方法是例如對結合(固定的)GM-CSF(或GM-CSF受體)的程度的測量,其是所謂的表面等離子體共振(SPR)。包含蛋白質的制劑的常見挑戰是聚集體隨時間、熱量或剪切應力的不可逆積累。通常,當聚集體沉淀時,它們形成容易檢測的大顆粒。然而,較小的非共價可溶性聚集體,其通常是沉淀形成大顆粒的前體,更難以檢測和量化。因此,對蛋白制劑中蛋白質的聚集進行檢測和量化的方法需要基于所評估的聚集體的種類。在上述方法中,確定蛋白制劑中可溶性共價聚集體的存在和/或其量的建議方法是:SEC/光散射、SDS-PAGE、CGE、RP-HPLC/ESI-MS、FFF和AUC。確定蛋白制劑中可溶性非共價聚集體的存在和/或其量的建議方法是:SEC、PAGE、SDS-PAGE、CGE、FFF、AUC和動態光散射。確定蛋白制劑中不溶性非共價聚集體的存在和/或其量的建議方法是:UV光譜、比濁法、濁度法、顯微鏡法、AUC、不對稱場流分級和動態光散射。亞可見顆粒也可以由降解的蛋白質、聚集體或更小的亞可見顆粒形成。確定亞可見顆粒的存在和/或其量的建議方法是:光散射例如靜態的(例如通過多角度激光散射)或動態的(例如通過光子相關光譜法)、納米顆粒跟蹤分析(NTA例如來自MalvernInstruments,Malvern,UK)、不透光度或其它液體粒子計數系統例如顯微鏡、動態影像(微流成像,例如Brightwell(CellBiosciences,Ottawa,CA)或FluidImagingTechnologies(Yarmouth,ME)的Image顆粒分析儀等)、流式細胞術和電子阻抗(Coulter)計數。此外,本發明的制劑優選提供改進長期儲存,這樣使得以液體形式或以冷凍形式、優選液體形式存在的中和GM-CSF的化合物在儲存過程中是穩定的。本文所使用的短語“長期”儲存應理解為意指制劑可儲存至少一個月、兩個月或三個月或更多、六個月或更多,優選一年和更多,或甚至2年、3年或4年或5年及更多。長期儲存也被理解為意指藥物組合物或在2-8℃或在環境溫度下、優選在2-8℃下儲存,由此該制劑優選不失去其生物活性至如本文所述的程度,和/或不形成聚集體如本文所述的程度,和/或包含單體至本文所述的程度。這些特性的檢測在本文其他地方進行描述。在本發明的一方面,制劑中的中和GM-CSF的化合物以液體形式穩定至少1個月、2個月、3個月;至少4個月、至少5個月;至少6個月;至少12個月;至少24個月;至少36個月;至少48個月、至少60個月。上述時間段之間的范圍也意在是本發明的一部分,例如9個月,諸如此類。另外,也意在包括使用任一上述值的組合作為上限和/或下限的數值范圍。優選地,制劑在室溫(約20℃至25℃)下穩定至少1個月,和/或在約2-8℃下穩定至少1、2、3、4、5、6、7、8、9、10、11或12個月,或更優選在約2-8℃下穩定至少2年、至少3年、至少4年或甚至至少5年。穩定性的另一個重要方面是根據本發明所述的組合物內的中和GM-CSF的化合物在儲存期間和儲存條件內(特別是溫度和可能的溫度變化)保持其生物活性或效力。活性或效力由例如化合物中和能力本身(其可在如上文所述基于細胞的試驗中進行測量)反映,或由GM-CSF中和化合物與GM-CSF或GM-CSF受體結合的能力反映。結合親和力可以通過SPR或本領域熟知的其它方法來評估,例如Biacore或Scatchard測定。通過將本文所述的中和GM-CSF的化合物添加到例如水溶液、緩沖液、張力調節劑,以及表面活性劑、氨基酸、抗氧化劑和/或螯合劑中的一種或多種、其中優選表面活性劑中來制備本發明的制劑。本領域普通技術人員會理解將各種組分的組合包括到制劑中可以以任何適當的順序進行。例如,緩沖液可最先、在中間或最后加入,張力調節劑可最先、在中間或最后加入,表面活性劑、氨基酸、抗氧化劑和/或螯合劑中的一種或多種可最先、在中間或最后加入。本領域普通技術人員還應當理解,這些化學物質中的某一些可能在某些組合中是不相容的,于是容易用具有相似特性但在相關混合物中相容的不同化學物質所替代。在本發明的一個優選方面,所述制劑包含緩沖液。本文所用的術語“緩沖液”或“緩沖劑”,包括那些將pH保持在所需范圍內的試劑。緩沖液是由弱酸及其共軛堿、或弱堿及其共軛酸的混合物組成的水溶液。它具有這種特性,即當加入少量強酸或強堿時溶液的pH變化非常小。在各種化學應用中,緩沖溶液被用作將pH保持接近恒定值的手段。一般而言,當在本發明的制劑中應用時緩沖液優選穩定中和GM-CSF的化合物。當在本文中使用時,“氨基酸緩沖劑”包括例如氨基酸堿基,例如組氨酸及其共軛鹽。氨基酸緩沖劑的一個實例是組氨酸/組氨酸氯化物。此實例優選應用于本發明。本文所述制劑的優選pH可選自以下范圍:約4至約10,優選約4至約6或約5至約7,更優選約5.5至約6.5。最優選地,pH約為5.8或正好5.8。因此,優選使用可將溶液保持在pH5-7的緩沖液。當在上下文的pH值/范圍使用時,術語“約”優選意指具有所述值上下±20%范圍的數值。當藥物組合物的pH設定為或接近生理水平時,施用時患者的舒適度最大。應當理解,可以根據需要調節pH以使特定制劑中的中和GM-CSF的化合物的穩定性和溶解度最大化,因此,在生理范圍之外的、但優選患者可耐受的pH在本發明的范圍內。可在本文所述制劑中使用的緩沖劑的非限制性實例包括:組氨酸、琥珀酸鹽、葡糖酸鹽、檸檬酸鹽、精氨酸、賴氨酸、天冬氨酸、谷氨酸、Tris(氨基丁三醇)、Bis-Tris、MOPS、ACES、TES、HEPES、EPPS、乙二胺、磷酸、馬來酸/磷酸鹽、2-嗎啉乙磺酸(MES)、磷酸鹽、乙酸鹽和二乙醇胺。優選的緩沖液為組氨酸、乙酸鹽和檸檬酸鹽緩沖液。更優選地,在本發明的制劑中應用組氨酸緩沖液,優選pH在5和7之間,更優選pH在5.5和6.5之間,甚至更優選pH為5.8。在本發明中應用的緩沖液是本領域所熟知的,并且通過已知方法制造且可從商業供應商處獲得。在一些實施方案中,在沒有氫氧化鈉(0mMNaOH)的情況下制備緩沖液的pH。在一個實施方案中,緩沖液是氨基酸及其鹽的混合物,例如組氨酸及組氨酸鹽的混合物,其可按比例預先測量,這樣在制備緩沖液期間不需要使用單獨的酸或堿來調節pH。在一些實施方案中,所述制劑進一步包含氫氧化鈉(NaOH)。在特定的實施方案中,所述制劑包含1-200mM,或少于50mM、少于40mM、少于35mM、少于30mM、少于25mM、少于20mM,或少于15mM,例如10mM的NaOH或更低,例如5mM或1mM的氫氧化鈉。除了中和GM-CSF的化合物和緩沖液之外,根據本發明所述的制劑還可包含其它物質,包括但不限于穩定試劑(穩定劑)。因此,在一個優選的方面,所述制劑包含也可用作張力調節劑的穩定劑。術語“穩定劑”是指改善或以其它方式增強制劑穩定性、特別是中和GM-CSF的化合物的穩定性的試劑。作為張力調節劑的穩定劑可以是非還原糖、糖醇或其組合。本發明所述液體組合物中的張力調節劑確保溶液的張力(即滲透壓)與正常生理流體基本相同,從而防止組合物施用后由于組合物與生理流體之間的離子濃度差異而引起的腫脹或快速吸收。通常,本文所述制劑的性質是這樣的,即所述制劑的滲透壓為約240至約500mOsmol/kg,更優選為約300至約450mOsmol/kg,甚至更優選為約350至約450mOsmol/kg,最優選為約400mOsmol/kg。優選地,穩定劑/張力調節劑可以是一種或多種非還原糖,諸如蔗糖或海藻糖;或一種或多種糖醇,諸如甘露醇或山梨醇,此外,還優選非還原糖和糖醇的組合。在某些實施方案中,組合物中的穩定劑/張力調節劑的濃度選自以下范圍:1-15%(w/v)、2-10%(w/v)、3-8%(w/v)、4-6.5%(w/w)、4.5-6%(w/v)。在特定的實施方案中,濃度為約5-6%(w/v)。在本發明制劑中應用的優選穩定劑/張力調節劑為山梨醇,優選其濃度5%(w/v)。在優選的實施方案中,本文所述制劑包含一種或多種額外的輔料。優選地,所述輔料選自表面活性劑、氨基酸、抗氧化劑、螯合劑及其組合可在本發明所述制劑中添加輔料,也稱為化學添加劑、共溶質或共溶劑,其優選使溶液(還以干燥或冷凍形式)中的中和GM-CSF的化合物穩定。優選地,輔料有助于穩定中和GM-CSF的化合物,但是應當理解,輔料可以另外有助于所述制劑的物理、化學和生物學特性。輔料是本領域所熟知的,并且其通過已知方法制備并可從商業供應商處獲得。優選的輔料是表面活性劑。術語“表面活性劑”一般包括那些屏蔽中和GM-CSF的化合物免受空氣/溶液界面誘導應力和溶液/表面誘導應力的試劑。這些界面應力可誘使蛋白質聚集和顆粒形成,導致不可接受的產品質量。界面應力的實例可以是蛋白質與以下項的接觸:i)空氣;ii)容器封閉材料,如橡膠柱塞、活塞、玻璃、載藥注射器;iii)生產相關材料,如鋼罐、管和泵;iv)冰,在凍/融期間等。向制劑中添加表面活性劑將減少蛋白質與疏水界面的相互作用,包括液體/空氣界面和冰/液體界面,以及蛋白質-蛋白質的相互作用。表面活性劑將減少在諸如冷凍、混合、過濾和泵送的操作期間所產生的亞可見和可見顆粒的量。表面活性劑的實例包括但不限于:非離子表面活性劑,諸如聚山梨醇酯(例如聚山梨醇酯80(PS80)或聚山梨醇酯20(PS20)(聚山梨醇酯通常也已知為商品名吐溫ICIAmericas);泊洛沙姆(例如泊洛沙姆188);Triton、十二烷基硫酸鈉(SDS);月桂基硫酸鈉(sodiumlaurelsulfate);鈉辛基糖苷(sodiumoctylglycoside);月桂基-磺基甜菜堿(sulfobetaine)、肉豆蔻基-磺基甜菜堿、亞油基(linoleyl)-磺基甜菜堿、硬脂基-磺基甜菜堿;月桂基-肌氨酸、肉豆蔻基-肌氨酸、亞油基-肌氨酸、硬脂基-肌氨酸;亞油基-甜菜堿、肉豆蔻基-甜菜堿、十六烷基-甜菜堿、月桂酰胺丙基-甜菜堿、椰油酰胺丙基-甜菜堿、亞油酰氨丙基-甜菜堿、肉豆蔻酰胺丙基-甜菜堿、棕櫚酰胺丙基(palmidopropyl)-甜菜堿、異硬脂酰胺丙基-甜菜堿(例如月桂酰氨丙基);肉豆蔻酰胺丙基-、棕櫚酰胺丙基-或異硬脂酰胺丙基二甲胺;甲基椰油酰基牛磺酸鈉或甲基油烯基牛磺酸二鈉(disodiummethylofeyl-taurate);Monaquat系列(MonaIndustries,Inc.,Paterson,NJ)、聚乙二醇、聚丙二醇和乙烯與丙二醇的共聚物(例如,普朗尼克(pluronics),PF68)。優選地,本文所述制劑中所用的表面活性劑選自以聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆及其組合中的一種或多種。所添加的表面活性劑的量使得蛋白質的聚集保持在可接受的水平(正如使用例如SEC-HPLC所測定的),同時還減少了在儲存、制造、冷凍/解凍、運輸等期間形成的亞可見或可見顆粒的量(正如通過光遮蔽、顯微鏡和基于動態成像的粒子計數系統如微流成像或FlowCAM所測量的)。在一些實施方案中,基于臨界聚集濃度(CAC)來確定制劑中表面活性劑的量。CAC是表面活性劑開始與蛋白質相互作用的濃度。表面張力測量值,例如來自張力計的測量值,可繪制在圖上以獲得與圖7類似的曲線。在第一不連續點處的表面活性劑濃度是CAC。在一些實施方案中,制劑中表面活性劑的量是高于CAC的量。在一些實施方案中,表面活性劑的量高于CAC但小于臨界膠束濃度(CMC)。在優選的實施方案中,對于高達200mg/mL的蛋白質濃度而言,本發明所述制劑包含濃度為約0.001%(w/v)至約1%(w/v)的、選自聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆及其組合的一種或多種表面活性劑。在一個更優選的實施方案中,聚山梨醇酯20與蛋白質的比例為約0.01:1至約3:1,優選約0.05:1至約2:1,更優選約0.1:1和約1.5:1之間,甚至更優選約0.1:1至約0.8:1,最優選約0.1:1至約0.2:1。對于80mg/mL的蛋白質濃度,聚山梨醇酯20的濃度為約0.001%(w/v)和約0.2%(w/v)之間,優選約0.005%和約0.15%(w/v)之間,更優選約0.007%(w/v)和約0.1%(w/v)之間,甚至更優選約0.007%(w/v)和約0.06%(w/v)之間,最優選約0.01%(w/v)。對于150mg/mL的蛋白質濃度,聚山梨醇酯20的濃度為約0.001%(w/v)和約0.4%(w/v)之間,優選約0.006%和約0.25%(w/v)之間,更優選約0.01%(w/v)和約0.18%(w/v)之間,甚至更優選約0.01%(w/v)和約0.1%(w/v)之間,最優選約0.02%(w/v)。在另一個實施方案中,聚山梨醇酯20與蛋白質的比例為約0.3:1至約3:1,優選約0.5:1至約2.0:1,更優選約0.5:1和約1.5:1之間,甚至更優選在約0.8:1至約1.2:1之間,最優選約1:1。對于80mg/mL的蛋白質濃度,聚山梨醇酯20的濃度為約0.02%(w/v)和約0.2%(w/v)之間,優選約0.03%(w/v)和約0.13%(w/v)之間,更優選約0.05%(w/v)和約0.08%(w/v)之間,最優選約0.07%(w/v)。對于150mg/mL的蛋白質濃度,聚山梨醇酯20的濃度為約0.04%(w/v)和約0.4%(w/v)之間,優選約0.06%(w/v)和約0.25%(w/v)之間,更優選約0.1%(w/v)和約0.15%(w/v)之間,最優選約0.13%(w/v)。在另一個更優選的實施方案中,聚山梨醇酯80與蛋白質的比例為約0.01:1至約3:1,優選約0.05:1至約2:1,更優選約0.1:1和約1.5:1之間,甚至更優選在約0.1:1至約0.6:1之間,最優選約0.3:1至約0.6:1。對于80mg/mL的蛋白質濃度,聚山梨醇酯80的濃度在約0.001%(w/v)和約0.2%(w/v)之間,優選在約0.004%(w/v)和約0.14%(w/v)之間,更優選約0.007%(w/v)和約0.1%(w/v)之間,甚至更優選約0.007%(w/v)至約0.05%(w/v)之間,最優選約0.04%(w/v)。對于150mg/mL的蛋白質濃度,聚山梨醇酯80的濃度為約0.001%(w/v)和約0.4%(w/v)之間,優選約0.007%(w/v)和約0.26%(w/v)之間,更優選約0.01%(w/v)和約0.2%(w/v)之間,甚至更優選約0.01%(w/v)和約0.08%(w/v)之間,最優選約0.04%(w/v)。在另一個實施方案中,聚山梨醇酯80與蛋白質的比例為約0.3:1至約3:1,優選約0.5:1至約2.0:1,更優選約0.5:1和約1.5:1之間,甚至更優選在約0.8:1至約1.2:1之間,最優選約1:1。對于80mg/mL的蛋白質濃度,聚山梨醇酯80的濃度為約0.02%(w/v)和約0.2%(w/v)之間,優選約0.04%(w/v)和約0.14%(w/v)之間,更優選約0.06%(w/v)和約0.09%(w/v)之間,最優選約0.07%(w/v)。對于150mg/mL的蛋白質濃度,聚山梨醇酯80的濃度為約0.04%(w/v)和約0.4%(w/v)之間,優選約0.06%(w/v)和約0.27%(w/v)之間,更優選約0.1%(w/v)和約0.16%(w/v)之間,最優選約0.13%(w/v)。其它優選的輔料可以是抗氧化劑或螯合劑。如本文所用,“抗氧化劑”是一種能夠減緩或防止其它分子氧化的分子。氧化是將電子從物質轉移到氧化劑的化學反應。抗氧化劑或螯合劑可用于減少由添加表面活性劑引入的氧化效應,該表面活性劑諸如聚山梨醇酯80或聚山梨醇酯20,其可在溶液中形成過氧化物。可在制劑中添加抗氧化劑和/或螯合劑諸如抗壞血酸(維生素C)、硫辛酸、褪黑激素、尿酸、胡蘿卜素、視黃醇、生育酚和生育三烯酚(例如α-生育酚(維生素E))、泛醌(輔酶Q)甲硫氨酸、半胱氨酸、檸檬酸、EDTA或DTPA。更優選地,以約3:1至約156:1的抗氧化劑:表面活性劑的摩爾比或以約1:1至約150:1的抗氧化劑:蛋白質的摩爾比添加甲硫氨酸、半胱氨酸或檸檬酸。更優選地,抗氧化劑:蛋白質的比例為約2:1至約100:1,甚至更優選約3:1至約20:1,最優選約3:1至約8:1。另一種可添加以穩定制劑中蛋白質的輔料為氨基酸。例如,本發明組合物所使用的氨基酸選自蘇氨酸、絲氨酸、脯氨酸、丙氨酸、纈氨酸、谷氨酰胺、甲硫氨酸、半胱氨酸、異亮氨酸、天冬氨酸、谷氨酸、精氨酸、甘氨酸、組氨酸、賴氨酸、苯丙氨酸、亮氨酸、天冬酰胺、色氨酸、酪氨酸及其組合。更優選地,氨基酸選自精氨酸、蘇氨酸、絲氨酸、丙氨酸、谷氨酰胺、甲硫氨酸、甘氨酸及其組合。本發明所述組合物中所使用的氨基酸的濃度范圍優選為約10mM至約100mM,更優選約50mM至約100mM。其他輔料的實例包括但不限于糖/多元醇,諸如蔗糖、乳糖、甘油、木糖醇、山梨醇、甘露醇、麥芽糖、肌醇、海藻糖、葡萄糖;聚合物,諸如血清白蛋白(牛血清白蛋白(BSA)、人SA或重組HA)、葡聚糖、PVA、羥丙基甲基纖維素(HPMC)、聚乙烯亞胺、明膠、聚乙烯吡咯烷酮(PVP)、羥乙基纖維素(HEC)、羥乙基淀粉(HES);非水溶劑,諸如多元醇(例如PEG、乙二醇和甘油)、二甲亞砜(DMSO)和二甲基甲酰胺(DMF);以及各種輔料如磷酸鉀、乙酸鈉、硫酸銨、硫酸鎂、硫酸鈉、三甲胺N-氧化物、甜菜堿、金屬離子(例如鋅、銅、鈣、錳和鎂)、CHAPS、單月桂酸酯、2-O-β-甘露糖酸甘油酯(mannoglycerate)或上述的任意組合。“冷凍保護劑”包括在生產、冷凍、儲存、處理、分配、重構或使用期間為冷凍蛋白質提供穩定性的物質。在一個特定的方面,“冷凍保護劑”包括保護蛋白質免受冷凍過程所誘發的應力的物質。冷凍保護劑可具有凍干保護作用。冷凍保護劑的非限制性實例包括糖,諸如蔗糖、葡萄糖、海藻糖、甘露醇、山梨醇、甘露糖和乳糖;聚合物,諸如葡聚糖、羥乙基淀粉、聚乙烯吡咯烷酮(PVP)和聚乙二醇;表面活性劑,諸如聚山梨醇酯(例如PS-20或PS-80);以及氨基酸,諸如甘氨酸、精氨酸、亮氨酸和絲氨酸。一般使用在生物系統中顯示低毒性的冷凍保護劑。如本文所述的二糖可以用作凍干保護劑或冷凍保護劑。“凍干保護劑”包括在凍干和隨后儲存期間防止或減少蛋白質化學或物理不穩定性的物質。一方面,由于干燥過程中水從組合物中被去除,凍干保護劑防止或減少蛋白質中的化學或物理不穩定性。在另一方面,凍干保護劑通過氫鍵結合幫助維持蛋白質的適當構象來穩定該蛋白質。因此,一方面,本文所述的二糖可用于在冷凍期間穩定中和GM-CSF的化合物。由于在冷凍期間的保護作用可能取決于二糖的絕對濃度(Carpenter等人,Pharm.Res.(1997),14:969-975),因此可能需要大于5%的濃度以最大化穩定性。在一個實施方案中,將凍干保護劑加入至本文所述的制劑中。本文使用的術語“凍干保護劑”包括在冷凍干燥或脫水過程(初級和次級冷凍-干燥循環)期間為蛋白質提供穩定性的試劑,其通過提供無定形玻璃狀基質并通過經氫鍵與蛋白質的結合,替代在干燥過程中除去的水分子。這有助于保持蛋白質構象,使凍干循環期間的蛋白質降解最小化,并提高產品的長期穩定性。將凍干保護劑以“凍干保護的量”添加到預凍干制劑中,這意味著在凍干保護量的凍干保護劑存在下凍干中和GM-CSF的化合物后,該化合物在凍干和儲存時基本上保持了其物理和化學的穩定性和完整性。凍干保護劑的非限制性實例包括糖,如蔗糖或海藻糖;氨基酸,如谷氨酸單鈉、甘氨酸或組氨酸;甲胺,如甜菜堿;溶致鹽,如硫酸鎂;多元醇,如三元或更高級糖醇,例如阿糖醇、木糖醇、山梨醇和甘露醇;聚乙二醇;普朗尼克(pluronics);以及上述的組合。優選地,凍干保護劑如上所述用于穩定劑。添加到制劑中的凍干保護劑的量,一般是當蛋白質制劑凍干時不會導致不可接受的蛋白質降解/聚集程度的量。另一優選的輔料可以是填充劑。本文所用的術語“填充劑”包括提供凍干產品的結構而不直接與藥物產品相互作用的試劑。除了提供藥學上優質的餅狀物之外,填充劑還可以賦予長期儲存時在改變崩解溫度、提供凍融保護和增強蛋白質穩定性方面有用的性質。填充劑的非限制性實例包括甘露醇、甘氨酸、乳糖和蔗糖。填充劑可以是結晶的(諸如甘氨酸、甘露醇或氯化鈉)或無定形的(諸如葡聚糖、羥乙基淀粉),并且通常以0.5%至10%的量用于蛋白質制劑中。優選地,本發明所述制劑中應用的填充劑促進了在美學上可接受的、均勻的或機械強度好的餅狀物的形成。填充劑還優選促進開孔結構的形成和提高重構的便捷性和速度。填充劑還優選減少或防止餅狀物崩解、共晶熔化或殘留水分的滯留。在另一方面,填充劑優選有助于保護中和GM-CSF的化合物抵抗應力(例如,物理和化學應力)并有助于維持蛋白質的活性。在一些實施方案中,制劑可任選地含有防腐劑。“防腐劑”是一種可以添加到本文所述制劑中以降低細菌活性的化合物。添加防腐劑可以例如促進多次使用(多劑量)制劑的生產。潛在防腐劑的實例包括十八烷基二甲基芐基氯化銨、氯化六烴季銨(hexamethoniumchloride)、苯扎氯銨(烷基芐基二甲基氯化銨的混合物,其中烷基為長鏈化合物)和芐索氯銨。其它類型的防腐劑包括芳香醇,諸如苯酚、丁醇和芐醇;尼泊金烷基酯,諸如尼泊金甲酯或尼泊金丙酯、鄰苯二酚、間苯二酚、環己醇、3-戊醇和間甲酚。本文最優選的防腐劑是芐醇。因此,在更優選的實施方案中,本發明的制劑是用于長期儲存的液體制劑,優選水性制劑,其包含約50mg/ml和約200mg/ml之間的中和GM-CSF的化合物,以及選自組氨酸、乙酸鹽和檸檬酸鹽的緩沖液,pH為約5至約7,所述制劑可另外包含蔗糖、海藻糖、甘露醇和/或山梨醇中的一種或多種作為穩定劑/張力調節劑,以及一種或多種選自聚山梨醇酯20、聚山梨醇酯80和泊洛沙姆的表面活性劑。在特別優選的實施方案中,本發明的制劑是用于長期儲存的液體制劑,優選水性制劑,其包含約50mg/ml和約200mg/ml之間的中和GM-CSF的化合物,更優選約80mg/ml或約150mg/ml;以及濃度為約20mM至約40mM、優選約30mM的組氨酸緩沖液,pH為約5.5至約6.5,更優選pH5.8;并且所述制劑可另外包含約4%至約6%、更優選約5%(w/v)的山梨醇以及聚山梨醇酯,例如聚山梨醇酯20或聚山梨醇酯80,其濃度為約0.005%(w/v)至約0.5%(w/v),優選約0.01%(w/v)至約0.04%(w/v)。如果在上述優選制劑中使用聚山梨醇酯20和約80mg/mL的蛋白質濃度,那么聚山梨醇酯20的濃度為約0.001%(w/v)和約0.2%(w/v)之間,優選約0.007%(w/v)和約0.11%(w/v)之間,更優選約0.007%(w/v)和約0.06%(w/v)之間,最優選約0.01%(w/v)。如果所用的蛋白質濃度為約150mg/mL,那么聚山梨醇酯20的濃度為約0.001%(w/v)至約0.4%(w/v)之間,優選約0.006%(w/v)和約0.25%(w/v)之間,更優選約0.01%(w/v)和約0.18%(w/v)之間,甚至更優選約0.01%(w/v)至約0.1%(w/v),最優選約0.02%(w/v)。在另一個實施方案中,如果在上述優選制劑中使用聚山梨醇酯20和約80mg/mL的蛋白質濃度,那么聚山梨醇酯20的濃度為約0.02%(w/v)和約0.2%(w/v)之間,優選約0.03%(w/v)和約0.13%(w/v)之間,更優選約0.05%(w/v)和約0.08%(w/v)之間,最優選約0.07%(w/v)。如果所用的蛋白質濃度為約150mg/mL,那么聚山梨醇酯20的濃度為約0.04%(w/v)和約0.4%(w/v)之間,優選約0.06%(w/v)和約0.25%(w/v)之間,更優選約0.1%(w/v)和約0.15%(w/v)之間,最優選約0.13%(w/v)。如果在上述優選制劑中使用聚山梨醇酯80和約80mg/mL的蛋白質濃度,那么聚山梨醇酯80的濃度為約0.001%(w/v)和約0.2%(w/v)之間,優選約0.004%(w/v)和約0.14%(w/v)之間,更優選約0.007%(w/v)和約0.1%(w/v)之間,甚至更優選約0.007%(w/v)和約0.05%(w/v)之間,最優選約0.04%(w/v)。如果所用的蛋白質濃度為約150mg/mL,那么聚山梨醇酯80的濃度為約0.001%(w/v)和約0.4%(w/v)之間,優選約0.007%(w/v)和約0.26%(w/v)之間,更優選約0.01%(w/v)和約0.2%(w/v)之間,甚至更優選約0.01%(w/v)和約0.08%(w/v)之間,最優選約0.04%(w/v)。在另一個實施方案中,如果在上述優選制劑中使用聚山梨醇酯80和約80mg/mL的蛋白質濃度,那么聚山梨醇酯80的濃度為約0.02%(w/v)和約0.2%(w/v)之間,優選約0.04%(w/v)和約0.14%(w/v)之間,更優選約0.06%(w/v)和約0.09%(w/v)之間,最優選約0.07%(w/v)。如果所使用的蛋白質濃度為約150mg/mL,那么聚山梨醇酯80的濃度為約0.04%(w/v)和約0.4%(w/v)之間,優選約0.06%(w/v)和約0.27%(w/v)之間,更優選約0.1%(w/v)和約0.16%(w/v)之間,最優選約0.13%(w/v)。此外,在一個實施方案中,本發明所述的中和抗GM-CSF抗體或其功能片段的制劑包含中和抗體約80mg/ml至約150mg/ml、山梨醇約5%(w/v)、L-組氨酸約30mM、聚山梨醇酯80約0.02%(w/v)至約0.04%(w/v),pH為約5.8。此外,在一個實施方案中,本發明所述的中和抗GM-CSF抗體或其功能片段的制劑包含中和抗體約80mg/ml,山梨醇約5%(w/v),L-組氨酸約30mM,聚山梨醇酯80約0.04%(w/v),pH為約5.8。此外,在一個實施方案中,本發明所述的中和抗GM-CSF抗體或其功能片段的制劑包含中和抗體約150mg/ml,山梨醇約5%(w/v),L-組氨酸約30mM,聚山梨醇酯80約0.04%(w/v),pH為約5.8。應當理解,所述組合物的某些組分可以與本領域已知的替代物互換。然而,本領域技術人員還將理解,包含某些組分將排除其它組分、濃度或該制劑制備方法的使用,原因包括但不限于化學相容性、pH、張力和穩定性。有益的是,本發明的液體制劑具有低且可行的粘度,其適合于皮下施用,諸如在即用型裝置中。由此,在約50和約1000[1/sec]之間的的剪切速率和約20℃的溫度下,根據本發明所述的制劑的粘度優選低于20mPa*s,更優選地在上述條件下低于15mPa*s。在一些實施方案中,本發明的液體制劑的粘度和/或穩定性隨時間保持低注射力。例如載藥注射器中制劑的力的測量在機器上進行,例如通用壓縮測試系統(Norwood,MA),其具有適于測試機構以保持注射器的附件。本文所述的制劑提供了既可通過手動裝置也可通過自動(例如,機械輔助)裝置進行皮下施用的可能性。在一個實施方案中,注射力是滑動力。在一些實施方案中,滑動力小于25N。在其它實施方案中,滑動力為0-20N、2-15N或4-11N。所述制劑在裝入注射器后可保持低注射力的時間為至少3個月、至少6個月、至少12個月、3個月、6個月、9個月、12個月、15個月、18個月、24個月、3-6個月、3-9個月、6-9個月、6-12個月、9-15個月、12-18個月、18-30個月或24-36個月。所述制劑可以儲存在冰箱中,例如2-8℃或5℃,或在室溫下,例如18-25℃或25℃。如本文所述,本申請大體涉及一個發現,即向包含中和GM-CSF的化合物的制劑中添加幾種物質可以減少制劑中這些化合物的聚集和/或降解/片段化。無論什么原因導致制劑中中和GM-CSF的化合物聚集或被降解,添加如本文所述的物質減少了制劑中中和GM-CSF的化合物的聚集/片段化。在某些實施方案中,添加所述物質減少了例如由儲存、暴露于升高的溫度、暴露于光、暴露于剪切應力、pH和離子條件及其任意組合而引起的制劑中的聚集/降解。本發明人發現的措施可用于減少中和GM-CSF的化合物、特別是配制成液體和冷凍形式的該化合物的聚集和/或降解/斷裂。因此,所減少的聚集/斷裂優選在液體制劑中觀察到。假定當直接以液體形式儲存并用于以后使用時,以冷凍狀態儲存并在使用前融化時,或者以干燥形式(諸如凍干、風干或噴霧干燥形式)制備并用于以后在使用前重構成液體形式或其它形式時,也可以觀察到聚集/降解的減少。因此,設想本文所述制劑可以通過本領域技術人員已知的任何方法儲存。非限制性的實例包括對制劑進行冷卻、冷凍、凍干和噴霧干燥,其中優選通過冷卻儲存。在一些情況下,將蛋白質制劑冷凍儲存。因此,期望所述制劑在這樣的條件包括在凍融循環下是相對穩定的。確定制劑的這種適應性的一種方法是使制劑樣品經歷至少一個,例如一個、三個、五個、七個和多達十個的凍融循環(例如通過在約-80℃±10℃下冷凍過夜,并在室溫下快速解凍,或在冰上緩慢解凍例如6小時),測定在凍融循環后積聚的低分子量/剪切(LMW)種類和/或高分子量/聚集(HMW)種類的量,并將其與凍融步驟之前樣品中存在的LMW種類或HMW種類的量進行比較。LMW或HMW種類的增加表明作為制劑一部分儲存的蛋白質的穩定性降低。尺寸排阻高效液相色譜(SE-HPLC)能用于確定LMW和HMW種類的存在。優選地,蛋白質制劑可以作為液體儲存。因此,如本文所述,期望液體制劑在這樣的條件下包括在各種溫度下是穩定的。例如,確定制劑適用性的一種方法是在若干溫度(例如2-8℃、15℃、20℃、25℃、30℃、35℃、40℃和50℃)下儲存樣品制劑,并監測隨時間所積聚的HMW和/或LMW種類的量。隨時間所積聚的HMW和/或LMW種類的量越小,所述儲存條件對制劑越好。此外,蛋白質的電荷分布可以通過陽離子交換高效液相色譜(CEX-HPLC)來監測。或者,制劑可以在凍干后儲存。進一步期望制劑在剪切應力的條件下是穩定的。確定制劑適用性的一種方法是在所期望的溫度(例如2-8℃、15℃、20℃、25℃、30℃、35℃、40℃和50℃,優選+5℃±3℃)下,在振蕩器例如垂直振蕩器上輕晃容器中制劑。該容器(例如小瓶)在振蕩器上存儲一段期望的時間段,例如多達14天或更長時間,與在相同溫度下但未振蕩儲存的對照進行比較。數據點收集可在例如0、1、2、3、4、5、6、7、8、9、10、11、12、14和14天后進行。振蕩儲存后積聚的低分子量(LMW)種類和/或高分子量(HMW)種類的量可以確定,并與未振蕩樣品中存在的LMW種類或HMW種類的量進行比較。LMW或HMW種類的增加表明作為制劑一部分儲存的蛋白質的穩定性降低。尺寸排阻高效液相色譜(SE-HPLC)可用于確定LMW和HMW種類的存在。在一些情況下,將制劑噴霧干燥,然后儲存。對于噴霧干燥,在干燥氣流的存在下將液體制劑霧化。水從制劑液滴中被除去到氣流中,得到藥物制劑的干燥顆粒。輔料可被包括在所述制劑中以(i)在噴霧干燥脫水期間保護蛋白質,(ii)在噴霧干燥后的儲存期間保護蛋白質,和/或(iii)賦予該溶液適于霧化特性。該方法與上述用于冷凍的方法類似,除了該樣品制劑是噴霧干燥而不是冷凍,在稀釋劑中重構,并且檢測重構的制劑中LMW種類和/或HMW種類的存在之外。與未凍干的相應樣品制劑相比,噴霧干燥樣品中LMW或HMW種類的增加表明噴霧干燥樣品的穩定性降低。術語“凍干的”或“冷凍干燥的”包括已經經歷干燥步驟如凍干的物質狀態,其中至少90%、優選95%、最優選98%的水分已被去除。因此,本文使用的術語“凍干”是指這樣的過程,通過該過程首先冷凍待干燥的材料,然后通過在真空環境中升華作用去除冰或冷凍的溶劑。輔料(例如凍干保護劑)可以包括在待凍干的制劑中,以便增強凍干產品在儲存時的穩定性。本文使用的術語“重構制劑”是指通過將凍干的蛋白制劑在稀釋劑中溶解以使中和GM-CSF的化合物分散在稀釋劑中而制備的制劑。本文使用的術語“稀釋劑”是藥學上可接受的(對人施用是安全和無毒的)物質,并且可用于制備液體制劑,例如在凍干后重構的制劑。稀釋劑的非限制性實例包括無菌水、注射用抑菌水(BWFI)、pH緩沖溶液(例如磷酸鹽緩沖鹽水)、無菌鹽水溶液、林格氏溶液、葡萄糖溶液或鹽和/或緩沖劑的水溶液。在本發明的另一方面,設想所述制劑用于治療。因此,本發明設想的藥物組合物(或藥物)包含本文所述制劑。在另一個實施方案中,本發明提供了一種治療受試者的方法,其包括施用治療有效量的本文所述制劑,其中所述受試者患有可以用中和GM-CSF的化合物進行有益治療的疾病或病癥。優選地,本文所述制劑用于預防和/或治療可以使用中和GM-CSF的化合物進行預防和/或治療和/或改善的疾病。術語“受試者”意在包括活的生物體。受試者的實例包括哺乳動物,例如人、狗、牛、馬、豬、綿羊、山羊、貓、小鼠、兔、大鼠和轉基因非人動物。在本發明的優選實施方案中,受試者是人。術語“有效劑量(dose)”或“有效用量(dosage)”被定義為足以實現或至少部分實現所期望效果的量。術語“治療有效劑量”被定義為足以治愈或至少部分阻止已經患有疾病的患者的疾病及其并發癥的量。該用途的有效量將取決于醫學病狀的嚴重性和受試者自身免疫系統的總體狀態。術語“患者”包括接受預防性或治療性治療的人和其他哺乳動物受試者。制劑的適當劑量或治療有效量將取決于待治療的病狀、治療前病狀的嚴重性以及患者的臨床病史和對治療劑的反應。可根據主治醫師的判斷來調整適當的劑量,以使得其可以一次或一系列施用于患者。所述藥物組合物可以作為單獨的治療劑施用或根據需要與其它治療方法組合施用。本發明的藥物組合物特別用于腸胃外施用,即皮下、肌內、靜脈內、關節內和/或滑膜內,其中優選皮下施用。腸胃外施用可以通過團注或連續輸注進行。用于注射的藥物組合物可以以添加有防腐劑的單位劑型存在,例如在安瓿或多劑量容器中。此外,已經開發了許多新的藥物遞送方法,本發明的藥物組合物適用于使用這些新方法進行施用,例如Inject-ease、Genject、注射筆諸如Genen,以及無針裝置諸如MediJector和BioJector。本發明藥物組合物也可以調整以適用于尚待發現的施用方法。參見Langer,1990,Science,249:1527-1533。凍干藥物組合物可優選存在于含有活性成分的小瓶中。在一個實施方案中,所述藥物組合物另外包含用于重構的溶液。所述藥物組合物可以進一步包含額外的藥學上可接受的組分。其它藥學上可接受的載體、賦形劑或穩定劑,諸如在Osol,A.所編著的第16版Remington'sPharmaceuticalSciences(1980)中所描述的那些,也可被包括在本文所述的蛋白質制劑中,條件是它們不會對制劑的預期特性造成不利影響。如本文所用的“藥學上可接受的載體”意指與藥物施用相容的任何和所有溶劑、分散介質、包衣、抗細菌劑和抗真菌劑、等滲劑和吸收延遲劑。這樣的用于藥物活性物質的介質和試劑的用途是本領域所熟知的。可接受的載體、賦形劑或穩定劑在所用劑量和濃度下對接受者是無毒的,其包括:張力調節劑;額外的緩沖試劑;防腐劑;共溶劑;抗氧化劑,包括抗壞血酸和甲硫氨酸;螯合劑如EDTA;金屬絡合物(例如Zn-蛋白絡合物);可生物降解的聚合物,諸如聚酯;成鹽抗衡離子,諸如鈉、多元糖醇;氨基酸,諸如丙氨酸、甘氨酸、天冬酰胺、2-苯丙氨酸和蘇氨酸;糖或糖醇,諸如乳糖醇、水蘇糖、甘露糖、山梨糖、木糖、核糖、核糖醇、肌糖(myoinisitose)、肌醇(myoinisitol)、半乳糖、半乳糖醇、甘油、環醇(例如肌醇)、聚乙二醇;含硫還原劑,諸如谷胱甘肽、硫辛酸、巰基乙酸鈉、硫代甘油、α-單硫代甘油和硫代硫酸鈉;低分子量蛋白質,諸如人血清白蛋白、牛血清白蛋白、明膠或其它免疫球蛋白;以及親水性聚合物,諸如聚乙烯吡咯烷酮。本文所述的制劑可用作治療和/或預防和/或改善有需要的患者的疾病或病癥的藥物組合物。術語“治療”是指治療性的治療和預防,或預防性措施。治療包括向患有疾病/病癥、具有疾病/病癥的癥狀或對疾病/病癥具有易感性的患者的身體、分離的組織或細胞應用或施用所述制劑,其目的是治療、治愈、減輕、解除、改變、補救、緩解、改善或影響疾病、疾病癥狀或對疾病易感性。那些“需要治療的”包括那些已經患有該病癥的,以及那些其中需要預防該病癥的。術語“病癥”是任何受益于使用本文所述蛋白質制劑進行治療的狀況。這包括慢性和急性的病癥或疾病,其包括那些使哺乳動物易患所述病癥的病理狀況。本文待治療的病癥的非限制性實例包括炎性和自身免疫性疾病,優選包括過敏性和銀屑病性疾病,以及關節炎性和哮喘性疾病,例如關節炎、類風濕性關節炎(RA)、自身免疫性腦炎、銀屑病、多發性硬化、肺病如哮喘、慢性阻塞性肺病(COPD)和急性呼吸窘迫綜合征(ARDS);克羅恩病、特發性肺纖維化(IPF)、炎性腸病(IBD)、葡萄膜炎、黃斑變性、結腸炎、華勒變性、抗磷脂綜合征(APS)、急性冠狀動脈綜合征、再狹窄、動脈粥樣硬化、復發性多軟骨炎(RP)、急性或慢性肝炎、失效骨科植入物、腎小球腎炎、狼瘡、特應性皮炎和炎癥、關節炎和骨關節炎疼痛。過敏性病癥是由過敏或過敏反應引起的任意病癥。過敏是免疫系統的超敏性病癥。過敏在人免疫系統對通常無害的外來物質(過敏原)如食物、花粉、霉菌、室塵、動物皮屑、塵螨等產生反應或過度反應時發生。銀屑病是主要影響皮膚的自身免疫性疾病。皮膚細胞的生長周期由于免疫系統發出的錯誤信號而加速。存在五種類型的銀屑病:斑塊狀、滴狀、皮褶、膿皰性和紅皮性。最常見的形式,即斑塊狀銀屑病,通常被看作是出現在表皮(皮膚)的頂部最上層上的紅色和白色色調的鱗片狀斑塊。然而,一些患者沒有皮膚病征兆或癥狀。該病癥是一種慢性復發性病狀,其嚴重程度不同,從輕微的局部斑塊到全身覆蓋。手指甲和腳趾甲經常受到影響(銀屑病性甲營養不良),可以看作是一個孤立的跡象。銀屑病還可導致被稱為銀屑病關節炎的關節炎癥。關節炎是涉及一個或多個關節的炎癥的關節病癥形式。存在超過100種不同形式的關節炎。最常見的形式,即骨關節炎(退行性關節病)是關節創傷、關節感染或衰老的結果。其它關節炎形式是類風濕性關節炎、銀屑病關節炎和其它相關的自身免疫性疾病。膿毒性關節炎是由關節感染引起的。哮喘是常見氣道慢性炎性病癥,其中許多細胞和細胞元件起作用。哮喘與氣道高反應性相關,導致反復發作的喘息、咳嗽、胸悶和呼吸短促。這些發作通常與肺內分布廣泛單獨但可變的氣流阻塞相關聯,所述氣流阻塞通常是自發性可逆的或通過治療可逆的。哮喘可以根據癥狀的頻率、一秒內強制呼氣量和呼氣峰流速來分類。哮喘還可以分類為特應性(外源性)或非特應性(內源性)。除中和GM-CSF的化合物之外,本發明的藥物組合物可包含另外的治療劑或生物活性劑。例如,可以存在用于治療特定適應癥諸如骨關節炎的治療因子(例如參與破壞關節軟骨或滑液組分的一種或多種抑制劑,選自但不限于抗金屬蛋白酶、環化素化合物、細胞因子拮抗劑、皮質類固醇、TNF抑制劑、IL-抑制劑、抗血管生成物質、聚蛋白多糖酶(aggrecanase)抑制劑、p38激酶抑制劑、細胞凋亡抑制劑、透明質酸酶抑制劑和蛋白水解酶抑制劑)。控制炎癥的因子包括英夫利昔單抗、依那西普(etanercerpt)、阿達木單抗(adalimulab)、nerelimonmab、lenercerpt等或其組合也可以是所述組合物的一部分。還設想所述藥物組合物可包括細胞外基質組分,例如透明質酸或其衍生物,包括其鹽、酯、內酯和硫酸鹽衍生物,優選透明質酸的偏酯。在另一個實施方案中,本發明涉及包含本發明制劑的試劑盒(或制品)或容器。所述制劑可優選已經處于液體狀態。然而,可替代的,其可優選處于凍干狀態。其也可以是冷凍、凍干、冷凍干燥或噴霧干燥的狀態。因此,如果所述制劑處于除液體之外的狀態,其可由醫生制備成(液體)水性藥物組合物。例如,所述制劑可以是凍干的,然后必須重構。因此,所述試劑盒可以進一步包括用于重構冷凍、凍干、冷凍干燥或噴霧干燥的制劑的工具和/或用于稀釋制劑的工具和/或用于分別施用制劑或藥物組合物的工具,例如注射器、泵、浸漬器、針等。所述試劑盒可以包含一個或多個含有本發明制劑的小瓶。所述試劑盒還可附帶使用說明。因此,提供了一種含有本文所述制劑的制品,并優選提供其使用說明書。所述制品包括適于容納制劑的容器。合適的容器包括但不限于瓶、小瓶(例如雙室小瓶)、注射器(例如單室或雙室注射器)、試管、霧化器、吸入器(例如定量吸入器或干粉吸入器)或儲藏器。所述容器可由各種材料形成,諸如玻璃、金屬或塑料(例如,聚碳酸酯、聚苯乙烯、聚丙烯、聚烯烴)。所述容器容納制劑,容器上的標簽或與容器相聯的標簽可以標明對重構和/或使用的指示。該標簽還可以標明所述制劑用于或旨在用于皮下施用。所述容納制劑的容器可以是多次使用的小瓶,其允許重復施用(例如,2-6次施用)所述制劑。所述制品還可以包括含有合適稀釋劑(例如WFI、0.9%NaCl、BWFI、磷酸鹽緩沖鹽水)的第二容器。當所述制品包含凍干形式的中和GM-CSF化合物制劑時,稀釋劑與凍干制劑的混合將在重構制劑中提供所期望的最終蛋白質濃度。所述制品可以進一步包括從商業和用戶角度來說所需的其它材料,包括其它緩沖液、稀釋劑、過濾器、針、注射器和具有使用說明的包裝說明書。本發明還包括可以用于遞送本發明制劑的裝置。這樣的裝置的實例包括但不限于注射器例如載藥注射器、筆、植入物、無針注射裝置、吸入裝置和貼片。本發明的組合物對于多方面是穩定的,包括由于它們在例如玻璃載藥注射器和藥筒中使用而產生的界面應力。已經確定橡膠配方、硅酮、鎢和固化劑與蛋白質溶液此消彼長地相互作用以形成聚集體、亞可見顆粒和可見顆粒。本發明的蛋白質制劑與載藥注射器/藥筒系統(包括封閉系統)中的組分相容。本發明通過附圖和實施例進行進一步說明,所述附圖和實施例僅僅是說明性的,而不構成對本發明范圍的限制。附圖說明圖1:儲存時間、儲存溫度和蛋白質濃度對抗GM-CSF抗體的單體水平的影響;圖2:以滲透壓[mOsmol/kg]為變量的標準化效果的帕累托圖;圖3:含80mg/mL抗GM-CSF抗體、5%山梨醇、30mM組氨酸和不同量的吐溫20的制劑中2-10μm顆粒的形成;圖4:含80mg/mL抗GM-CSF抗體、5%山梨醇、30mM組氨酸和不同量的吐溫80的制劑中2-10μm顆粒的形成;圖5:含150mg/mL抗GM-CSF抗體、5%山梨醇、30mM組氨酸和不同量的吐溫20的制劑中2-10μm顆粒的形成;圖6:含150mg/mL抗GM-CSF抗體、5%山梨醇、30mM的組氨酸和不同量的吐溫80的制劑中2-10μm顆粒的形成;圖7:抗GM-CSF抗體與表面活性劑的代表性表面張力曲線;圖8:在含有不同濃度的吐溫20或吐溫80的30mM組氨酸、5%山梨醇中80mg/mL抗GM-CSF抗體的≥10μm顆粒濃度隨凍/融循環次數的增加;圖9:在含有不同濃度的吐溫20或吐溫80的30mM組氨酸、5%山梨醇中150mg/mL抗GM-CSF抗體的≥10μm顆粒濃度隨凍/融循環次數的增加。下列項目也表征了本發明:1.一種組合物,其包含濃度為至少約20mg/ml的中和GM-CSF的化合物、張力調節劑、緩沖劑,并且包含表面活性劑、氨基酸、抗氧化劑和/或螯合劑中的一種或多種,其中所述組合物是穩定的。2.根據項目1所述的組合物,其包含中和GM-CSF的化合物、張力調節劑、緩沖劑和表面活性劑。3.根據項目1或2所述的組合物,其中所述中和GM-CSF的化合物以至少約50mg/ml的濃度存在,所述張力調節劑以約1%至約15%(w/v)的濃度存在,所述緩沖劑以約10mM至約50mM的濃度存在。4.根據項目1至3中任一項所述的組合物,其中所述張力調節劑選自甘露醇、山梨醇、蔗糖和/或海藻糖。5.根據項目1至4中任一項所述的組合物,其中所述緩沖劑選自組氨酸、乙酸鹽和/或檸檬酸鹽緩沖劑。6.根據項目1至5中任一項所述的組合物,其中所述表面活性劑選自聚山梨醇酯20、聚山梨醇酯80、泊洛沙姆以及組合中的一種或多種。7.根據項目1至6中任一項所述的組合物,其中所述中和GM-CSF的化合物以至少約50mg/ml且小于約200mg/ml的濃度存在,所述張力調節劑以約3%至約7%(w/v)的濃度存在,所述緩沖劑以約20mM至約40mM的濃度存在,并且所述表面活性劑以約0.001%至約1%(w/v)的濃度存在。8.根據項目1至7中任一項所述的組合物,其中所述pH為約5和約7之間。9.根據項目1至8中任一項所述的組合物,其中所述張力調節劑為山梨醇,并且所述緩沖劑為組氨酸緩沖劑。10.根據項目2至9中任一項所述的組合物,其進一步包含抗氧化劑。11.根據項目1至10中任一項所述的組合物,其中所述中和GM-CSF的化合物選自多肽、擬肽、核酸和小分子。12.根據項目11所述的組合物,其中所述多肽是與GM-CSF或GM-CSF受體結合的抗體或其功能片段。13.根據項目12所述的組合物,其中所述抗體或其功能片段是人單克隆抗體或其功能片段。14.根據項目12或13所述的組合物,其中所述抗體是IgG、IgG1或IgG4抗體。15.根據項目12至14中任一項所述的組合物,其中所述抗體或其功能片段與GM-CSF的表位結合,所述表位優選包含第23-27位氨基酸(RRLLN)和/或第65-77位氨基酸(GLR/QGSLTKLKGPL)。16.根據項目15所述的組合物,其中所述表位進一步包含:(i)第28-31位氨基酸(LSRD);(ii)第32-33位氨基酸(TA)和/或(iii)第21-22位氨基酸(EA)。17.根據項目15或16所述的組合物,其中所述表位是不連續的表位。18.根據項目12至17中任一項所述的組合物,其中所述抗體或其功能片段在其重鏈可變區中含有包含選自如SEQIDNO:1-13和56中任一項所示氨基酸序列的CDR3。19.根據項目18所述的組合物,其中所述重鏈可變區CDR3序列中的任一項和包含如SEQIDNO:14所示氨基酸序列的重鏈可變區CDR1以及包含如SEQIDNO:15所示氨基酸序列的重鏈可變區CDR2一起存在于重鏈可變區中。20.根據項目12至19中任一項所述的組合物,其中所述抗體或其功能片段在其輕鏈可變區中含有包含如SEQIDNO:16所示氨基酸序列的CDR1、包含如SEQIDNO:17所示氨基酸序列的CDR2和包含如SEQIDNO:18所示氨基酸序列的CDR3。21.根據項目12至20中任一項所述的組合物,其中所述抗體或其功能片段在其輕鏈可變區中包含如SEQIDNO:19、54和55中任一項所示的氨基酸序列。22.根據項目12至21中任一項所述的組合物,其中所述抗體或其功能片段在其重鏈可變區中包含如SEQIDNO:20-33、52和53中任一項所示的氨基酸序列。23.根據項目12至22中任一項所述的組合物,其中所述抗體或其功能片段在其輕鏈可變區中含有包含如SEQIDNO:16所示氨基酸序列的CDR1、包含如SEQIDNO:17所示氨基酸序列的CDR2和包含如SEQIDNO:18中所示氨基酸序列的CDR3;并且在其重鏈可變區中含有包含如SEQIDNO:14所示氨基酸序列的CDR1、包含如SEQIDNO:15所示氨基酸序列的CDR2和包含如SEQIDNO:1-13和56中任一項所示氨基酸序列的CDR3。24.根據項目12至23中任一項所述的組合物,其中所述抗體或其功能片段在其輕鏈可變區中含有包含如SEQIDNO:16所示氨基酸序列的CDR1、包含如SEQIDNO:17所示氨基酸序列的CDR2和包含如SEQIDNO:18中所示氨基酸序列的CDR3;并且在其重鏈可變區中含有包含如SEQIDNO:14所示氨基酸序列的CDR1、包含如SEQIDNO:15所示氨基酸序列的CDR2和包含如SEQIDNO:2所示氨基酸序列的CDR3。25.根據項目12至24中任一項所述的組合物,其中所述抗體或其功能片段包含如SEQIDNO:34所示的輕鏈氨基酸序列,以及選自如SEQIDNO:35-48中任一項所示的那些的重鏈氨基酸序列。26.根據項目12至25中任一項所述的組合物,其中所述抗體或其功能片段包含如SEQIDNO:34所示的輕鏈氨基酸序列以及如SEQIDNO:35所示的重鏈氨基酸序列。27.根據項目12至26中任一項所述的組合物,其中所述抗體或其功能片段包含與如SEQIDNO:1-48和52-56中任一項所示的相應氨基酸序列具有至少70%同源性的氨基酸序列,優選包含與如SEQIDNO:1-18和56中任一項所示的相應氨基酸序列、和/或與如SEQIDNO:19-48和52-55中任一項所示氨基酸序列中的框架區氨基酸序列具有至少70%同源性的氨基酸序列。28.根據前述項目中任一項所述的組合物,其包含:i)約50mg/ml至約180mg/ml的中和GM-CSF的化合物,ii)約5%(w/v)山梨醇,iii)約30mML-組氨酸,iv)約0.001%至約1%(w/v)表面活性劑,以及v)pH為約5.8。29.根據項目28所述的組合物,其包含約80mg/ml或約150mg/ml的中和GM-CSF的化合物。30.根據前述項目中任一項所述的組合物,其為液體,優選為水性組合物。31.根據前述項目中任一項所述的組合物,其在約2-8℃下穩定至少24個月,或在室溫下穩定至少28天。32.根據前述項目中任一項所述的組合物,其用于治療。33.根據前述項目中任一項所述的組合物,其用于靜脈內和/或皮下施用。34.根據前述項目中任一項所述的組合物,其用于治療炎性和自身免疫性疾病,優選包括過敏性和銀屑病性疾病,以及關節炎性和哮喘性疾病。35.一種試劑盒,其包含前述項目中任一項所述的組合物。36.根據權利要求35所述的試劑盒,其包括載藥注射器、藥筒或自動注射器。應當理解,本文所公開的發明不限于特定的方法、方案或試劑,因而它們是可以變化的。本文所提供的討論和實施例僅出于描述特定實施方案的目的而給出,其不旨在限制本發明的范圍,本發明的范圍僅由權利要求書限定。以下實施例將闡述本發明。實施例1:材料以下實施例用人單克隆IgG1抗體(下文中以“抗體”表示)進行,該抗體與高親和力的特異性人GM-CSF結合并中和,其在WO2006/111353中有描述。它的產生在WO2006/111353的實施例2中有描述。更具體地,該抗體包含如SEQIDNO:16、17、18、14、15和2中所示的輕鏈和重鏈CDR序列。這些CDR序列分別包含在重鏈和輕鏈可變結構域中,并分別在SEQIDNO:34和35中示出。GM-CSF在多種促炎癥和自身免疫性人類疾病中異常地過度產生,并且發現添加重組的GM-CSF會加重這些疾病。用GM-CSF中和抗體治療的可能的疾病適應癥包括類風濕性關節炎(RA)、哮喘和其它形式的肺部炎癥、多發性硬化(MS)和銀屑病。使用無血清和無蛋白質的培養基在生物反應器中產生抗體。由單個小瓶的抗體產生克隆制備生產發酵罐的接種物。在發酵過程完成后,通過過濾來對含有分泌抗體的收獲物進行處理,以將細胞和碎片從上清液中分離。基于常見的色譜方法對收獲物進行純化,以減少HCP、DNA和潛在的病毒。整體病毒滅活步驟是下游過程的另一附加部分。對于制劑,進行濃縮和緩沖液的更換步驟。實施例2:檢測方法建立尺寸排阻高效液相色譜法(SE-HPLC)以確定抗體的聚集程度(HPLC:Agilent1100Chemstation;柱:TosohBiosepTSKgelG4000SWXL)。通過進行九點范圍檢測來驗證SE-HPLC方法,從中確定并測試精度(六次重復注射)和線性度(三標準曲線)。所有試驗都使用100mMKH2PO4、200mMNa2SO4,pH6.6作為運行緩沖液進行。建立表面等離子體共振(SPR)方法以確定抗體與固定的GM-CSF的結合活性的程度(Biacore3000/CM5傳感器芯片/HBS-EP運行緩沖液)。通過進行九點范圍檢測來驗證SPR方法,從中確定并測試精度(六次重復注射)和線性度(三標準曲線)。進行還原和非還原SDS-PAGE以檢測抗體的降解產物(片段)和聚集體。對溶液中尺寸為約2-100μm的顆粒進行微流成像(MFI,Brightwell,Ottawa,CA)以量化內在和外部亞可見顆粒的量。使用WCX-10柱和TRIS/咪唑/哌嗪運行緩沖液中的pH梯度進行陽離子交換層析(CEX)以評估帶電荷的異構體。酸性異構體在主要異構體之前洗脫,堿性異構體在主要異構體之后洗脫。使用配有用于保持注射器的轉接器的通用壓縮測試系統來測試注射器滑動力。實施例3:pH和溫度應激的影響進行研究以評估抗體在pH值從3到10范圍內的低離子強度篩選緩沖液(LISSB:2mM甘氨酸、2mM檸檬酸、2mMHEPES、2mMMES和2mMTris)中的穩定性。將抗體樣品在各自的溶液中在55℃下儲存14天的時間。在T0、T7和T14(天)時分析樣品。SPR分析表明所述抗體在pH4-7下最穩定。當通過SE-HPLC分析時,發現所述抗體單體在pH4-6(T14)下最穩定。T14樣品的非還原和還原SDS-PAGE僅在pH4-6下顯示出最小的降解產物和聚集體的形成。實施例4:離子強度和溫度應激的影響進行研究以評估所述抗體在0、10、100和500mMNaCl存在下在低離子強度篩選緩沖液(LISSB)中的穩定性。將抗體樣品透析至含有額外NaCl的LISSB溶液(pH4.5和pH7.5)中,達到約1mg/ml的濃度,并在55℃下儲存14天的時間。在T0、T7和T14(天)時,通過SE-HPLC和SPR分析樣品。HPLC和SPR研究表明,添加鹽會使所述抗體的穩定性變差,并且此影響在pH4.5下比在pH7.5下更加顯著。此外,SE-HPLC數據顯示,在pH4.5下具有升高的鹽濃度(≥100mM)的抗體不穩定性主要導致所述抗體聚集體的積聚。在pH7.5下具有升高的鹽濃度(500mM)的抗體不穩定性主要導致抗體降解產物的積聚。在LISSBpH4.5、500mMNaCl中,抗體的沉淀水平(T7和T14)非常高。實施例5:緩沖液的影響進行研究以評估所述抗體在各種pH5-7的緩沖液中的穩定性。將抗體樣品透析至pH5、6和7的20mM檸檬酸鹽緩沖液;pH6和pH7的20mM磷酸鹽緩沖液;pH6和pH7的20mM琥珀酸鹽緩沖液;pH6和pH7的20mM組氨酸緩沖液;以及pH5和pH6的20mM乙酸鹽緩沖液中,達到約1mg/ml的濃度,并在55℃下儲存14天的時間。在T0、T7和T14(天)時,通過SE-HPLC、SPR以及還原和非還原SDS-PAGE分析樣品。SPR研究、HPLC單體和聚集體數據以及還原和非還原的SDS-PAGE表明,所述抗體在pH5的乙酸鹽緩沖液、pH6的組氨酸緩沖液和pH5、6和7的檸檬酸鹽緩沖液中最穩定(T14的數據)。實施例6:氨基酸的影響進行研究以評估所述抗體在添加有不同氨基酸的低離子強度篩選緩沖液(LISSB)中的穩定性。將抗體樣品在pH6的、含有250mM相應氨基酸的溶液中在55℃下儲存14天的時間。在T0、T7和T14(天)時分析樣品。SPR研究表明特別是谷氨酸、蘇氨酸、賴氨酸和纈氨酸(T14)的輕微穩定作用。HPLC數據表明,與沒有添加任何氨基酸的參照相比,谷氨酸、蘇氨酸和丙氨酸的穩定化和顯著效果分別導致增多了約2-3%的完整單體和減少了約30%、31%和20%的聚集體。實施例7:糖和表面活性劑的影響進行研究以評估所述抗體在添加有各種糖或表面活性劑的低離子強度篩選緩沖液(LISSB)中的穩定性。將抗體樣品用額外的6%(w/v)的糖(D-甘露醇、D-山梨醇、蔗糖,D-甘露糖、D-麥芽糖、D-海藻糖、D-葡萄糖)、0.05%(v/v)吐溫20或0.02%(v/v)吐溫80透析到pH6.0的LISSB溶液中,達到約1mg/ml的濃度,并在55℃下儲存14天的時間。在T0、T7和T14(天)時,通過SE-HPLC、SPR和還原和非還原SDS-PAGE分析樣品。SPR和HPLC研究表明D-山梨醇和D-甘露醇使所述抗體的穩定性分別提高約20%/3%(SPR/HPLC數據,T14)和14%/4%(SPR/HPLC數據,T14)。海藻糖和蔗糖均具有分別為7%/0.7%(SPR/HPLC數據,T14)和6%/2%(SPR/HPLC數據,T14)的降低作用。此外,HPLC數據表明,D-山梨醇和D-甘露醇使所述抗體聚集體的形成分別減少了43%和50%,這也得到了SDS-PAGE所得了數據的支持。如通過SE-HPLC、SPR和SDS-PAGE所測,0.05%(v/v)吐溫20和0.02%(v/v)吐溫80都不影響穩定性。實施例8:緩沖液、氨基酸和糖的組合的影響基于先前的研究,進行研究以評估在緩沖液、氨基酸和糖的組合中配制的1mg/ml抗體的穩定性。先前的研究表明了pH5的20mM乙酸鹽;pH6的20mM組氨酸;250mM的谷氨酸;250mM的蘇氨酸,6%(w/v)山梨醇和6%(w/v)的甘露醇的穩定作用。將所述抗體以5.4mg/ml的濃度配制成如表1所示的20mM的緩沖液、250mM的氨基酸和6%(v/v)的糖類的組合的溶液,并在55℃下儲存14天的時間。將1×PBS中的抗體作為對照。在T0、T7和T14(天)時,通過SE-HPLC和SPR分析樣品。此外,檢測包含1×PBS中的所述抗體(5.4mg/ml)的T0樣品對凍融易感性。將存儲小瓶在冷凍器中-20℃下緩慢冷凍。冷凍完成后,將樣品在室溫下融化。重復該過程直到完成五個凍融循環。在兩個和五個循環后檢查每一個樣品的SPR和SE-HPLC回收。表1:緩沖液、糖和氨基酸的組合(Ac=乙酸鹽緩沖液;His=組氨酸緩沖液;M=甘露醇;S=山梨醇)SPR數據顯示,相對于T0,在T14/55℃下樣品5-16中的結合活性>93%。對于1×PBS(樣品17)和樣品1-4(全部不含甘露醇或山梨醇)中的抗體,數值分別為62%、19%、26%、91%和85%。因此,SPR數據表明,添加甘露醇或山梨醇改善了結合活性的穩定性。此外,樣品1-4在T7和T14處呈黃色,這表明氧化。SE-HPLC數據顯示,在樣品5-8、11-12和15-16中發現最低水平的聚集體(3.5%-5.6%)和降解產物(4.2%-5.4%)(T14/55℃數據),這支持甘露醇和山梨醇對抗體單體的穩定作用,并表明添加250mM蘇氨酸的影響可能較小。然而,通過樣品5-8、11-12和15-16中發現的單體水平(分別為91.2%、89.8%、91.5%、90.8%、89.8%、89.0%、91.4%和90.9%)——對于樣品17(PBS),數值為80.3%(T14/55℃數據)——來判斷蘇氨酸的影響至少是最小的。250mM谷氨酸和山梨醇或甘露醇一起對抗體單體的穩定性有負面影響,特別是在乙酸鹽緩沖液中。總之,所述抗體單體似乎在pH5的20mM乙酸鹽緩沖液或pH6的20mM組氨酸緩沖液和6%(w/v)山梨醇或6%(w/v)甘露醇的組合中是最穩定的。來自凍/融實驗的SE-HPLC數據表明,在穩定抗體單體方面山梨醇的作用稍優于甘露醇。在5輪凍/融后,與樣品5和7中的單體含量為96.9%和96.0%相比,樣品6和8中單體的含量分別為98.6%和98.4%。實施例9:組氨酸或乙酸鹽緩沖液、山梨醇或甘露醇和吐溫20或吐溫80的組合的影響基于來自先前研究的穩定性數據(顯示穩定作用的,特別是pH5的20mM乙酸鹽、pH6的20mM的組氨酸、6%(w/v)山梨醇和6%(w/v)甘露醇的穩定作用),進行了新的研究以評估在組氨酸或乙酸鹽緩沖液、山梨醇或甘露醇、吐溫20或吐溫80的組合中配制的10mg/ml抗體的穩定性。由于抗體濃度為10mg/ml,還通過SE-HPLC檢測了添加0.02%(w/v)吐溫20和0.02%(w/v)吐溫80對聚集的影響。將所述抗體以10mg/ml的濃度配制到pH5.0的20mM乙酸鹽緩沖液或pH6.0的2mM組氨基酸緩沖液、并含如表2所示添加劑的溶液中,在55℃下儲存14天的時間。在T0、T7和T14(天)時,通過SE-HPLC和SPR分析樣品。另外,檢測抗體樣品對凍融的易感性。所述抗體以10mg/ml的濃度在-20℃下在冰箱中緩慢冷凍。冷凍完成后,將樣品在室溫下融化。重復該過程直到完成三個和/或五個凍融循環。在三個和/或五個凍融循環后,檢測每個樣品的SPR和SE-HPLC回收。表2:緩沖液、糖和洗滌劑的組合(Ac=乙酸鹽緩沖液;His=組氨酸緩沖液;M=甘露醇;S=山梨醇;T20=吐溫20;T80=吐溫80)HPLC數據顯示,盡管乙酸鹽和組氨酸之間存在微小差異,但組氨酸似乎至少與乙酸鹽一樣好。1周后,與不含表面活性劑的相應制劑相比,含有乙酸鹽、山梨醇和吐溫80,以及含有組氨酸、山梨醇和吐溫20的制劑具有相似的降解。凍融實驗表明,在五輪凍融后,洗滌劑對抗體單體的水平至少沒有影響。然而,與6%(w/v)甘露醇相比,當向所述試劑中添加6%(w/v)山梨醇時,所述抗體單體更穩定。加入甘露醇后,所述抗體單體在5輪凍融后聚集到更高程度。來自凍融實驗的HPLC數據顯示,使用乙酸鹽和組氨酸之間沒有差異。總之,通過HPLC測定,含有pH6.0的20mM組氨酸和6%(w/v)山梨醇的預制劑對于抗體單體的穩定性似乎是最佳的。實施例10:20mM組氨酸、6%(w/v)D-山梨醇的預制劑的短期穩定性評估在確定pH6.0的20mM組氨酸和6%(w/v)山梨醇作為最佳預制劑的基礎上,進行短期穩定性試驗以評價較高抗體濃度的預制劑。將所述抗體以約22、36、42、83和118mg/ml的濃度配制到上述溶液中。將配制的抗體在5℃和25℃下儲存長達4周的時間。在T0、T14和T28(天)時,通過SE-HPLC分析樣品。SE-HPLC數據清楚地顯示所述抗體在pH6.0的20mM組氨酸、6%(w/v)山梨醇中是穩定的。在5℃或25℃下儲存28天后,檢測到的抗體單體濃度總是高于97%,除了在25℃下測試的最高抗體濃度(118mg/ml),其中抗體單體濃度為約96.5%。結果在圖1中示出。實施例11:最終輔料的微調基于先前實驗中產生的數據,已經選擇山梨醇和組氨酸用于穩定抗體。在下一步中,使用“實驗設計”(DesignofExperiment,DOE),針對10-100mg/ml的抗體濃度,對輔料的量以及pH值進行微調,這包括3個中心點,得到30個單獨運行。隨機實驗計劃使用以下參數進行:抗體:10-55-100mg/ml,pH:5-6-7,組氨酸:10-30-50mM,山梨醇:2-6-10%(w/v)。為允許短期評價,將樣品在50℃的加速條件下應激14天。此外,進行三個凍融循環(-20℃)以模擬抗體儲存。結果:確定滲透壓以確保制劑的生理條件。對于所述抗體的靜脈或皮下應用,在250和450mOsmol/kg之間的滲透壓是可接受的范圍。如圖2所示,滲透壓主要由制劑中山梨醇的量控制。低濃度(10-50mM)下的組氨酸和所述抗體本身均對滲透壓具有最小的影響。滲透壓對山梨醇和組氨酸的濃度的依賴性可在等高線中描述。該等高線顯示,為將滲透壓維持在生理區間中,山梨醇的濃度在3%和7%(w/v)之間是必需的。所產生的數據表明山梨醇的最佳濃度為約6%,這導致相當高的滲透壓值。由于山梨醇一定程度的減少不影響所述抗體的穩定性,因此山梨醇濃度可以降低至5%以達到約400mOsmol/kg的滲透壓,由此增加患者的方便性。基于所產生的數據,將組氨酸的最佳濃度設定為30mM。通過SE-HPLC測量,在組氨酸濃度范圍在10mM和50mM之間時,沒有檢測到其對聚集或片段化有影響。所述抗體的聚集主要取決于濃度。抗體濃度的增加導致在凍/融期間和加速的溫度應激條件下聚集水平較高和澄清度值增加。此外,pH值影響抗體的單體含量。鑒于pH<6下的加速應激導致抗體片段化增多,在凍/融期間的穩定性不受影響,相反觀察到了稍好的穩定性。在pH>6的pH值下,針對加速溫度和凍/融處理兩者,可以使用SE-HPLC和澄清度分析來測量單體含量的減少。為了抵消相反的效果,pH5.8似乎最適合于所述抗體制劑。得到具有以下參數的制劑:此組合物的條件或參數也可以適用于具有更高抗體濃度的組合物,如以下實施例所示。實施例12:穩定性研究長期研究此研究被設計用于長達60個月的測試期。在此期間,抗體樣品在5℃±3℃下儲存在DINR2玻璃小瓶中。此外,25℃±2℃下的加速研究和40℃±2℃下的應激研究在DINR2玻璃小瓶中進行分別長達12個月和6個月。使用濃度為106mg/ml和145mg/ml的抗體,在含30mM組氨酸單鹽酸鹽和5%(w/v)山梨醇的制劑中在pH5.8下進行測試。測量以下參數:pH,滲透壓,濃度(OD280),單體、聚集體和片段的百分比(通過SE-HPLC),效力(基于細胞分析)。結果在以下表3-8中示出。表3:+5℃±3℃下的穩定性測試(106mg/ml抗體)表4:+5℃±3℃下的穩定性測試(145mg/ml抗體)表5:+25℃±2℃下的穩定性測試(106mg/ml抗體)表6:+25℃±2℃下的穩定性測試(145mg/ml抗體)表7:+40℃±2℃下的穩定性測試(106mg/ml抗體)表8:+40℃±2℃下的穩定性測試(145mg/ml抗體)加速/應激研究為了證明藥物物質的可比性,因此,抗體增長后,使用兩批在30mM組氨酸、5%山梨醇、pH5.8的溶液中配制的抗體濃度為165mg/ml和171mg/ml的藥物物質,在加速(25℃)和應激(40℃)條件下進行穩定性研究。測量了以下參數:pH,滲透壓,濃度(OD280),單體、聚集體和片段的百分比(通過SE-HPLC),效力(基于細胞分析)。抗體濃度為171mg/ml的結果在以下表9和10中示出。表9:+25℃±2℃下的穩定性測試(171mg/ml抗體)表10:+40℃±2℃下的穩定性測試(171mg/ml抗體)凍/融研究測試在30mM組氨酸(pH5.8)、5%山梨醇的溶液中配制的濃度為106mg/ml和145mg/ml的抗體的凍/融穩定性。所述抗體在-80℃±10℃下冷凍至少過夜。在室溫下進行融化≥6小時。進行0、1、3、5、7和10個凍/融循環。測量了以下參數:pH,滲透壓,濃度(OD280),單體、聚集體和片段的百分比(通過SE-HPLC),效力(基于細胞分析)。結果在以下表11和12中示出。表11:-80℃±10℃下的凍/融穩定性測試(106mg/ml抗體)表12:-80℃±10℃下的凍/融穩定性測試(145mg/ml抗體)結果和結論針對30mM組氨酸、5%山梨醇(pH5.8)的制劑中為約106mg/ml和約145mg/ml的抗體濃度,進行了長達60個月的長期穩定性研究,包括在加速和應激條件下。在加速和應激條件下,針對在30mM組氨酸、5%山梨醇(pH5.8)中高達約171mg/ml的抗體濃度進行另外的穩定性研究。在60個月期間,在+5℃±3℃下儲存的兩種濃度的樣品顯示出小于2%的聚集,并且與參照相比具有相同的效力。在加速條件(+25℃±2℃)下儲存12個月后,兩種濃度(106mg/ml和145mg/ml)均顯示出小于2%的聚集,并且與參照相比具有相同的效力。在應激條件(+40℃±2℃)下儲存6個月后,兩種濃度均顯示出小于5%的聚集,并且與參照相比具有大致相同的效力。另外的加速/應激研究的數據顯示在25℃和40℃下分別有3個月和1個月的穩定性。這表明,可以預期2-8℃下的穩定性與如上所述106mg/ml和145mg/ml的抗體濃度所獲得的穩定性相當。此外,30mM組氨酸、5%山梨醇、pH5.8中的抗體在兩個測試抗體濃度約106mg/ml和約145mg/ml下,在至少10個-80℃±10℃的凍/融循環期間是穩定的。實施例13:粘度評價使用流變儀測定在30mM組氨酸(pH5.8)和5%山梨醇溶液中所配制的濃度為150mg/ml的抗體的粘度。流變儀用于不能通過單一粘度值定義而因此需要比粘度計設置并測量更多參數的那些流體。對于一些流體而言,粘度在剪切速率很寬的范圍內是恒定的(牛頓流體)。不具有恒定粘度的流體(非牛頓流體)不能由單一數值描述。非牛頓流體顯現出剪切應力和剪切速率之間各種不同的相關性。因此,對于非牛頓流體,粘度取決于溫度以及剪切速率。在給定溫度和給定剪切速率[1/sec]下,粘度以毫帕斯卡*秒(mPas*s)表示。在20℃的溫度和約50和約1000[1/sec]之間的剪切速率下,含約150mg/ml抗體的制劑的粘度低于12mPas*s。在5℃的溫度和約50和約1000[1/sec]之間的剪切速率下,含約150mg/ml抗體的制劑的粘度低于20mPas*s。實施例14:攪拌/剪切應力下的穩定性用0、0.01、0.05、0.1%的吐溫20制備含5%山梨醇、30mM組氨酸、pH5.8的抗體濃度為80mg/mL的制劑,并用0、0.01、0.05、0.1和0.15%的吐溫20(20)(PS20)制備含5%山梨醇、30mM組氨酸(pH5.8)的蛋白質濃度為150mg/mL的制劑。這些制劑在剪切室或混合器中攪拌長達24小時,并在0、4、8和24小時時通過MFI測量亞可見顆粒。與不含吐溫的制劑相比,添加至少0.01%的20降低了亞可見顆粒形成的速率。用0、0.01、0.05、0.1%的80(PS80)制備含5%山梨醇、30mM組氨酸(pH5.8)的抗體濃度為150mg/mL的制劑,并用0、0.01、0.05、0.1和0.15%的80制備含5%山梨醇、30mM組氨酸(pH5.8)的蛋白質濃度為150mg/mL的制劑。將這些制劑在剪切室或混合器中攪拌長達8小時,并在0、4、6和8小時時通過MFI測量亞可見顆粒。與不含的制劑相比,添加至少0.01%的80降低了亞可見顆粒形成的速率。圖3-6示出了(作為每ml顆粒數乘以稀釋系數)針對在添加了20或80(%w/v)的30mM組氨酸、5%山梨醇、pH5.8中的80mg/mL和150mg/mL蛋白質(抗體)進行的附加測試的初步結果。對這些制劑進行剪切/攪拌以檢查其在溶液中形成亞可見顆粒的傾向,發現表面活性劑減少了亞可見顆粒的形成。因此,在制造和儲存期間需要表面活性劑來防止亞可見顆粒的形成,或減少亞可見顆粒的形成。實施例15:表面活性劑相互作用的評價進行表面張力測量以表征20和80與在5%山梨醇、30mM組氨酸、pH5.8中的80mg/mL和150mg/mL蛋白質的相互作用。得到類似于圖7的表面張力曲線。測定了臨界聚集濃度(CAC),其是表面活性劑開始與蛋白質相互作用的濃度。此外,還測定了臨界膠束濃度——表面活性劑膠束形成的濃度,其表明與蛋白質的相互作用處于平衡。表13總結了這些結果。對于兩種濃度,20和80以相似的CAC表面活性劑:蛋白質摩爾比與蛋白質發生相似相互作用。CMC在較高的蛋白質濃度下較高,但對于表面活性劑:蛋白質摩爾比,其在兩種蛋白質濃度下相似。20的CMC表面活性劑:蛋白質摩爾比80低。從表面張力測量看,表面活性劑與蛋白質相互作用的范圍是從CAC直至CMC。對于20,所述摩爾比范圍為大約0.004至2.6,而對于80,所述摩爾比范圍為大約0.003至3.3。蛋白質制劑中表面活性劑的最佳水平高于CAC。表13.表面張力曲線數據的總結CAC=臨界聚集濃度CMC=臨界膠束濃度實施例16:凍融穩定性在20(PS20)和80(PS80)濃度為0%、0.01%和0.1%的30mM組氨酸、5%山梨醇、pH5.8中的80mg/mL抗GM-CSF抗體制劑經過10個凍融循環后通過MFI來表征。如圖8所示,對于不含表面活性劑的制劑而言,≥10μm的顆粒隨凍融循環次數而明顯增加。從0.01%直至0.1%的20或80,顆粒沒有明顯增加。在20和80濃度為0%、0.05%和0.15%的30mM組氨酸、5%山梨醇、pH5.8中的150mg/mL抗GM-CSF抗體制劑經過10個凍融循環后通過MFI來表征。如圖9所示,對于不含表面活性劑的制劑中的一種,尺寸≥10μm的顆粒明顯增加。從0.05%直至0.15%的20或80,顆粒沒有明顯增加。實施例17:加速穩定性在20(PS20)和80(PS80)濃度為0%、0.05%和0.1%的30mM組氨酸、5%山梨醇、pH5.8中的80mg/mL抗GM-CSF抗體制劑,在40℃下加速穩定1周。所述樣品通過MFI(表14)和SE-HPLC(表15)進行表征。如MFI所測量,≥10μm的顆粒濃度在40℃下1周沒有增長。然而,如SE-HPLC所測量,多聚集體(HMW)增加。7天后,對于含有表面活性劑的制劑而言,HMW種類的量略高,但不顯著高于不含表面活性劑的制劑。此外,HMW濃度的增長不依賴于表面活性劑的量或表面活性劑的兩種不同類型。表14:80mg/mL抗GM-CSF抗體、30mM組氨酸、5%山梨醇、pH5.8在40℃下經過7天后顆粒濃度的增長NA=無法獲得表15:80mg/mL抗GM-CSF抗體、30mM組氨酸、5%山梨醇、pH5.8在40℃下經過7天的SE-HPLC結果20(PS20)和80(PS80)濃度為0%、0.1%和0.15%的30mM組氨酸、5%山梨醇、pH5.8中的150mg/mL抗GM-CSF抗體的制劑,在40℃下加速穩定1周。所述樣品通過MFI和SE-HPLC進行表征。如MFI所測量,≥10μm的顆粒濃度在40℃下1周沒有增長(表16)。然而,如SE-HPLC所測量(表17),可溶性聚集體(HMW)增加。HMW種類的增加速率在150mg/mL抗體時高于80mg/mL的抗體,但其不受制劑中表面活性劑的量或表面活性劑的類型影響。與不含表面活性劑的制劑相比,通過添加表面活性劑,7天后HMW種類的量略有增加,但沒有統計學上的顯著性。表16:150mg/mL抗GM-CSF抗體、30mM組氨酸、5%山梨醇、pH5.8在40℃下經過7天的顆粒增長表17:150mg/mL抗GM-CSF抗體、30mM組氨酸、5%山梨醇、pH5.8在40℃下經過7天的SE-HPLC結果實施例18:載藥注射器中的穩定性用來自3個不同制造商的具有不同的硅酮量、橡膠組分等的載藥注射器研究各種制劑的穩定性。此外,研究了安慰劑制劑。將制劑置于2-8℃和25℃下長達12個月。含有蛋白質、抗體(Ab)的制劑通過視覺外觀、SE-HPLC、陽離子交換層析和MFI進行表征,而安慰劑制劑通過視覺外觀和MFI進行表征。所研究的制劑在表18中示出。表18:用于穩定性分析的載藥注射器的情況制劑#組合物注射器制造商1150mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80A2150mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80B3150mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80C480mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80A580mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80B680mg/mLAb、30mM組氨酸、5%山梨醇、0.04%PS80C780mg/mLAb、30mM組氨酸、5%山梨醇、0.02%PS80A8150mg/mLAb、30mM組氨酸、5%山梨醇、0.02%PS80A930mM組氨酸、5%山梨醇、0.02%PS80A1030mM組氨酸、5%山梨醇、0.04%PS80A實施例19:載藥注射器中的穩定性用來自3個不同制造商的、具有不同硅酮油量和橡膠配方用于針罩的載藥注射器,其均是用于皮下施用的典型注射器,來對含有不同抗體濃度和聚山梨醇酯量的各種制劑的穩定性進行研究。這3個注射器制造商均使用相同的塞/柱塞配方。所選擇的聚山梨醇酯的量高于CAC,并且處于表面張力曲線中相當平坦的部分。此外,研究了安慰劑制劑。將制劑置于2-8℃和25℃下用于長期取樣。含有蛋白質的制劑通過視覺外觀、SE-HPLC、陽離子交換層析和MFI進行表征,而安慰劑制劑通過視覺外觀和MFI進行表征。所研究的制劑在表19示出,結果在表20-26中示出。對于80mg/mL的抗體制劑,對所有制劑和注射器類型而言,視覺外觀是無色,無可見顆粒,并且不隨時間改變。對于150mg/mL的抗體制劑,對所有制劑和注射器類型而言,視覺外觀是淡黃色,無可見顆粒,并且不隨時間改變。150mg/mL制劑的通過SE-HPLC所得的聚集體增加速率高于80mg/mL,表面活性劑的量并不影響聚集的速率。所檢測的所有制劑和注射器類型的電荷分布隨時間的變化是相同的。表19:用于穩定性分析的載藥注射器的情況表20:+5℃±3℃下儲存的載藥注射器制劑的SE-HPLC結果表21:+25℃/60%RH下儲存的載藥注射器制劑的SE-HPLC結果表22:+5℃±3℃下儲存的載藥注射器制劑的CEX結果表23:+25℃/60%RH下儲存的載藥注射器制劑的CEX結果表24:+5℃±3℃下儲存的載藥注射器制劑的注射力結果表25:+25℃/60%RH下儲存的載藥注射器制劑的注射力結果注射力結果顯示,對于所檢測的每種制劑和每個注射器,平均滑動力為約4-11N。該力的范圍給出了提供本文所描述的制劑中的抗GM-CSF抗體用于手工使用和自動注射器使用的可能性。表26:+5℃±3℃下儲存的載藥注射器制劑的MFI結果(顆粒/mL)NV—結果無效,因為流動池中存在氣泡,且無其他樣品可用。表27:+25℃/60%RH下儲存的載藥注射器制劑的MFI結果(顆粒/mL)NV—結果無效,因為流動池中存在氣泡,且無其他樣品可用。序列表<110>武田有限公司<120>包含GM-CSF中和化合物的液體制劑<130>1749<160>60<170>PatentInversion3.5<210>1<211>10<212>PRT<213>人工序列<220><223>CDR-H37A-701<400>1SerGlyLeuIleAlaAsnHisMetThrPro1510<210>2<211>10<212>PRT<213>人工序列<220><223>CDR-H37B1-502<400>2ThrThrLeuIleSerValTyrPheAspTyr1510<210>3<211>10<212>PRT<213>人工序列<220><223>CDR-H3L38-A1<400>3SerGlyLeuIlePheAspTyrTrpLeuAsp1510<210>4<211>10<212>PRT<213>人工序列<220><223>CDR-H3L38-A12<400>4SerGlyLeuIleIleAspAlaLeuSerPro1510<210>5<211>10<212>PRT<213>人工序列<220><223>CDR-H3L38-G7<400>5ThrSerLeuMetSerIleTyrPheAspTyr1510<210>6<211>10<212>PRT<213>人工序列<220><223>CDR-H3L39-D11<400>6SerGlyLeuLeuPheLeuTyrPheAspTyr1510<210>7<211>10<212>PRT<213>人工序列<220><223>CDR-H3E1-37-E7<400>7SerGlyLeuIleAsnLeuGlyMetHisPro1510<210>8<211>10<212>PRT<213>人工序列<220><223>CDR-H3M1_3-82<400>8SerGlyLeuIlePheAspAlaLeuArgAsp1510<210>9<211>10<212>PRT<213>人工序列<220><223>CDR-H3Ln4p-23<400>9SerGlyLeuIlePheAspLysLeuThrSer1510<210>10<211>10<212>PRT<213>人工序列<220><223>CDR-H3Ln4p-28<400>10SerGlyLeuIleAsnLeuHisPheAspThr1510<210>11<211>10<212>PRT<213>人工序列<220><223>CDR-H3Ln4p-50<400>11SerThrHisPheSerAlaTyrPheAspTyr1510<210>12<211>10<212>PRT<213>人工序列<220><223>CDR-H3Ln4p-65<400>12SerGlyLeuIleMetAspLysLeuAspAsn1510<210>13<211>10<212>PRT<213>人工序列<220><223>CDR-H3Ln4p-90<400>13SerGlyLeuIleIleAspAsnLeuAsnPro1510<210>14<211>5<212>PRT<213>人工序列<220><223>CDR-H17B1-502<400>14AspTyrLeuLeuHis15<210>15<211>17<212>PRT<213>人工序列<220><223>CDR-H27B1-502<400>15TrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPheGln151015Gly<210>16<211>11<212>PRT<213>人工序列<220><223>CDR-L15-306<400>16ArgAlaSerGlnAsnIleArgAsnIleLeuAsn1510<210>17<211>7<212>PRT<213>人工序列<220><223>CDR-L25-306<400>17AlaAlaSerAsnLeuGlnSer15<210>18<211>9<212>PRT<213>人工序列<220><223>CDR-L35-306<400>18GlnGlnSerTyrSerMetProArgThr15<210>19<211>107<212>PRT<213>人工序列<220><223>VL5-306*L-version<400>19AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleAlaCysArgAlaSerGlnAsnIleArgAsnIle202530LeuAsnTrpTyrGlnGlnArgProGlyLysAlaProGlnLeuLeuIle354045TyrAlaAlaSerAsnLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnSerTyrSerMetProArg859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>20<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=7A-701<400>20GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuIleAlaAsnHisMetThrProTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>21<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=7B1-502*<400>21GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgThrThrLeuIleSerValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>22<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=3077*<400>22GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuIleAlaValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>23<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=L38-A1<400>23GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspTyrTrpLeuAspTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>24<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=L38-A12<400>24GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleIleAspAlaLeuSerProTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>25<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=L38-G7<400>25GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgThrSerLeuMetSerIleTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>26<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=L39-D11<400>26GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuLeuPheLeuTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>27<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=E1-37-E7<400>27GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleAsnLeuGlyMetHisProTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>28<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=M1_3-82<400>28GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspAlaLeuArgAspTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>29<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=Ln4p-23<400>29GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspLysLeuThrSerTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>30<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=Ln4p-28<400>30GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleAsnLeuHisPheAspThrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>31<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=Ln4p-50<400>31GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerThrHisPheSerAlaTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>32<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=Ln4p-65<400>32GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleMetAspLysLeuAspAsnTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>33<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH=Ln4p-90<400>33GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleIleAspAsnLeuAsnProTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>34<211>214<212>PRT<213>人工序列<220><223>LightChain5-306*L-version<400>34AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleAlaCysArgAlaSerGlnAsnIleArgAsnIle202530LeuAsnTrpTyrGlnGlnArgProGlyLysAlaProGlnLeuLeuIle354045TyrAlaAlaSerAsnLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnSerTyrSerMetProArg859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>35<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=7B1-502*<400>35GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgThrThrLeuIleSerValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>36<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=7A-701*<400>36GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuIleAlaAsnHisMetThrProTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>37<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=L38-A1*<400>37GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspTyrTrpLeuAspTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>38<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=L38-A12*<400>38GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleIleAspAlaLeuSerProTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>39<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=L38-G7*<400>39GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgThrSerLeuMetSerIleTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>40<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=L39-D11*<400>40GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuLeuPheLeuTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>41<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=E1-37-E7*<400>41GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleAsnLeuGlyMetHisProTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>42<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=M1_3-82*<400>42GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspAlaLeuArgAspTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>43<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=Ln4p-23*<400>43GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIlePheAspLysLeuThrSerTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>44<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=Ln4p-28*<400>44GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleAsnLeuHisPheAspThrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>45<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=Ln4p-50*<400>45GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerThrHisPheSerAlaTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>46<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=Ln4p-65*<400>46GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleMetAspLysLeuAspAsnTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>47<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=Ln4p-90*<400>47GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095AlaArgSerGlyLeuIleIleAspAsnLeuAsnProTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>48<211>449<212>PRT<213>人工序列<220><223>具有CDR-H3的重鏈=3077*<400>48GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuIleAlaValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSerAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysLysValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgAspGluLeuThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>49<211>127<212>PRT<213>人GM-CSF<400>49AlaProAlaArgSerProSerProSerThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnGluThrValGluValIleSerGluMetPheAsp354045LeuGlnGluProThrCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuArgGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGluSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125<210>50<211>127<212>PRT<213>獼猴GM-CSF<400>50AlaProAlaArgSerProSerProGlyThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnLysThrValGluValValSerGluMetPheAsp354045LeuGlnGluProSerCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuGlnGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGlnSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125<210>51<211>127<212>PRT<213>長臂猿GM-CSF<400>51AlaProSerArgSerProSerProSerThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluIleAsnGluThrValGluValValSerGluMetPheAsp354045LeuGlnGluProThrCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuArgGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleIlePheGluSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGly115120125<210>52<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH7B1-502<400>52GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgThrThrLeuIleSerValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>53<211>119<212>PRT<213>人工序列<220><223>具有CDR-H3的VH3077<400>53GluValGlnLeuLeuGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaPheGlyTyrProPheThrAspTyr202530LeuLeuHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpVal354045GlyTrpLeuAsnProTyrSerGlyAspThrAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerIleSerThrAlaTyr65707580MetGluLeuSerArgLeuArgSerAspAspThrAlaValTyrTyrCys859095ThrArgSerGlyLeuIleAlaValTyrPheAspTyrTrpGlyGlnGly100105110ThrMetValThrValSerSer115<210>54<211>107<212>PRT<213>人工序列<220><223>VL5-306<400>54GluLeuValMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleAlaCysArgAlaSerGlnAsnIleArgAsnIle202530LeuAsnTrpTyrGlnGlnArgProGlyLysAlaProGlnLeuLeuIle354045TyrAlaAlaSerAsnLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnSerTyrSerMetProArg859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>55<211>107<212>PRT<213>人工序列<220><223>VL5-306*V-version<400>55AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleAlaCysArgAlaSerGlnAsnIleArgAsnIle202530LeuAsnTrpTyrGlnGlnArgProGlyLysAlaProGlnLeuLeuIle354045TyrAlaAlaSerAsnLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleAsnSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnSerTyrSerMetProArg859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>56<211>10<212>PRT<213>人工序列<220><223>CDR-H33077<400>56SerGlyLeuIleAlaValTyrPheAspTyr1510<210>57<211>127<212>PRT<213>人<400>57AlaProAlaArgSerProSerProSerThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnGluThrValGluValIleSerGluMetPheAsp354045LeuGlnGluProThrCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuArgGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGluSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125<210>58<211>127<212>PRT<213>長臂猿<400>58AlaProAlaArgSerProSerProSerThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnGluThrValGluValIleSerGluMetPheAsp354045LeuGlnGluProThrCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuArgGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGluSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125<210>59<211>127<212>PRT<213>獼猴<400>59AlaProAlaArgSerProSerProGlyThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnLysThrValGluValValSerGluMetPheAsp354045LeuGlnGluProSerCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuGlnGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGlnSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125<210>60<211>127<212>PRT<213>食蟹猴<400>60AlaProAlaArgSerProSerProGlyThrGlnProTrpGluHisVal151015AsnAlaIleGlnGluAlaArgArgLeuLeuAsnLeuSerArgAspThr202530AlaAlaGluMetAsnLysThrValGluValValSerGluMetPheAsp354045LeuGlnGluProSerCysLeuGlnThrArgLeuGluLeuTyrLysGln505560GlyLeuGlnGlySerLeuThrLysLeuLysGlyProLeuThrMetMet65707580AlaSerHisTyrLysGlnHisCysProProThrProGluThrSerCys859095AlaThrGlnIleIleThrPheGlnSerPheLysGluAsnLeuLysAsp100105110PheLeuLeuValIleProPheAspCysTrpGluProValGlnGlu115120125當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1