抗腫瘤中藥組合物及其制備方法與流程
本發明涉及抗腫瘤中藥技術領域,具體涉及一種抗腫瘤中藥組合物及其制備方法。
背景技術:
腫瘤(tumor)是機體在各種致癌因素作用下,局部組織的某一個細胞在基因水平上失去對其生長的正常調控,導致其克隆性異常增生而形成的新生物。一般認為,腫瘤細胞是單克隆性的,即一個腫瘤中的所有瘤細胞均是一個突變的細胞的后代。腫瘤的肉眼觀形態多種多樣,并可在一定程度上反映腫瘤的良惡性。醫學界一般將腫瘤分為良性和惡性兩大類,其中惡性腫瘤又稱為癌癥,可發生在身體的大多數組織器官,其主要臨床特征是生長迅速,對組織的浸潤性強,可轉移到身體其他部位,還會產生有害物質,破壞正常器官組織結構,使機體功能失調,嚴重的威脅患者生命。
世衛組織最新數據顯示,到2020年前,全球癌癥發病率將增加50%,即每年將新增1500萬癌癥患者。不僅如此,癌癥的死亡人數也在全球迅猛上升,2007年全球共有760萬人死于癌癥,2030年這個數字可能會增至1320萬。而且,全球20%的新發癌癥病人在中國,24%的癌癥死亡病人在中國。目前我國每死亡5人,即有1人死于癌癥,而在0—64歲人口中,每死亡4人,即有1人死于癌癥。在《2012中國腫瘤登記年報》中顯示,我國每分鐘就有6人被確診為癌癥患者,依此計算,我國每天就有8000多人被確診為癌癥,因而每年多達三百多萬新增癌癥病人。
目前尚未有特別有效的抗癌藥物,能有效改善癌癥患者癥狀的抗腫瘤藥物數量也很少,而且需要長期使用,相對于龐大的癌癥患者數量,目前可選的抗癌藥物不多,并且價格昂貴,使大量癌癥患者無法得到有效治療。
近年來西醫西藥對癌癥的治療出現靶向藥物和免疫細胞治療法。“靶向藥物”的意思是指這種藥物可以分清“敵”、“我”,只針對癌細胞,不損害健康細胞。正是因為靶向殺傷或抑制癌細胞而極少傷害正常細胞的靶向治療,該技術已經成為研究癌癥治療新技術的重要方向。“靶向藥物”按其作用的標靶不同又可分為以下幾種:(1)基因治療和病毒治療:早在2004年,全世界就有1020多個方案進入臨床,63.4%用于癌癥的治療。主要是用復制缺陷型載體轉運抗血管生成因子、抑癌基因、前藥活化基因以及免疫刺激基因。其中以腺病毒攜帶P53臨床進展最為迅速,全球至少有5個方案進入111期臨床試驗。但是,腫瘤基因治療仍存在很多障礙,主要問題是載體不能特異性靶向腫瘤細胞,治療基因在腫瘤細胞中高效表達低不足以消滅腫瘤,以及病毒載體外殼的改變等。
近年,治療腫瘤的抗體藥物研究取得了突破性進展。目前,國際上已有500多種抗體用于診斷與治療,美國FDA已批準18個抗體上市,其中8個用于腫瘤治療的靶向抗體。例如,治療淋巴瘤的抗體Rituxan已治療了30多萬病人,用于一線治療總反應率為60%—75%,其療效與化療相同;聯合化療有效率高達80%以上,完全緩解率達40%一63%;針對血管內皮生長因子的抗體Avastin使晚期結腸癌患者的生存期平均延長了5個月,目前美國95%結腸癌病人使用該藥。但是,目前抗體治療實體瘤仍存在著3個難題:抗體難以穿透實體腫瘤的細胞,因此,治療大體積實體腫瘤的療效仍不理想;生產成本及價格均非常昂貴;只能針對腫瘤細胞某個特異性受體,治療中需要為抗體標上同位素或毒素,但副作用也隨之增加。
腫瘤的發生、發展與細胞增殖、凋亡等信號傳導通路中某一個環節密切相關。信號傳導最重要的分子之一是蛋白質酪氨酸激酶,針對后者開發靶向藥物成了抗癌藥物的研究熱點之一。目前,已被美國FDA批準的小分子STI-571(GleeveC或GliveC)可特異性殺死腫瘤細胞。在過去的15年中,人們發現了多個可以穿入活細胞的小膚,用這些小膚攜帶外源物質進入細胞,效率非常之高。但是,目前這些方法還處于初步實驗,還有很多問題需要解決,如穿膜膚并非可以穿入所有細胞,其穿入機制也不明確,誘發免疫反應會干擾它在體內的療效等。
RNA干擾(RNAinterferenCe,RNAi)是一種由短的雙鏈RNA誘發的mRNA降解。這種現象發生在轉錄后水平,又稱為轉錄后基因沉默。RNAi只降解與之序列相應的單個內源基因的mRNA,具有很高的特異性與效率。接受了小干擾RNA基因藥物治療的移植瘤模型,可同時提高對化療藥物的敏感性。但是,RNAi的治療技術迄今沒有獲得廣泛應用,主要問題是RNAi不容易導入腫瘤組織,在體內的半衰期也比較短。
以蛋白酪氨酸激酶為靶點的新藥研發進展迅速。此激酶可催化ATP中γ一磷酸基轉移到多種蛋白質的酪氨酸殘基上,這在細胞生長、增殖和分化進程中具有重要作用。HerCeptinTM(GenenteCh與ROChe公司)是以酪氨酸激酶受體HERZ/neu為靶點的人源化單克隆抗體,與多種化療藥物有相加或協同效應。GleeveCTTM(瑞士NOvatiS公司)是針對酪氨酸激酶BCrAbl的一種特異性抑制劑。對治療慢性髓樣白血病具有非常好的療效,已被FDA批準提前上市,用于治療費城染色體呈陽性的慢性髓樣白血病患者。Iressa(AstraZeneca公司)是針對EGFR酪氨酸激酶的可口服的小分子抑制劑。2003年5月FDA批準用于經含鉑類或紫杉類方案化療失敗的晚期非小細胞肺癌,是第1個用于實體瘤治療的針對特定靶點的小分子酪氨酸激酶抑制劑。但是,小分子靶向藥物通常具有較大的毒副作用,而且存在明顯的個體差異,因而大部分小分子靶向藥物均在試驗性治療階段。
近年研究發現,有幾種細胞可以攜帶病毒載體進行系統給藥治療。這些細胞包括巨噬細胞、T細胞、NK細胞、異體腫瘤細胞以及目前研究最熱的干細胞等。這些腫瘤趨化細胞可以感應腫瘤微環境發出的信號,具有追蹤腫瘤、傳遞基因的作用,但仍需要更深入地研究。與傳統方法相比,應用干細胞治療疾病具有毒性低、一次用藥有效、不需要完全了解疾病發病的確切機理等優點。但是,由于間充質干細胞主要來源于骨髓,在放化療后的病人難以大量擴增這類細胞。
免疫細胞療法是向腫瘤患者輸入具有抗腫瘤活性的免疫細胞,直接殺傷腫瘤或激發機體抗腫瘤免疫反應,從而達到治療效果的生物療法。其操作包括細胞在體外的傳代、擴增、修飾、篩選及經藥物或其他能改變細胞生物學行為的處理;經體外操作后的體細胞可用于腫瘤治療,也可用于腫瘤預防。體細胞免疫治療已成為腫瘤患者放、化療后輔助治療的重要手段之一,其對于促進患者免疫系統的重建、消除殘留病灶及骨髓凈化都具有良好效果。但是,免疫細胞療法目前處于初級階段,主要用于輔助治療,而患者反應不一,部分病人對此療法不敏感。
從中醫角度上說腫瘤的病因病機:腫瘤是由虛、毒、瘀、結四端引起所致,其形成的根本原因為正氣虧虛,邪毒內蘊“其病機演變則為內蘊邪毒,耗氣傷血,正不抑邪,邪毒乘虛,流竄經絡、氣血、筋骨,客于臟腑,日久聚而成積其過程充分體現了因虛致病,又因病致虛,正虛邪盛,正不抑邪的惡性演變規律”。這與現代醫學對腫瘤發生機制的研究相吻合:虛——體現在機體免疫監控能力低下,而宿主低下的免疫狀態是影響腫瘤細胞轉移的重要因素,正虛的病理結果是腫瘤細胞在體內存活;毒——體現在余毒未清,手術、放、化療后仍殘存的亞臨床病灶,成為死灰復燃、轉移復發的根源;瘀——體現在血液的高凝、高粘及高聚狀態;結——體現在微瘤栓的附壁、著床及轉移瘤的迅速增殖和生長。
中醫治療癌癥主要以扶正祛邪、標本兼治為原則,但目前中醫治癌技術的發展也不盡人意。全國目前抗腫瘤中藥產品雖多,卻無法進入抗腫瘤主流藥物行列。下列簡述我國目前常見的幾類抗腫瘤中藥產品現狀。
抑制癌細胞中藥:包括康萊特注射液(主要成分:薏苡仁油)、消癌平注射液(主要成分:烏骨藤等)、鴉膽子油乳注射液(主要成分:鴉膽子提取物)、艾迪注射液(主要成分:黃芪、刺五加、人參、斑鰲提取物)、安爾欣注射液(主要成分:人參多糖)、華蟾素注射液(主要成分:中華大蟾蜍提取物)、金龍膠囊(主要成分:鮮守宮、鮮金錢白花蛇草)、抗腫瘤膠囊(主要成分:人參、斑鰲、半枝蓮、甘草、熊膽粉、女貞子等)、安替可膠囊(主要成分:蟾皮等)、博生癌寧透皮貼(主要成分:布魯生(Brucine)蟾蛛皮、番水鱉堿、藤黃素、大戟二烯醇、大黃素等)。這些中藥產品主要通過抑制或直接殺滅腫瘤細胞而達到抗癌作用。
提高免疫抗腫瘤中藥:包括莪術油注射液(主要成分:莪術油)、白花蛇舌草注射液(主要成分:白花蛇舌草提取物)、博爾寧膠囊(主要成分:黃芪、光慈菇、重樓、龍葵、紫蘇子、僵蠶、大黃等)、復方紅豆杉膠囊(主要成分:紫杉醇、人參皂甙、甘草甜素等)、樓蓮膠囊(主要成分:重樓、半邊蓮、半枝蓮、白花蛇舌草、蓬莪術、水蛙、水紅花子、新開河紅參、制何首烏、縮砂仁),等。這些中藥產品主要通過提高或激活患者體內免疫力而達到抑制腫瘤細胞增殖的作用。
止痛類抗腫瘤中藥:包括烏頭注射液(主要成分:生川烏、生草烏提取物)、嗎特靈注射液(主要成分:天然藥物苦參提取物)、抗癌平丸(主要成分:珍珠菜、蘭香草、百草霜、藤梨根、蛇毒、蟾酥、白花蛇舌草、石上柏、半枝蓮、腫節風、合成蛋白等)、科博肽(主要成分:眼鏡蛇神經毒素等),等。這些中藥產品主要通過消腫作用而減輕腫瘤導致的疼痛癥狀,有的還具有抑制腫瘤細胞增殖的作用。
扶正類抗腫瘤中藥:包括香菇多糖注射液(主要成分:香菇多糖)、云芝糖肽膠囊(主要成分:云芝多糖等)、天康寧膠囊(主要成分:桑蠶蛹和桑蠶卵)、貞芪扶正沖劑(主要成分:黃芪、女貞子)、參芪片(主要成分:人參、黃芪、當歸、鹿角膠等)、龜鱉丸(主要成分:全龜、全鱉)、龜甲養陰片(主要成分:龜甲、鱉甲、地黃、珍珠等)、峰齡膠囊(主要成分:野生峰齡孢子發酵提取物),等。這些中藥產品主要功能類似免疫增強劑的作用,通過增強機體抵抗力而達到抗腫瘤效果。
目前的抗腫瘤中藥組合物項目很多,但迄今未見有中藥產品可以取代西醫西藥的抗腫瘤治療。雖然當今中西醫對癌癥的治療雖有較大發展,但是尚無特別有效的方法可以解決癌癥的治療問題。
技術實現要素:
基于此,本發明提供一種抗腫瘤中藥組合物,具有高效抗腫瘤活性又無顯著毒副作用,且耐藥性低。
本發明還提供一種抗腫瘤中藥組合物的制備方法。
為了實現本發明的目的,本發明采用以下技術方案:
一種抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪15-45份、炒白術8-25份、白芍3-18份、柴胡8-25份、雞血藤8-35份、丹皮8-25份、生半夏8-35份、厚樸3-18份、蚤休8-25份、莪術8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份。
在其中一些實施例中,所述的抗腫瘤中藥組合物包括如下重量份的組分:
黃芪20-40份、炒白術10-20份、白芍5-15份、柴胡10-20份、雞血藤10-30份、丹皮10-20份、生半夏10-30份、厚樸5-15份、蚤休10-20份、莪術10-20份、蜈蚣5-15份、甘草3-10份、辣木籽5-15份、虎杖10-20份。
在其中一些實施例中,所述的抗腫瘤中藥組合物包括如下重量份的組分:
黃芪30份、炒白術15份、白芍10份、柴胡15份、雞血藤20份、丹皮15份、生半夏20份、厚樸10份、蚤休15份、莪術15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
本發明還采用如下的技術方案:所述抗腫瘤中藥組合物的制備方法為:
提供如下重量份的組分:黃芪15-45份、炒白術8-25份、白芍3-18份、柴胡8-25份、雞血藤8-35份、丹皮8-25份、生半夏8-35份、厚樸3-18份、蚤休8-25份、莪術8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份;
將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖置于提取容器中,加入上述藥物體積8-12倍的水,加熱所述提取容器,回流提取1.5h-2.5h,同時收集提取過程中產生的揮發油,提取完成后過濾,得到一次提取液;再向濾渣中加入濾渣體積6-10倍的水,繼續提取1h-2h,同時收集提取過程中產生的揮發油,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,濃縮至每毫升濃縮液含生藥量2-4克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。
在其中一些實施例中,所述的濃縮方法為:采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量2-4克。
本發明所述的抗腫瘤中藥組合物,經試驗,其對人肺癌A549細胞、鼻咽癌CNE-2Z細胞、骨肉瘤143B細胞、急性早幼粒細胞白血病HL-60細胞均具有高效的抑制作用,相比目前市場上用于治療肺癌、鼻咽癌、骨肉瘤、急性早幼粒細胞白血病的常規用藥長春瑞濱、尼莫司汀、甲氨蝶呤、維A酸等副作用低,不易誘發耐藥性,具有高效抗腫瘤活性又無顯著毒副作用,且藥物耐藥性低。
附圖說明
圖1是本發明實施例一所述的試驗中1號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
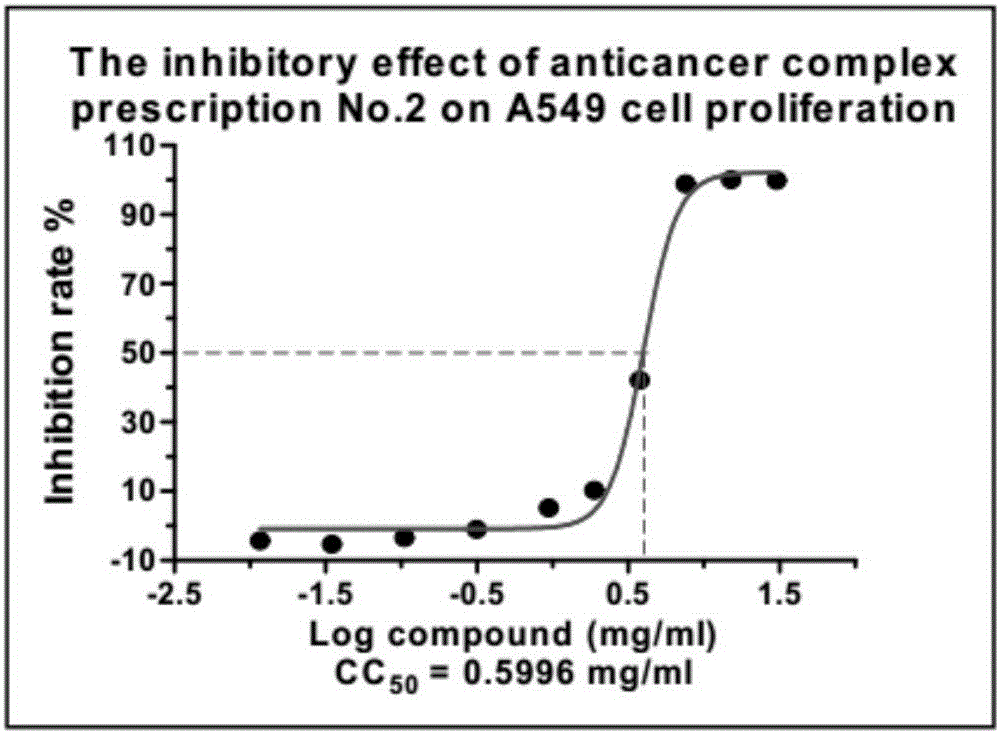
圖2是本發明實施例一所述的試驗中2號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖3是本發明實施例一所述的試驗中3號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖4是本發明實施例一所述的試驗中4號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖5是本發明實施例一所述的試驗中5號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖6是本發明實施例一所述的試驗中6號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖7是本發明實施例一所述的試驗中7號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖8是本發明實施例一所述的試驗中8號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖9是本發明實施例一所述的試驗中9號組對人肺癌A549細胞生長抑制率及CC50值曲線圖;
圖10是本發明實施例一所述的試驗中1號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖11是本發明實施例一所述的試驗中2號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖12是本發明實施例一所述的試驗中3號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖13是本發明實施例一所述的試驗中4號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖14是本發明實施例一所述的試驗中5號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖15是本發明實施例一所述的試驗中6號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖16是本發明實施例一所述的試驗中7號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖17是本發明實施例一所述的試驗中8號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖18是本發明實施例一所述的試驗中9號組對鼻咽癌CNE-2Z細胞生長抑制率及CC50值曲線圖;
圖19是本發明實施例一所述的試驗中1號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖20是本發明實施例一所述的試驗中2號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖21是本發明實施例一所述的試驗中3號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖22是本發明實施例一所述的試驗中4號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖23是本發明實施例一所述的試驗中5號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖24是本發明實施例一所述的試驗中6號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖25是本發明實施例一所述的試驗中7號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖26是本發明實施例一所述的試驗中8號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖27是本發明實施例一所述的試驗中9號組對骨肉瘤143B細胞生長抑制率及CC50值曲線圖;
圖28是本發明實施例一所述的試驗中1號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖29是本發明實施例一所述的試驗中2號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖30是本發明實施例一所述的試驗中3號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖31是本發明實施例一所述的試驗中4號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖32是本發明實施例一所述的試驗中5號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖33是本發明實施例一所述的試驗中6號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖34是本發明實施例一所述的試驗中7號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖35是本發明實施例一所述的試驗中8號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖;
圖36是本發明實施例一所述的試驗中9號組對急性早幼粒細胞白血病HL-60細胞生長抑制率及CC50值曲線圖。
具體實施方式
為了便于理解本發明,下面將對本發明進行更全面的描述。但是,本發明可以以許多不同的形式來實現,并不限于本文所描述的實施例。相反地,提供這些實施例的目的是使對本發明的公開內容的理解更加透徹全面。
除非另有定義,本文所使用的所有的技術和科學術語與屬于本發明的技術領域的技術人員通常理解的含義相同。本文中在本發明的說明書中所使用的術語只是為了描述具體的實施例的目的,不是旨在于限制本發明。
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪15-45份、炒白術8-25份、白芍3-18份、柴胡8-25份、雞血藤8-35份、丹皮8-25份、生半夏8-35份、厚樸3-18份、蚤休8-25份、莪術8-25份、蜈蚣3-18份、甘草3-15份、辣木籽3-18份、虎杖8-25份。
在其中一些實施例中,所述的抗腫瘤中藥組合物包括如下重量份的組分:
黃芪20-40份、炒白術10-20份、白芍5-15份、柴胡10-20份、雞血藤10-30份、丹皮10-20份、生半夏10-30份、厚樸5-15份、蚤休10-20份、莪術10-20份、蜈蚣5-15份、甘草3-10份、辣木籽5-15份、虎杖10-20份。
在其中一些實施例中,所述的抗腫瘤中藥組合物包括如下重量份的組分:
黃芪30份、炒白術15份、白芍10份、柴胡15份、雞血藤20份、丹皮15份、生半夏20份、厚樸10份、蚤休15份、莪術15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
其中,所述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖置于提取容器中,加入上述藥物體積8-12倍的水,加熱所述提取容器,回流提取1.5h-2.5h,同時收集提取過程中產生的揮發油,提取完成后過濾,得到一次提取液;再向濾渣中加入濾渣體積6-10倍的水,繼續提取1h-2h,同時收集提取過程中產生的揮發油,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,濃縮至每毫升濃縮液含生藥量2-4克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。在提取之前還可將上述的藥品均進行粉碎,然后經40℃-50℃熱水浸泡一段時間后再進行提取。其中的過濾方法為:采用高速離心或壓濾等方法。
其中,所述的濃縮方法為:采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量2-4克。
當然,提取次數不限于兩次,還可以進行兩次以上的提取,合并多次提取液再進行過濾。提取次數越多,后面濾液所含的藥物成分就越少。兩次提取可基本達到80%-90%的提取率。
以下將通過幾個實施例來進一步說明本發明的方案。
實施例一
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪30份、炒白術15份、白芍10份、柴胡15份、雞血藤20份、丹皮15份、生半夏20份、厚樸10份、蚤休15份、莪術15份、蜈蚣10份、甘草6份、辣木籽10份、虎杖15份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積10倍的水,加熱所述提取容器,待沸騰后開始回流提取2h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;再向濾渣中加入濾渣體積8倍的水,繼續提取濾渣1.5h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量3克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
采用實施例一所述的藥物浸膏進行樣品試驗如下:
試驗浸膏樣品的制備:稱取米粒大小的浸膏至離心管中,按1ml的量逐次加入蒸餾水,震蕩溶解,至溶液澄清,離心機離心1000rpm*3min,用移液槍將上清液移至干凈試管A內。向離心管底部的沉淀物中加少許蒸餾水,震蕩溶解,肉眼觀察是否溶解完全,若沉淀物的量不隨溶液量增加而減少,則停止加液,記錄下總共加入的蒸餾水的體積x ml。并將攪拌使試管內的溶液混勻,將該試管內的溶液分裝在兩個EP管內,每管5ml,EP管密封,并標明處方號、浸膏濃度、日期。按照表一所述的實驗設計進行試驗:
表一抗癌中藥復方9個樣本抗腫瘤實驗設計表
抗腫瘤活性實驗部分:
瘤細胞試驗:按照《細胞毒類抗腫瘤藥物非臨床研究技術指導原則》(中國新藥與臨床雜志,27(6):462,2008),進行體外抗腫瘤細胞試驗,測定9個中藥復方的抗腫瘤活性。采用培養腫瘤細胞,觀察細胞生長速度,以合適的細胞密度2.0-5.0×103cells/well接種于96孔培養板,培養16-24小時后,加入10個梯度濃度的化合物(9個中藥抗癌復方樣品),孵育培養72小時后CCK-8法測定細胞活力,得出不同濃度的中藥復方提取物對人肺癌A549細胞、鼻咽癌CNE-2Z細胞、骨肉瘤143B細胞、急性早幼粒細胞白血病HL-60細胞的增殖抑制率及CC50值。
一、細胞培養:采用RPMI-1640培養基,10%FBS培養人肺癌A549細胞、鼻咽癌CNE-2Z細胞、骨肉瘤143B細胞,置于37℃、5%二氧化碳培養箱中培養。每日使用倒置顯微鏡觀察細胞1次,隔2-4天換培養液一次。培養瓶中的細胞生長到80%~95%融合時進行細胞傳代或收集細胞鋪板培養。棄去舊培養液,加入0.25%胰酶消化液2ml,細胞變圓﹑上浮后,加入4ml培養液終止消化,再轉移至無菌離心管中,1000r/min離心4min,棄上清液,以1:4-1:6比例轉移至新的無菌培養皿中培養。采用IMDM培養基,20%FBS培養人急性早幼粒細胞白血病HL-60細胞,置于37℃、5%二氧化碳培養箱中培養。每日使用倒置顯微鏡觀察細胞1次,隔2-4天換培養液一次。培養瓶中的細胞生長到80%~95%融合時進行細胞傳代或收集細胞鋪板培養。將細胞懸液轉移至無菌離心管中,1200r/min離心5min,棄上清液,以1:4-1:6比例轉移至新的無菌培養皿中培養。
二、藥物配制:受試的中藥抗癌復方提取物中采用含5%FBS的RPMI-1640培養基配制,2-4倍梯度稀釋,配制成9個濃度梯度濃度的工作液。
三、細胞鋪板:收集對數生長期的A549、143B、CNE-2Z細胞,計數,用5%FBS的RPMI-1640培養基重懸細胞,調整細胞濃度2.22~5.55×104Cells/ml,接種96孔板,每孔加90μl的細胞懸液約2000~5000個細胞,在37℃,5%CO2條件下孵育過夜。收集對數生長期的HL-60細胞,計數,用10%FBS的IMDM培養基重懸細胞,調整細胞濃度1.66~2.22×105Cells/ml,接種96孔板,每孔加90μl的細胞懸液約15000~20000個細胞,在37℃,5%CO2條件下孵育培養。
四、細胞給藥:待A549、143B、CNE-2Z細胞鋪板孵育過夜后(待HL細胞鋪板孵育1-4小時后),棄去原培養基,每孔對應加入9個梯度濃度的工作液10μl(第1,2個高濃度給藥孔直接加入10-20μl的樣品母液),置于37℃含5%CO2培養箱中孵育72小時;同時設立不加化合物加細胞的陰性對照組Ac和不加細胞及化合物的空白對照組Ab。
五、吸光度測定:加藥72小時后,棄去原培養基,加入100μl含10%CCK-8的DMEM培養基置于37℃培養箱中孵育1.5-2.5小時,酶標儀450nm處檢測各孔的吸光度(A)值。
數據處理:按下式計算藥物對腫瘤細胞生長的抑制率:腫瘤細胞生長抑制率%=[(Ac-As)/(Ac-Ab)]×100%;其中,As:樣品的吸光度(細胞+CCK-8+待測化合物);Ac:陰性對照的吸光度(細胞+CCK-8+DMSO);Ab:空白對照的吸光度(培養基+CCK-8+DMSO),并采用Graph Pad Prism 5軟件分析數據及作圖。數據處理軟件分別計算各化合物在72小時的CC50值。
結果:本次實驗的9個中藥抗癌復方樣本人肺癌A549細胞、鼻咽癌CNE-2Z細胞、骨肉瘤143B細胞、急性早幼粒細胞白血病HL-60細胞均有一定療效;CC50值在0.4mg/ml至25mg/ml之間。按照一定的濃度梯度給藥48h后,顯微鏡下觀察可明顯看到細胞生長活性的變化,由高濃度向低濃度給藥孔、陰性對照孔,細胞的數量是逐漸增多的;在前面的幾個高劑量孔可明顯看到較多的細胞碎片,細胞的整體活性較差。中藥復方1-3號樣品的濃度較低,個別樣高濃度給藥孔對細胞的最大抑制率低于50%未能得到CC50值。中藥抗癌復方4號、6號、7號、8號、9號均有較好的抑瘤療效;CC50值在10mg/ml以內(具體實驗結果如下圖“中藥抗癌復方對A549、CNE-2Z、143B、HL-60細胞增殖抑制療效曲線圖”所示)。實驗采用Cell Counting Kit-8試劑盒進行檢測,活細胞越多孵育的時間越長則顏色越深,相對應的450nm吸光度值越大。由于中藥抗癌復方樣本有顏色,HL60細胞是懸浮生長的細胞,檢測前不能換液,對檢測值會造成直接影響。檢測時,高濃度給藥孔的吸光度值較高,而實際鏡下觀察高濃度給藥孔的細胞較少、活性較差;這里觀察結果與檢測值出現偏差,檢測值僅做參考。建議盡量避免選取懸浮細胞做藥效篩選。實驗周期較長樣品反復凍融放置一段時間后可在管底析出沉淀,提示樣品的溶解度、穩定性、均一性較差;這也造成了個別樣本重復實驗的結果波動較大。
附圖1-36分別示出了1-9號試驗組分別對人肺癌A549細胞、鼻咽癌CNE-2Z細胞、骨肉瘤143B細胞、急性早幼粒細胞白血病HL-60細胞的增殖抑制率及CC50值曲線圖。由圖中可以得出結論:本次受試的中藥抗癌復方1-9號均具有高效的抗腫瘤抑制細胞增殖作用,尤其4號、6號、7號、8號、9號效果更佳。
實施例二
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪20份、炒白術10份、白芍5份、柴胡10份、雞血藤10份、丹皮10份、生半夏10份、厚樸5份、蚤休10份、莪術10份、蜈蚣5份、甘草3份、辣木籽5份、虎杖10份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積8倍的水,加熱所述提取容器,待沸騰后開始回流提取2.5h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;在向濾渣中加入濾渣體積6倍的水,繼續提取濾渣1h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量4克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
針對實施例二采用與實施例一相同的方法進行試驗,得到實施例二所述的藥物對抗腫瘤也具有很好的效果,且無毒副作用。
實施例三
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪40份、炒白術20份、白芍15份、柴胡20份、雞血藤30份、丹皮20份、生半夏30份、厚樸15份、蚤休20份、莪術20份、蜈蚣15份、甘草10份、辣木籽15份、虎杖20份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積12倍的水,加熱所述提取容器,待沸騰后開始回流提取1.5h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;在向濾渣中加入濾渣體積6倍的水,繼續提取濾渣1h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至得到濃縮液,然后將濃縮液與揮發油合并,每毫升濃縮液含生藥量2克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
針對實施例三采用與實施例一相同的方法進行試驗,得到實施例二所述的藥物對抗腫瘤也具有很好的效果,且無毒副作用。
實施例四
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪15份、炒白術8份、白芍3份、柴胡8份、雞血藤8份、丹皮8份、生半夏8份、厚樸3份、蚤休8份、莪術8份、蜈蚣3份、甘草3份、辣木籽3份、虎杖8份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積10倍的水,加熱所述提取容器,待沸騰后開始回流提取1.5h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;在向濾渣中加入濾渣體積9倍的水,繼續提取濾渣1.8h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量3克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
針對實施例四采用與實施例一相同的方法進行試驗,得到實施例二所述的藥物對抗腫瘤也具有很好的效果,且無毒副作用。
實施例五
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪45份、炒白術25份、白芍18份、柴胡25份、雞血藤35份、丹皮25份、生半夏35份、厚樸18份、蚤休25份、莪術25份、蜈蚣18份、甘草15份、辣木籽18份、虎杖25份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積12倍的水,加熱所述提取容器,待沸騰后開始回流提取2.5h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;在向濾渣中加入濾渣體積10倍的水,繼續提取濾渣1.5h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量3克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
針對實施例五采用與實施例一相同的方法進行試驗,得到實施例二所述的藥物對抗腫瘤也具有很好的效果,且無毒副作用。
實施例六
本發明所述的抗腫瘤中藥組合物,其包括如下重量份的組分:
黃芪32份、炒白術20份、白芍15份、柴胡10份、雞血藤12份、丹皮20份、生半夏23份、厚樸12份、蚤休18份、莪術15份、蜈蚣15份、甘草10份、辣木籽8份、虎杖13份。
上述抗腫瘤中藥組合物的制備方法為:將黃芪、炒白術、白芍、柴胡、雞血藤、丹皮、生半夏、厚樸、蚤休、莪術、蜈蚣、甘草、辣木籽以及虎杖均進行粉碎,然后經40℃熱水浸泡半小時,再置于提取容器中,加入上述藥物體積10倍的水,加熱所述提取容器,待沸騰后開始回流提取2h,采用揮發油提取器收集提取過程中的揮發油,提取完成后采用高速離心或壓濾等方法進行過濾,得到一次提取液;在向濾渣中加入濾渣體積8倍的水,繼續提取濾渣1.5h,提取完成后過濾,得到二次提取液;合并上述一次提取液與二次提取液,采用減壓真空濃縮設備或薄膜濃縮設備濃縮至每毫升濃縮液含生藥量1克,得到濃縮液,然后將濃縮液與揮發油合并,得到藥物浸膏。上述藥物浸膏直接食用即可。
針對實施例六采用與實施例一相同的方法進行試驗,得到實施例二所述的藥物對抗腫瘤也具有很好的效果,且無毒副作用。
以上所述實施例僅表達了本發明的幾種實施方式,其描述較為具體和詳細,但并不能因此而理解為對本發明專利范圍的限制。應當指出的是,對于本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬于本發明的保護范圍。因此,本發明專利的保護范圍應以所附權利要求為準。
- 還沒有人留言評論。精彩留言會獲得點贊!