一種抑制多藥耐受基因表達的靶向抗腫瘤納米藥物的制作方法
本發明屬于納米藥物載體技術領域,具體涉及一種抑制多藥耐受基因表達的靶向化療抗腫瘤納米藥物的制備方法及其應用。
背景技術:
在全世界70多億人口中,每年新產生約1400多萬癌癥患者,死亡人數達820多萬,癌癥已成為許多國家或地區居民的主要死亡原因。近年來,將化學療法與納米技術相結合而產生的納米藥物被廣泛的應用于腫瘤治療,主要原因是其具有可控的藥物釋放特點,易于向腫瘤組織滲透,并且能減少藥物的全身毒性等。但是,由于納米藥物遞送效率較低,阻礙了致死劑量的藥物在腫瘤組織中停留足夠長的時間,從而限制了其進一步廣泛的應用。
普朗尼克共聚物是一類應用于藥物制劑的高分子,能有效抑制P-糖蛋白的藥物外排功能,并具有良好的生物相容性和極低的免疫原性。透明質酸是細胞外基質中廣泛存在的多糖成分,對在腫瘤細胞上過表達的CD44有很好的親和性,可利用透明質酸介導納米粒子進入靶細胞。目前,納米粒子表面進行雙功能化新策略來提高腫瘤細胞或組織中抗癌藥物濃度的報道較少,制備并開展普朗尼克共聚物和透明質酸表面雙功能化納米藥物的研究還沒有開展。
技術實現要素:
有鑒于此,本發明的目的之一在于提供一種抑制多藥耐受基因表達的靶向化療抗腫瘤納米藥物的制備方法;本發明的目的之二在于提供上述納米藥物的應用。
為實現上述發明目的,技術方案為:
一種抑制多藥耐受基因表達的靶向化療抗腫瘤納米藥物,其制備方法包含以下步驟:
1)將聚乳酸-羥基乙酸共聚物、普朗尼克F127和姜黃素共同溶于二氯甲烷-甲醇共溶劑中;
2)將步驟1)的溶液逐滴加入到聚乙烯醇和殼聚糖混合溶液中;
3)將步驟2)得到的溶液立即放入冰浴中,超聲處理6次,每次超聲10 s,以促使形成水包油的乳液;
4)將步驟3)得到的乳液迅速倒入含有聚乙烯醇水相溶液中,形成乳濁液;
5)在低真空條件下,使得步驟4)的乳濁液中的有機溶劑進行蒸發;
6)將步驟5)之后的溶液進行離心處理,收集得到納米粒子,并用去離子水洗滌3次;
7)將步驟6)的納米粒子渦旋分散在2-(N-嗎啉)乙磺酸一水合物緩沖液中,得到納米粒子懸浮液;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽/N-羥基琥珀酰亞胺對透明質酸的羧基基團進行活化,得到活化后的透明質酸溶液;
9)將步驟8)的活化后的透明質酸溶液加入到步驟7)的納米粒子懸浮液中,所得混合物在室溫下攪拌2小時;
10)將步驟9)的溶液進行高速離心,收集得到納米粒子,并用去離子水洗3次;
11)將步驟9)的納米粒子重新分散在含少量海藻糖的水溶液中,形成納米粒子水溶液;
12)將步驟11)得到的納米粒子水溶液進行冷凍干燥,可以得到具有抑制多藥耐受基因表達的靶向化療抗腫瘤納米藥物,將其儲存在–20攝氏度的密閉容器中備用。
優選的,所述步驟1)中,聚乳酸-羥基乙酸和普朗尼克F127質量比為1:0.5~1:1,聚乳酸-羥基乙酸和姜黃素的質量比為100mg:6 mg~100 mg:12 mg,二氯甲烷-甲醇溶液的比例為5:5~8:2;所述步驟2)中,聚乙烯醇和殼聚糖水溶液的總體積為2~6 mL,兩者的濃度范圍分別是2~5%和0.2~0.5%,殼聚糖分子量為1.8×104;所述步驟3)中超聲的參數為超聲振幅30~80%。
優選的,所述步驟4)中,聚乙烯醇水溶液的總體積為10~200 mL,濃度范圍是0.05~0.5%;所述步驟6)和步驟10)中,離心速率為8000~20000 rpm,離心時間為8~30 min;所述步驟11中,海藻糖水溶液的濃度為3~10%;所述步驟12)中,冷凍干燥按照以下方法進行:在-80℃冷凍過夜后置于凍干機中凍干12~36 h。
相對于現有的技術,本發明的優點在于:
1. 本發明以聚乳酸-羥基乙酸共聚物為基材,并用普朗尼克 F127和透明質酸進行表面雙功能化,制備方法為水包油的溶劑揮發法,整個制備過程簡單快捷,制備周期短,產率高。
2. 本發明引入了普朗尼克共聚物,第一,它能通過抑制由MDR1基因編碼的P-糖蛋白在腫瘤細胞表面的活性,抑制藥物外排功能,從而逆轉腫瘤細胞的多藥耐受性;第二,普朗尼克共聚物具有良好的生物相容性和極低的免疫原性,使得它適用于對生物體局部或全身給藥;第三,普朗尼克共聚物中親水性的聚環氧乙烷,不僅能阻止納米粒子聚集和血液蛋白成份在納米粒子表面吸附,而且還能防止被網狀內皮系統識別吞噬。
3. 本發明引入了透明質酸,透明質酸對腫瘤細胞表面高度過量表達的CD44具有很高的親和性,從而達到藥物的定位釋放。
4. 本發明提出對納米粒子表面進行雙功能化新策略來提高腫瘤細胞或組織中抗癌藥物濃度,是對現有單一表面修飾的一個突破和重要創新。
5. 本發明首次提出、制備并開展普朗尼克共聚物和透明質酸表面雙功能化納米粒子對抗癌效果的協同效應研究,這將有助于我們更好揭示納米粒子表面功能化的機理和規律,同時為在分子水平上設計具有優異抗癌效果的載藥納米粒子提供理論依據。
附圖說明
為了使本發明的目的、技術方案和優點更加清楚,下面將結合附圖對本發明作進一步的詳細描述。
圖1為普朗尼克和透明質酸表面雙功能化納米粒子的掃描電鏡圖(a)和粒徑分布圖(b)。
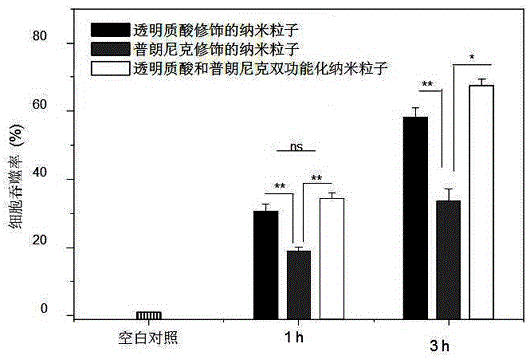
圖2為不同納米粒子與結腸-26細胞共培養1 h和3 h后,細胞吞噬納米粒子圖。
圖3為不同納米粒子處理細胞后,細胞MDR1 mRNA表達水平圖。
圖4為小鼠靜脈注射不同納米粒子后,腫瘤數量圖。
具體實施方式
以下將參照附圖,對本發明的優選實施例進行詳細的描述。
實施例
實施例提供一種抑制多藥耐受基因表達的靶向化療抗腫瘤納米藥物的制備方法,即普朗尼克和透明質酸表面雙功能化納米粒子的制備方法,包括以下步驟:
1)稱量50 mg聚乳酸-羥基乙酸共聚物,25 mg普朗尼克,5 mg姜黃素共同溶于1 mL 二氯甲烷-甲醇(8:2)溶劑中;
2)將上述有機溶液逐滴加入4 mL 5%聚乙烯醇和0.5%殼聚糖水溶液中;
3)將上述溶液立即放入冰浴中,進行超聲,超聲的參數為超聲振幅50%,每次10s,超聲6次;
4)將上述乳濁液迅速倒入100 mL 0.3%的聚乙烯醇水溶液中;
5)在低真空條件下,將上述乳濁液中有機溶劑蒸發;
6)離心收集上述納米粒子,離心速率為12000 rpm,離心時間為20 min,并用去離子水洗滌3次;
7)將納米粒子渦旋分散在2-(N-嗎啉)乙磺酸一水合物緩沖液中;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽/N-羥基琥珀酰亞胺對透明質酸的羧基基團進行活化;
9)將透明質酸溶液加入到納米粒子懸浮液中,所得混合物在室溫下攪拌2小時;
10)高速離心收集納米粒子,離心速率為12000 rpm,離心時間為20 min,并用去離子水洗三次;
11)將上述納米粒子重新分散在少量5%海藻糖的水溶液中;
12)冷凍干燥后儲存在–20攝氏度的密閉容器中。
比較例1
比較例1 普朗尼克功能化納米粒子的制備方法,包括以下步驟:
1)稱量50 mg聚乳酸-羥基乙酸共聚物,25 mg普朗尼克同溶于1 mL 二氯甲烷-甲醇(8:2)溶劑中;
2)將上述有機溶液逐滴加入4 mL 5%聚乙烯醇和0.5%殼聚糖水溶液中;
3)將上述溶液立即放入冰浴中,進行超聲,超聲的參數為超聲振幅50%,每次10s,超聲6次;
4)將上述乳濁液迅速倒入100mL 0.3%的聚乙烯醇水溶液中;
5)在低真空條件下,將上述乳濁液中有機溶劑蒸發;
6)離心收集上述納米粒子,離心速率為12000 rpm,離心時間為20 min,并用去離子水洗滌3次;
7)將上述納米粒子重新分散在1mL含5%海藻糖的水溶液中;
8)將上述納米粒子凍干,存于-20攝氏度的密閉容器中。
比較例2
比較例2透明質酸表面功能化的納米粒子制備方法,包括以下步驟:
1)稱量50 mg聚乳酸-羥基乙酸共聚物溶于1 mL 二氯甲烷-甲醇(8:2)溶劑中;
2)將上述有機溶液逐滴加入4 mL 5%聚乙烯醇的水溶液中;
3)將上述溶液立即放入冰浴中,進行超聲,超聲的參數為超聲振幅50%,每次10s,超聲6次;
4)將上述乳濁液迅速倒入100 mL 0.3%的聚乙烯醇水溶液中;
5)在低真空條件下,將上述乳濁液中有機溶劑蒸發;
6)離心收集上述納米粒子,離心速率為12000 rpm,離心時間為20 min,并用去離子水洗滌3次;
7)將納米粒子渦旋分散在2-(N-嗎啉)乙磺酸一水合物緩沖液中;
8)利用1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽/N-羥基琥珀酰亞胺對透明質酸的羧基基團進行活化;
9)將透明質酸溶液加入到納米粒子懸浮液中,所得混合物在室溫下攪拌2小時;
10)高速離心收集納米粒子,離心速率為12000 rpm,離心時間為20 min,并用去離子水洗三次;
11)將上述納米粒子重新分散在少量5%海藻糖的水溶液中;
12)冷凍干燥后儲存在–20攝氏度的密閉容器中。
圖1為納米粒子的掃描電鏡圖(a)和粒徑分布圖(b)。如圖1所示,掃描電鏡圖片可以看出,制得的納米粒子是球形的,表面光滑,粒徑均勻,結合粒徑分布圖,粒徑分布范圍較窄,粒徑分布在250 nm至330 nm之間。
圖2為不同納米粒子與結腸-26細胞共培養1 h和3 h后,細胞吞噬納米粒子圖。如圖2所示,載姜黃素濃度相同的條件下,用透明質酸和普拉尼克雙功能化納米粒子處理過的細胞吞噬藥物量最多,透明質酸修飾的納米粒子次之。這表明,用普朗尼克 F127和透明質酸進行表面修飾的納米粒子抑制癌細胞表面P型糖蛋白,同時由于透明質酸可以介導細胞吞噬作用,有效加強了細胞對納米粒子的吞噬效率。而隨著時間的增長,細胞的吞噬率增加,這說明細胞持續吞噬納米粒子,沒有明顯的外排作用。
圖3為不同納米粒子處理細胞后,結腸腫瘤細胞中MDR1 mRNA表達水平圖。如圖3所示,透明質酸和普朗尼克雙功能化的納米粒子處理組MDR1 mRNA的表達水平最低,這可以說明,透明質酸和普朗尼克雙功能化納米粒子有效抑制了MDR1 mRNA表達,普朗尼克 F127在引入到納米粒子之后保留了抑制細胞表面P型糖蛋白作用的能力。
圖4為小鼠尾靜脈注射不同納米粒子后,原位結腸腫瘤數量圖。如圖4所示,與空白對照組對比,不同組成的納米粒子處理的小鼠腫瘤數量都有所下降,其中透明質酸和普朗尼克雙功能化的納米粒子處理組的腫瘤數目最少,表明雙功能化的納米粒子抑制腫瘤生長的效果最好,而且透明質酸和普朗尼克在抑制腫瘤生長方面起協同作用。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種靶向錨定劑及其制備方法和應用與流程
- 一種超低分子量插層抑制劑及其制備方法與流程
- 具有膠原特異結合能力的神經再生抑制分子的拮抗蛋白CBD-PlexinB1LBD及應用的制作方法與工藝
- 具有膠原特異結合能力的神經再生抑制分子的拮抗蛋白CBD-EphA4LBD及應用的制作方法與工藝
- 一種KDM1A小分子抑制劑在抑制腫瘤細胞生長和轉移中的應用的制作方法與工藝
- 一種抑制多藥耐受基因表達的靶向抗腫瘤納米藥物的制作方法與工藝
- MALT1靶向抑制物在制備MALT1依賴性腫瘤治療藥物中的應用的制作方法與工藝
- 作為ASGPR靶向劑的被取代的?6,8?二氧雜雙環[3.2.1]辛烷?2,3?二醇化合物的制作方法與工藝
- 小分子C?Myc抑制劑的制作方法與工藝
- 一種RNA抑制劑及其在腫瘤中的應用的制作方法與工藝