一種磷酸特地唑胺脂質體的制備方法及其應用與流程
本發明屬于藥物制劑技術領域,涉及一種磷酸特地唑胺脂質體的制備方法和應用。
背景技術:
如今,抗生素的濫用導致多藥耐藥性的現象愈演愈烈,為了應對此種現象繼續惡化,新抗生素的研究刻不容緩。作為新型唑烷酮類抗菌藥,磷酸特地唑胺于2013年獲得美國fda優先評審資格,并于2014年6月20日批準上市,常被用于耐甲氧西林菌株(mrsa)和甲氧西林敏感菌株(mssa)等引起的急性、細菌性皮膚和皮膚結構感染(absssi)。上市的商品名為sivextrotm,有靜脈注射用凍干粉針劑和片劑兩種劑型,規格均為200mg。注射用粉針劑在注射后1h就可達到血藥濃度峰值,而口服片劑需要3h,絕對生物利用度約91%。
脂質體是一種由類脂質雙分子層形成的微形泡囊,又稱為類脂小球或液晶微囊,根據藥物的溶解特性,油溶性藥物被包封于磷脂雙分子層中,而水溶性藥物則存在于中央的空腔中。脂質體由于具有被動靶向性、緩釋性、細胞親和性與組織相容性、降低藥物的毒性、提高藥物的穩定性等特點,因而在醫藥領域廣泛應用。
制備脂質體的方法多種多樣,分為主動載藥法和被動載藥法兩個大類。主動載藥法又稱化學梯度法,首先將一定濃度的離子溶液包封于空白脂質體中,透析除去外相離子,形成化學梯度,再加入藥物溶液孵育,利用化學梯度將藥物遞送到脂質體中。被動載藥法包括:(1)薄膜分散法:將脂質在二氯甲烷、氯仿、甲醇及乙醇等有機溶劑溶解,再利用旋轉蒸發儀使圓底瓶內的溶劑揮發,在瓶壁上形成均勻的脂質膜,在臨界溫度以上的溫度條件下,將欲包覆藥物的水溶液和脂質膜混合,借助手搖或超聲等機械力,將瓶壁上的脂質膜振搖下來,在水溶液中就會形成多層脂質體(mlv)。(2)反復凍融法:利用脂質體破裂后會再自行密合的特性,以多次冷凍、再解凍的方式,造成脂質體的破裂及重組再密合,最后可形成大小較均勻的單層脂質體。(3)逆相蒸發法:以有機溶劑溶解高濃度的脂質,與藥物水溶液超聲或剪切成初乳,再以旋轉蒸發儀使有機溶劑揮發,形成包封率較高的脂質體。這種方法對于水溶性藥物的包封率相對較高。(4)前體脂質體法:載體顆粒與脂質溶液的混懸液經旋轉蒸發儀使有機溶劑揮發,脂質均勻吸附于載體顆粒上,形成脂質體前體。再將藥物溶液,加入到脂質體前體中,攪拌,超聲,形成大小均一的脂質體。
由于磷酸特地唑胺在室溫下不穩定,易水解,因此貯藏和運輸極為不便,也增加了產品貯藏成本和運輸成本。本發明,提供了一種醋酸鈣梯度法制備磷酸特地唑胺脂質體,不僅能夠提高藥物的穩定性,細胞親和性,還可以實現連續化生產,更好地適應工業化需求,因此在醫藥領域有廣泛應用的前景。
技術實現要素:
本發明提供了一種磷酸特地唑胺脂質體的制備方法及其應用。制備所述的磷酸特地唑胺脂質體的方法,步驟如下:按比例稱取大豆卵磷脂、膽固醇,加入2ml無水乙醇于50~60℃旋轉蒸發(真空度0.02~0.07mpa)成干膜,加5ml醋酸鈣水溶液(120mmol/l),水化3~7min分散均勻(必要時超聲分散),制成空白脂質體。將制備好的空白脂質體置于透析袋(8000~14000da)中,用生理鹽水透析三次,每次持續1h。透析后的空白脂質體加入磷酸特地唑胺溶液(為增加水溶性,與naoh反應成二鈉鹽),45~55℃水浴孵育10~20min后即得,其理化性質如圖1~4。
本發明的一種磷酸特地唑胺脂質體的優勢有:1.該磷酸特地唑胺脂質體具有良好的細胞親和性與組織相容性。無溶血現象發生,注射安全性高,如圖5~6。同時提高藥物的穩定性;2.該磷酸特地唑胺脂質體具有緩釋效果,如圖7。同時它還具有一定的靶向性,降低了其對機體的耐藥性。
該磷酸特地唑胺脂質體對耐甲氧西林菌株(mrsa)和甲氧西林敏感菌株(mssa)等引起的感染有效。
采用醋酸鈣梯度法制備磷酸特地唑胺脂質體,包封率高,不僅可以實現連續化生產,還能更好的適應工業化需求,因此在醫藥領域有廣泛應用的前景。
附圖說明
圖1磷酸特地唑胺脂質體照片(a新鮮制備脂質體,b凍干粉,c凍干復溶后脂質體);
圖2磷酸特地唑胺脂質體透射電鏡照片;
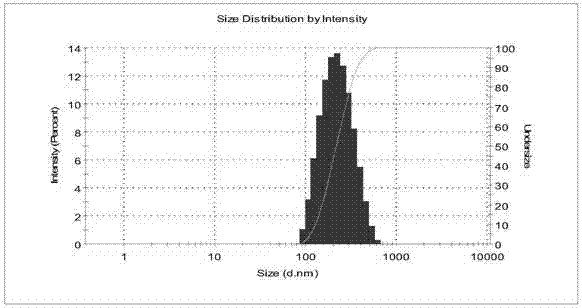
圖3磷酸特地唑胺脂質體粒徑分布圖;
圖4磷酸特地唑胺脂質體電位分布圖;
圖5磷酸特地唑胺脂質體溶血試驗結果(1.陰性對照,2~6.不同濃度的tdza-lips組,7.陽性對照);
圖6磷酸特地唑胺脂質體溶血率結果;
圖7磷酸特地唑胺脂質體體外釋放曲線。
具體實施方式
實施例1按質量比6:1稱取大豆卵磷脂、膽固醇,加入2ml無水乙醇于55℃旋轉蒸發(真空度0.05mpa)成干膜,加5ml醋酸鈣水溶液(120mmol/l),水化5min分散均勻(必要時超聲分散),制成空白脂質體。將制備好的空白脂質體置于透析袋(8000~14000da)中,用生理鹽水透析三次,每次持續1h。透析后的空白脂質體加入磷酸特地唑胺溶液(為增加水溶性,與naoh反應成二鈉鹽),50℃水浴孵育15min后即得。
實施例2按質量比6:1稱取蛋黃卵磷脂、膽固醇,加入2ml無水乙醇于55℃旋轉蒸發(真空度0.05mpa)成干膜,加5ml醋酸鈣水溶液(120mmol/l),水化5min分散均勻(必要時超聲分散),制成空白脂質體。將制備好的空白脂質體置于透析袋(8000~14000da)中,用生理鹽水透析三次,每次持續1h。透析后的空白脂質體加入磷酸特地唑胺溶液(為增加水溶性,與naoh反應成二鈉鹽),50℃水浴孵育15min后即得。
實施例3按質量比6:1稱取大豆卵磷脂、膽固醇,加入2ml二氯甲烷于42℃旋轉蒸發(真空度0.04mpa)成干膜,加5ml醋酸鈣水溶液(120mmol/l),水化5min分散均勻(必要時超聲分散),制成空白脂質體。將制備好的空白脂質體置于透析袋(8000-14000da)中,用生理鹽水透析三次,每次持續1h。透析后的空白脂質體加入磷酸特地唑胺溶液(為增加水溶性,與naoh反應成二鈉鹽),50℃水浴孵育15min后即得。
實施例4將含有3%甘露糖的脂質體混懸液過0.22μm濾膜除菌,放入超低溫冰箱-80℃預凍24h,然后將得到的樣品轉移到冷凍干燥機中凍干-50℃,48h,制得凍干粉針劑。
實施例5將含有3%蔗糖的脂質體混懸液過0.22μm濾膜除菌,放入超低溫冰箱-80℃預凍24h,然后將得到的樣品轉移到冷凍干燥機中凍干-50℃,48h,制得凍干粉針劑。
技術特征:
技術總結
本發明提供了一種磷酸特地唑胺脂質體的制備方法及其應用,其特征是在于以大豆卵磷脂、膽固醇為膜材,采用醋酸鈣梯度法,將磷酸特地唑胺包封制備成磷酸特地唑胺脂質體。平均粒徑183.7nm,其包封率可達70%~75%。該脂質體具有被動靶向性、緩釋性、細胞親和性與組織相容性,無毒,同時提高藥物的穩定性。醋酸鈣梯度法制備磷酸特地唑胺脂質體不僅可以實現連續化生產,還能更好的適應工業化需求,因此在醫藥領域有廣泛應用的前景。
技術研發人員:黃桂華;楊振磊;邵愛霞
受保護的技術使用者:濟南維瑞醫藥科技開發有限公司
技術研發日:2017.08.04
技術公布日:2017.10.20
- 還沒有人留言評論。精彩留言會獲得點贊!