一種從唇形科香茶菜屬植物中分離出的化合物及其制備方法與應用與流程
本發明屬于醫藥領域,具體是涉及一種從唇形科香茶菜屬植物中分離出的化合物及其制備方法與應用。
背景技術:
硫氧還蛋白系統包括硫氧化蛋白(thioredoxin,Trx)、硫氧化蛋白還原酶(thioredoxin reductase,TrxR)和煙酰胺腺嘌呤二核苷酸(nitotinamide adeninedinucleotide phosphate,NADPH),是一個廣泛分布的NADPH依賴性二硫化合物還原酶系統。Trx有兩種同源異構體Trx1和Trx2,兩者功能相似,但在細胞中有不同的定位。Trx1定位于細胞質、細胞核及細胞外基質,Trx2主要定位于線粒體。Trx1是一個由104個氨基酸組成的蛋白質,其活性位點組成為半胱氨酸-甘氨酸-脯氨酸-半胱氨酸(-Cys-Gly-Pro-Cys-)保守的形式。Trx的還原機制在于其與底物X-S2結合后,在復合物的疏水環境中,Cys32的巰基作為親核物質與蛋白底物結合形成共價鍵的二硫化物,最后去質子的Cys35作用于此二硫化物的二硫鍵,釋放出被還原的蛋白底物。因此,Trx調控細胞內的氧化還原平衡,在調節細胞生長及細胞程序性死亡等方面起重要作用。
越來越多的證據表明硫氧還蛋白系統在腫瘤起始和進展中發揮著重要作用。研究表明,Trx1蛋白在許多腫瘤細胞和腫瘤組織中異常高表達(Anticancer Res 2003;23:2425-33)。過表達的Trx1能夠促進腫瘤細胞增殖,通過與ASK1、PTEN等蛋白結合幫助腫瘤細胞逃逸(EMBO J 1998;17:2596-606,Arch Biochem Biophys 2004;429:123-33)。Trx1能通過增加HIFα表達、增強VEGF功能促進血管生成(Cancer Res 2002;62:5089-95)。此外,臨床研究表明Trx1表達量越高,腫瘤病人預后越差(Cancer Res 2000;60:2281-9)。除了腫瘤以外,許多疾病都與上述硫氧還蛋白系統介導的事件所引發的異常細胞反應有關。這些疾病包括,但不限于,急性和慢性炎性疾病,自身免疫性疾病,變應性疾病,與氧化應激有關的疾病,癌癥,以及特征在細胞過度增殖的疾病。
研發選擇性Trx1抑制劑對于Trx1-介導的疾病治療具有重要意義。藥物化學方面的巨大努力已經找到了可有效抑制Trx1的抑制劑——1-甲基丙基-2-咪唑二硫化物PX-12(Biochem.Pharmacol 1998;55:987–994)。PX-12可以可逆地在Trx1活性位點上形成二硫化物,導致其氧化,阻斷了形成Trx1活性二聚體,從而導致Trx-TrxR信號通路的抑制。可惜的是,PX-12的臨床試驗效果并不理想(Cancer Chemother Pharmacol.2011;67:503-09,Invest New Drugs.2013;31:631-41)。因此,篩選新的Trx1選擇性抑制劑是醫藥研發的重要需求,它們可能是極為有效的治療腫瘤及其他Trx1-介導的疾病的藥物。
我國具有豐富的中藥資源。這一珍貴寶庫為篩選疾病治療藥物提供了大量的先導化合物。唇形科香茶菜屬(Isodon)植物是我國民間廣泛使用的中草藥,香茶菜屬植物味辛、苦,性涼,以全草或根入藥,具有清熱利濕、活血散瘀、解毒消腫等功效。該屬植物富含結構多樣的活性二萜類化合物,特別是對映-貝殼杉烷類二萜。部分二萜類化合物具有良好的抗腫瘤,免疫抑制等活性,一些香茶菜屬植物的有效成分已用于臨床。紫萼香茶菜(Isodon forrestii var.forrestii)為多年生草本,根木質、粗大、疙瘩狀,葉對生,產于云南西北部及四川西南部,在我國民間用于治療濕熱黃疸、淋證、水腫、咽喉腫痛、關節痹痛、閉經、乳癰、痔瘡、發背、跌打損傷、毒蛇咬傷等疾病。但是關于Isodon forrestii var.forrestii Iso A的化學成分研究尚未見文獻報道,以及該植物有效成分在制備抗腫瘤藥物中的應用,尤其是與硫氧還蛋白信號通路的關系沒有明確。
技術實現要素:
本發明要解決的技術問題是提供新穎的、未見文獻報道的可作為Trx選擇性抑制劑的化合物,或其藥用鹽,以其為有效成分和至少一種藥學上可接受的載體組成的藥物組合物,以及其制備方法和用途。
為解決上述技術問題,本發明采取的技術方案為:
一種式I結構的化合物或其藥學上可接受的鹽:
一種式I結構的化合物或其藥學上可接受的鹽的制備方法,包括以下步驟:
(1)取唇形科香茶菜屬植物的植株地上部分粉碎為植物粉末;
(2)以第一有機溶劑和水的混合溶液浸泡步驟(1)中得到的植物粉末,分離固體部分得到浸出液;
(3)將步驟(2)中得到的浸出液蒸餾除去第一有機溶劑后,加入第二有機溶劑提取,有機相濃縮后得到浸膏;
(4)步驟(3)中得到的浸膏通過硅膠柱層析和反相硅膠柱層析得到權利要求1中所述化合物I。
步驟(1)中,所述唇形科香茶菜屬植物為紫萼香茶菜。
步驟(2)中,所述混合溶液中所述第一有機溶劑和水的質量百分比為10-100%,所述第一有機溶劑選自甲醇,乙醇,氯仿,二氯甲烷,石油醚或丙酮中的一種或多種,優選為丙酮,所述浸泡的方法為室溫下浸泡1~3次,優選為3次;所述植物粉末和浸泡所述混合溶劑的總的重量體積比為1:1-1:5kg/L,優選為1:1.2-1:2kg/L。
步驟(3)中,所述第二有機溶劑選自為乙酸乙酯、氯仿、乙醚、石油醚中的一種或多種,優選為乙酸乙酯,所述第二有機溶劑和步驟(2)中所述混合溶劑的體積比為1:1-1:5。
步驟(4)中,所述硅膠層析柱層析的實驗條件為:填料硅膠的孔徑為100-300目,優選為200~300目;洗脫劑為體積比1:0-1的氯仿和丙酮的混合溶劑,優選為1:0.11~1:0.5;洗脫劑的用量為所有樣品加硅膠總質量的3-6倍;所述反相硅膠柱層析的實驗條件為:反相硅膠型號為RP-18,洗脫劑為體積比10%-100%的甲醇和水或者乙腈和水的混合溶液,優選為73%-85%的甲醇和水或者乙腈和水的混合溶液,洗脫劑的用量為所用RP-18填料質量的3-6倍。
所述制備方法還包含與酸成鹽的步驟,所述酸選自鹽酸、氫溴酸、硝酸、硫酸、磷酸、酒石酸、檸檬酸、甲酸、乙酸、乙二酸或其他適合的有機酸或無機酸。
一種藥物組合物,包含式1所述的化合物或其藥學上可接受的鹽。
一種藥物制劑,包含治療有效量的式1所述的化合物或其藥學上可接受的鹽藥學上可接受的賦形劑。所述賦形劑可以是在藥物制劑中除主藥以外所允許添加的一切附加物或者輔料。
所述制劑為能作為適宜口服或注射給藥的制劑形式;其中所述的口服給藥的制劑形式為片劑、緩釋片、控釋片、錠劑、硬或軟膠囊、滴丸、微丸、水性或油混懸劑、乳劑、可分散的散劑或顆粒劑、口服溶液、糖漿劑或酏劑,所述的注射給藥的制劑形式為滅菌的水性或油性溶液、無菌粉末、脂質體、乳劑、微乳劑、納米乳劑或微囊。
所述的式I化合物或其藥學上可接受的鹽或其藥物組合物在制備用于預防或治療腫瘤的藥物中的用途,所述腫瘤為Trx1-介導的腫瘤。
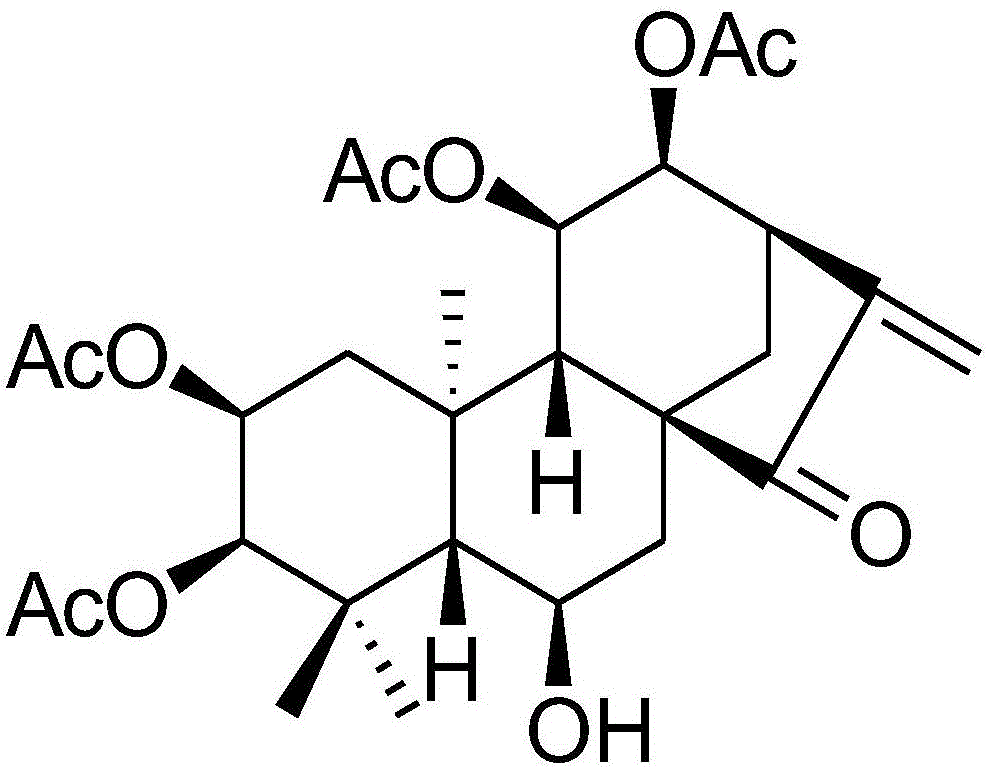
所述式I結構的化合物命名為Isoforresin A,簡稱為Iso A,是一種對映-貝殼杉烷二萜。經過一系列模型實驗證明Iso A能夠選擇性抑制人腫瘤細胞生長并誘導細胞凋亡。
有益效果:本發明的Iso A安全低毒,藥理作用強,預示著很好的藥用前景。
附圖說明
圖1 Iso A的結構圖;
圖2 MTT實驗中Iso A處理各種正常細胞和腫瘤細胞的IC50值;
圖3各種不同濃度Iso A處理人正常肝細胞LO2和肝癌細胞HepG224小時后,MTT檢測細胞生長抑制結果;
圖4各種不同濃度Iso A處理人正常肝細胞LO2和肝癌細胞HepG224小時后,臺盼藍染色檢測細胞存活結果;
圖5 10或20μM的Iso A處理HepG2細胞24小時后Annexin V的分析結果;
圖6 Iso A在體外反應中對Trx1活性抑制分析;
圖7不同濃度Iso A處理HepG2細胞8小時后Trx1的活性分析;
圖8 Iso A與Trx蛋白直接結合的質譜分析圖;
圖9顯肝癌移植瘤模型中Iso A給藥后小鼠體重的變化;
圖10肝癌移植瘤模型中Iso A給藥后腫瘤體積的變化;
圖11肝癌移植瘤模型中Iso A給藥后腫瘤重量的變化;
圖12肝癌移植瘤模型中Iso A給藥后腫瘤細胞中Trx1活性的變化;
圖13 Iso A給藥后小鼠血清中ALT,AST和ALP指數的變化;
圖14 Iso A給藥后小鼠血清中尿素氮和肌酐的變化;
圖15 Iso A的X-單晶衍射圖。
具體實施方式
根據下述實施例,可以更好地理解本發明。然而,本領域的技術人員容易理解,實施例所描述的內容僅用于說明本發明,而不應當也不會限制權利要求書中所詳細描述的本發明。
實施例1 化合物Iso A的制備方法
取植物Isodon forrestii var.forrestii地上部分10Kg粉碎,用70%(丙酮:水)丙酮水室溫浸泡三次,共12升,利用減壓蒸餾蒸發丙酮后,剩余部分以乙酸乙酯萃取,得到乙酸乙酯提取物,利用硅膠柱色譜,200目孔徑硅膠,氯仿:丙酮(體積比1:0.11)溶劑沖洗后,經由RP-18體積比為85%乙甲醇和水的混合溶液反復處理,最后得到Iso A500mg,得率約為0.005%。
化合物Iso A的X-單晶以及紫外,旋光,紅外,核磁等理化數據:
Crystal data for Sze1:C28H38O10,M=534.58,orthorhombic,α=90.00°,β=90.00°,γ=90.00°,T=100(2)K,space group P212121,Z=4,μ(CuKα)=0.796mm-1,12890reflections measured,4629independent reflections(Rint=0.0457).The final R1values were 0.0721(I>2σ(I)).The final wR(F2)values were 0.2147(I>2σ(I)).The final R1 values were 0.0731(all data).The final wR(F2)values were 0.2158(all data).The goodness of fit on F2was 1.136.Flack parameter=-0.1(3).The Hooft parameter is 0.01(8)for 1779 Bijvoet pairs.
Isoforretin A:Colorless needle crystals.(c 0.08,MeOH).UV(MeOH)λmax(logε):232(3.9)nm;IR(KBr)Vmax 3442,2962,2934,2881,1732,1644,1428,1370,1251,1231,1176,1034,995,603;Positive ESIMS:m/z 557[M+Na]+;positive HRESIMS[M+Na]+m/z 557.2365(calcd for C28H38O10Na,557.2357);1H NMR(600MHz,C5D5N)δH6.17(1H,s,H-17a),5.66(1H,dd,11.8,5.5,H-2α),5.47(1H,br d,4.7,H-11α),5.41(1H,s,H-17b),5.37(1H,br s,H-3α),5.15(1H,br s,H-12α),4.67(1H,br s,H-6α),3.34(1H,br d,14.5,H-14a),3.28(1H,br s,H-13α),2.58(1H,br d,14.2,H-7a),2.18(1H,overlap,H-1a),2.14(3H,s,Me-20),2.01(3H,s,AcO-3),1.98(1H,overlap,H-9β),1.93(3H,s,AcO-2),1.87(1H,overlap,H-1b),1.83(1H,overlap,H-7b),1.74(3H,s,AcO-11),1.67(1H,br d,14.5,H-14a),1.61(3H,s,Me-19),1.06(3H,s,Me-18);13C NMR(150MHz,C5D5N)δC 208.3(s,C-15),170.8(s,AcO-3),170.4(s,AcO-2),169.4(s,AcO-12),168.7(s,AcO-11),145.4(s,C-16),117.1(t,C-17),77.9(d,C-3),75.4(d,C-12),70.1(d,C-11),67.9(d,C-2),64.9(d,C-6),60.2(d,C-9),49.8(d,C-5),48.8(s,C-8),42.7(t,C-7),41.8(d,C-13),40.8(t,C-1),40.3(s,C-10),39.0(s,C-4),32.2(t,C-14),28.7(q,C-18),23.4(q,C-19),21.1(q,C-20),21.1(q,AcO-2),21.1(q,AcO-11),20.7(q,AcO-12),19.3(q,AcO-3).
實施例2 化合物Iso A的制備方法
取植物Isodon forrestii var.forrestii地上部分10Kg粉碎,用80%(丙酮:水)丙酮水室溫浸泡三次,共20升,利用減壓蒸餾蒸發丙酮后,剩余部分以乙酸乙酯萃取,得到乙酸乙酯提取物,利用硅膠柱色譜,300目孔徑硅膠,氯仿:丙酮(1:0.5)溶劑沖洗后,經由RP-18和體積比為85%乙腈和水的混合溶液反復處理,最后得到Iso A 400mg,得率約為0.004%。
實施例3 Iso A能夠選擇性抑制人腫瘤細胞生長并誘導細胞凋亡
Iso A(純度>99%)溶解于DMSO,儲存液濃度為40mM,-20℃保存。用MTT法檢測IsoA在多種腫瘤細胞,包括肝癌,乳腺癌,肺癌,骨肉瘤,黑色素瘤,宮頸癌等,以及正常細胞人肝細胞LO2,人胚肺細胞HFL1,人乳腺上皮細胞MCF 10A的抑制效果。與正常細胞相比,Iso A對腫瘤細胞具有更強的抑制效果,其IC50值均小于30μM(圖2)。在測試的細胞中,HepG2細胞對Iso A最為敏感,因此后續實驗選用HepG2為模型。MTT實驗表明,Iso A能夠濃度依賴的方式抑制HepG2細胞生長,但對LO2細胞沒有明顯的抑制作用(圖3)。進一步臺盼藍實驗表明,Iso A能夠選擇性的引起HepG2細胞死亡,而對正常細胞沒有明顯毒性(圖4)。流式細胞儀分析檢測結果表明Iso A處理引起了Annexin V陽性細胞的增加,進一步證實Iso A誘導了細胞凋亡,而caspase廣譜抑制劑Z-VAD-FMK部分抑制了Iso A誘導的細胞凋亡,說明Iso A誘導的細胞凋亡作用至少部分依賴于caspase的活化(圖5)。
實施例4 Iso A在體外反應中對Trx1活性抑制作用
實驗材料:
Trx1蛋白購自北京義翹神州生物技術有限公司,Trx1活性檢測試劑盒購自美國Caymen Chemical公司。
實驗方法:
1)按照試劑盒提供實驗方法配制Trx 1檢測液;
2)加入系列稀釋的Iso A(終濃度0-100μM)
3)37℃孵育30min
4)每孔加入5μl NADPH,37℃孵育10min;
5)每孔加入10μl熒光底物,37℃孵育5min;
6)酶標儀檢測
7)計算相對酶活力體外條件下Trx活性檢測方法:
體外條件下Trx活性檢測采用Thioredoxin Activity Fluorescent Assay Kit(Caymen Chemical)來進行。根據試劑盒說明書的要求,在0.02μM的Trx樣品中加入2μl的不同濃度的Iso A(0.195μM to 100μM),隨后每個樣品各加入5μl的β-NADPH,37℃孵育30min.最后加入熒光底物,在反應30至60分鐘時間段,通過在酶標儀(Thermo Scientific Varioskan Flash fluorescent microplate reader)記錄518nm的發射波長(488nm激發)來計算Trx1活性。
實驗結果:
如圖6所示,Iso A能抑制Trx1活性,實驗組(2.5,5,10μM)抑制率分別為20%,48.6%,98%,提示Iso A可能通過抑制Trx1信號傳導通路,調控某些相關基因的表達,從而發揮抗腫瘤作用。
實施例5 不同濃度Iso A在細胞水平對Trx1的抑制作用
細胞或組織樣品中Trx1活性檢測方法:細胞或組織樣品用裂解液(20mM HEPES(pH 7.9),300mM NaCl,100mM KCl,10mM EDTA,and 0.1%Nonidet P-40,含蛋白酶抑制劑)裂解。取90微克蛋白用DTT活化緩沖液(50mmol/liter HEPES(pH 7.6),1mmol/liter EDTA,1mg/ml bovine serum albumin,and 2mmol/liter dithiothreitol)在37℃預處理15分鐘。然后加入20μl反應混合液(200μl of 1M HEPES(pH 7.6),40μl of 0.2mol/liter EDTA,40μl of NADPH(40mg/ml),)和500μl胰島素(10mg/ml)。加入5μl硫氧還蛋白還原酶起始反應,在對照組中加入同體積的水。樣品在37℃孵育20分鐘,加入0.25ml的6M鹽酸胍和0.4mg/ml的DTNB終止反應。檢測412nm的光吸收。
體外培養人肝癌細胞株HepG2。細胞生長至對數生長期后,用胰酶消化細胞,1000rpm離心5分鐘,棄上清,將細胞稀釋成5×105接種于6孔板,培養24h后,用不同濃度Iso A處理細胞,陰性對照組為0.5%DMSO,培養箱中培養16h后,收集細胞,檢測細胞內Trx1活性。以陰性對照活性為1,計算各組Trx1相對活性。結果表明,10-30μM的Iso A處理HepG2細胞8小時能夠顯著抑制細胞內Trx1活性(圖7).
實施例6 Iso A與Trx1蛋白Cys32/35位點直接結合
人源Trx1蛋白(Sino Biological Inc.)儲存液溶于無菌水,濃度為5mg/ml.在25mM Tris-HCl(pH7.4)緩沖液中,將4μl的Iso A與140μl人Trx1蛋白混合,室溫孵育2h。反應完成的樣品用Shimadzu Biotech Proteome試劑盒處理,用MonoSpin Trypsin酶解,隨后用C18柱脫鹽,利用MALDI 7090(SHIMADZU)進行質譜分析。質譜結果表明Iso A能直接與Trx1蛋白結合(圖8)。
實施例7 Iso A在移植瘤小鼠模型中抑制腫瘤生長
1.材料
a)細胞株:人肝癌細胞HepG2購自中國科學院典型培養物保藏委員會細胞庫
b)動物:BALB/c裸小鼠20只,體重(13±2g),雄性,BALB/c小鼠購自南京大學模式動物中心,動物飼養于江蘇省中醫藥研究院動物中心[SCXK(蘇)2002-0001]無特殊病原體環境中。
c)藥物:Iso A
2.實驗方法
a)肝癌小鼠模型的制作:取對數生長期肝癌細胞HepG2,胰酶消化后配制成2x107cells/ml細胞懸液,1ml注射器接種200μl(100μl細胞+100μl基質膠)細胞懸液于裸鼠的右側腋下。
b)實驗動物分組和給藥:待腫瘤長100mm3時進行分組,每組10只(每組平均體積一致,腫瘤體積過大或過小者剔除)。具體分組如下:①Iso A 15mg/kg劑量組,②溶劑對照組(0.5%CMC-Na)。每天腹腔注射給藥一次,共計15天。
c)取材和觀察指標:
i.一般狀態的觀察:每三天測一次體重和腫瘤大小(腫瘤體積V=長徑×短2/2),先測再給藥。每日觀察小鼠的自主活動,精神狀態,毛發,呼吸,飲食,糞便性狀及對外界刺激的反應。藥物干擾結束后麻醉小鼠,心臟穿刺取全血,離心取血漿凍存于-80℃。用鑷子鑷住小鼠右腋腫瘤生長部位皮膚后,用手術剪子剪開皮膚,暴露腫瘤,用手術剪鈍性剝離腫瘤,并用天平稱瘤重、移植瘤重,計算抑制率。以抑瘤率來判斷抑瘤作用。腫瘤抑制率(%)=[1-(平均實驗組瘤重/平均對照組瘤重)]×100%。
ii.TUNEL染色檢測腫瘤組織的凋亡情況:冰凍組織切片室溫固定后,按照Roche公司TUNEL凋亡檢測試劑盒說明書進行。
iii.檢測血液常規評估Iso A的骨髓毒性,檢測血漿中ALT、AST、ALP水平評估IsoA肝臟毒性,檢測肌酐與尿素氮評估腎損傷情況。
構建肝癌小鼠移植瘤模型,將小鼠隨機分為對照組和Iso A(15mg/kg)給藥組。每三天記錄一次體重和腫瘤大小,給藥15天后,處死小鼠,取腫瘤組織、血等檢測分析。實驗結果表明,給藥期間,對照組和給藥組小鼠體重沒有顯著差異,說明Iso A毒副作用較小(圖9)。與對照組相比,Iso A給藥后,腫瘤體積和重量顯著降低(圖10,11)。此外,通過對腫瘤組織內Trx1活性分析發現,腫瘤組織中Trx1活性也顯著降低(圖12)。上述結果表明,Iso A能在小鼠模型中通過抑制Trx1活性而發揮抗腫瘤作用。
對照組和Iso A給藥組小鼠血清中ALT、AST和ALP的水平沒有顯著差異,表明Iso A沒有明顯的肝毒性(圖13)。對照組和Iso A給藥組小鼠血清中尿素氮和肌酐的水平沒有顯著差異,表明Iso A沒有明顯的腎毒性(圖14)。上述結果表明,Iso A具有抗腫瘤作用,且對小鼠骨髓、肝臟和腎臟等重要器官無顯著毒副作用。
實施例8 按實施例1制Iso A,按其與賦形劑重量比1:1的比例加入賦形劑,制粒壓片。所述賦形劑為淀粉。
實施例9 按實施例1制得Iso A,按其與賦形劑重量比1:2的比例加入賦形劑,制粒壓片。所述賦形劑為淀粉。
實施例10 按實施例1制得Iso A,按常規膠囊制劑方法制成膠囊。
實施例11 按實施例1制得Iso A,再按下述方法制成片劑:
實施例12
膠囊劑:Iso A, 100mg
淀粉 適量
硬脂酸鎂 適量
制備方法:將Iso A,與助劑混合,過篩,在合適的容器中均勻混合,把得到的混合物裝入硬明膠膠囊。
實施例13
制備方法:攪拌下于適當體積的重蒸餾水中每次加入一種成分,直至完全深解,然后再加入另一種成分。加水至2ml后,將該溶液在無菌過濾器上過濾,裝入瓶中并按照適當的劑量分隔。
實施例14
滴丸:Iso A 100mg
聚乙二醇6000 900mg
制法:Iso A與聚乙二醇6000熔融液的制備:按上述處方量稱取Iso A,加入適量無水乙醇,微熱溶解后,加入處方量的聚乙二醇熔融液中(60℃水浴保溫),攪拌混合均勻,直至乙醇揮盡為止,靜置于60℃水浴中保溫30分鐘,待氣泡除盡,然后將除盡氣泡的上述混勻熔融液轉入貯液筒內,在保溫80-85℃的條件下,控制滴速,一滴滴地滴入冷凝液中,等冷凝完全,傾去冷凝液,收集滴丸,瀝凈和用濾紙除去丸上的冷凝液,放置硅膠干燥器中或自然干燥即可。
- 還沒有人留言評論。精彩留言會獲得點贊!