一種硼中子俘獲治療蒙特卡羅劑量超分辨率去噪方法
本發明涉及放射治療計劃系統,具體是一種硼中子俘獲治療蒙特卡羅劑量超分辨率去噪方法。
背景技術:
1、硼中子俘獲治療(bnct)因其靶向性強、對正常組織損傷小等優勢,在頭頸部腫瘤,膠質瘤,惡性黑色素瘤等傳統放療手段(如光子放療)治療效果不佳的癌癥治療中展現出重要潛力。近年來,bnct在世界上迅速發展,國內截至2024年底已有近20家bnct項目在建。bnct的治療效果直接依賴于準確的劑量計算。蒙特卡羅(mc)模擬方法被認為是劑量計算的“金標準”,該方法通過模擬中子和次級光子在患者體內的輸運和各種物理過程,能夠獲得高精度的劑量分布,是目前唯一一種可以計算得到三維不均勻介質中劑量分布的方法。然而,由于?mc?模擬通常需模擬數十億次粒子事件以達到臨床可接受精度(如不確定度小于3%),這個過程需要數小時甚至數天的計算時間,難以滿足臨床中如在線自適應治療等需要實時或近實時治療計劃的場景中。
2、盡管已經有研究采用基于卷積神經網絡(cnn)的深度學習(dl)技術對光子的蒙特卡羅劑量噪聲進行抑制,但還沒有人將這項技術應用于擁有更復雜物理過程的硼中子俘獲療法中,同時,在圖像處理中,傳統方法聚焦于單獨處理去噪或超分辨率任務。純深度學習的方法在缺乏對物理過程(如能量守恒等基本物理定律)限制的情況下,容易在關鍵區域(如皮膚及腫瘤內部)產生較大劑量偏差,從而影響治療安全性和效果,它們在bnct中對臨床劑量計算的結果缺乏可解釋性。
3、現有bnct的tps大多外接phits、mcnp等通用蒙卡程序進行劑量計算,通常,該方法將計算區域劃分為高分辨率網格,采用大量粒子事件模擬以降低統計誤差,實現對各器官(包括腫瘤、皮膚及其他關鍵結構)的精確劑量評估。盡管該方法計算結果準確,但由于需要模擬億級別的粒子事件,其計算時間長、對硬件資源要求高,難以滿足臨床中對快速治療計劃生成的需求。
4、現有技術一的缺點:
5、1.計算效率低:
6、傳統蒙特卡羅程序(如phits、mcnp)基于cpu架構,單次劑量計算需6-8小時(日本住友重工neucure?bnct系統),無法滿足在線自適應放療(治療中動態調整計劃)等治療場景的實時性需求。
7、2.硬件與算法適配性差:
8、通用蒙特卡羅程序未針對gpu并行架構優化,一般只能運行在cpu上。線程分配與任務批處理策略粗放,且需要大量的計算線程才能達到快速計算,這對于沒有高性能計算服務器的醫療機構并不友好,限制了蒙特卡羅軟件對于臨床的使用。
9、現有技術二提出采用純深度學習方法實現?bnct?劑量預測。該方案通過構建基于3d?u-net?的深度學習模型,將患者?ct?圖像作為輸入,直接輸出患者體內的三維劑量分布。利用卷積神經網絡的非線性映射能力,此方法可在短時間內完成劑量計算。
10、1.3.2?現有技術二的缺點
11、1.任務單一性:
12、僅針對去噪任務設計,無法同步提升空間分辨率,需額外插值步驟,導致高頻細節丟失;無法進一步提升計算速度
13、2.物理約束缺失:
14、純數據驅動的均方誤差(mean?squared?error,mse)損失函數忽略能量守恒等物理規律,其預測結果在關鍵部位(尤其是皮膚與腫瘤內部)往往存在較大偏差,且純深度學習預測得到的結果在臨床上的可解釋性不足。
15、3.bnct適應性差:
16、輸入僅包含單一矢量圖,未融合bnct過程中涉及到多種次級粒子的多組分劑量及患者解剖信息(如hu值、體部輪廓的二值化掩模、皮膚區域的二值化掩模),難以對bnct中復雜的劑量疊加效應進行建模。在遇到訓練數據中未充分覆蓋的特殊病例時,可能出現不穩定的預測結果,從而制約了其在臨床中的廣泛應用。
技術實現思路
1、本發明的目的在于提供一種硼中子俘獲治療蒙特卡羅劑量超分辨率去噪方法,以解決上述背景技術中提出的問題。
2、為實現上述目的,本發明提供如下技術方案:
3、一種硼中子俘獲治療蒙特卡羅劑量超分辨率去噪方法,包含以下步驟:
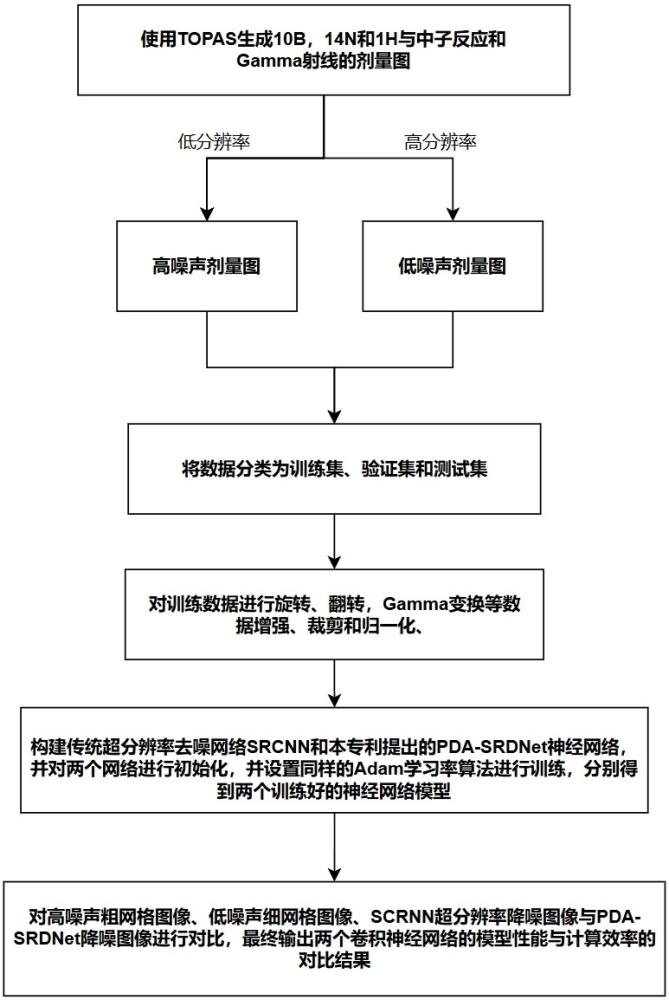
4、步驟1、獲取真實患者的ct、勾畫、放療計劃數據,使用通用mc軟件進行劑量計算;
5、步驟2、對獲取的數據進行數據集劃分并對數據進行裁剪、歸一等初步處理;
6、步驟3、構建超分辨率去噪卷積神經網絡模型;對傳統超分辨率卷積神經網絡模型srcnn以及專利構建的超分辨率去噪卷積神經網絡模型pda-srdnet在同樣的訓練條件下進行模型訓練,分別得到兩個訓練好的卷積神經網絡模型;
7、步驟4、使用測試集數據分別輸入到兩個訓練好的卷積神經網絡中,得到超分辨率去噪后的結果,進行多維度的對比;
8、步驟5、對預測出來的矢量圖執行后處理操作,生成最終的矢量圖;將最終的矢量圖上傳到放療計劃系統tps中供醫生物理師進行評估。
9、作為本發明的進一步技術方案:步驟1中,使用通用mc程序topas,設置劑量計算所需要的參數,在同一患者人體模型分別計算b-10(硼劑量,db),n-14和h-1(氮劑量和氫劑量,dn,dh)與中子反應引起的幾種吸收劑量和光子劑量(dγ);每位病人共模擬4部分劑量(db,dh,dn,dγ)。每個組分劑量分別模擬出低分辨率高噪聲圖像和高分辨率低噪聲圖像,分別作為訓練數據和地面真值。
10、作為本發明的進一步技術方案:在步驟2中,首先將數據集劃分為訓練數據集和驗證數據集,為了獲得足夠且多樣化的訓練數據,將每個矢量圖進行90°、180°、270°旋轉以及上下翻轉等操作,或進行gamma映射不僅有效擴展了數據集的規模,還提高了網絡對空間變換和噪聲分布變化的魯棒性。經過數據增強,我們對增強后的數據進行裁剪、邊緣填充、數據歸一化,統一除以低分辨率高噪聲矢量圖的最大值。
11、作為本發明的進一步技術方案:步驟3中,mc超分辨率去噪網絡選用本專利提到的改進的輕型卷積神經網絡pda-srdnet,使用四通道輸入,輸入包括患者的ct值三維矩陣、體部輪廓的二值化掩模、皮膚區域的二值化掩模和mc計算得到的高噪聲粗網格能量沉積矩陣;對傳統超分辨率網絡scrnn和pda-srdnet進行參數初始化。采用訓練集中體部輪廓的二值化掩模、皮膚區域的二值化掩模和mc計算得到的高噪聲粗網格能量沉積矩陣對超分辨率去噪網絡進行訓練。
12、作為本發明的進一步技術方案:步驟4中,對兩個卷積神經網絡的對比進一步包括:將步驟3中得到的兩個訓練好的卷積神經網絡的降噪結果進行同樣的簡單處理,提取數據后,對低采樣數據得到的高噪聲低分辨率圖像、高采樣數據得到的低噪聲高分辨率干凈圖像、srcnn卷積神經網絡降噪圖像與pda-srdnet去噪卷積神經網絡降噪圖像進行對比,最終輸出兩個卷積神經網絡的模型性能與計算效率的對比結果。
13、作為本發明的進一步技術方案:步驟5中,后處理操作包括對預測出來的輪廓執行排除異常預測區域和邊緣平滑操作。去除孔洞、排除異常預測區域和邊緣平滑操作,具體包含以下步驟:采用泛洪算法去除輪廓的邊界內的異常空洞信息;找出包含輪廓的預測信息的最大連通域,用以去除其他異常預測區域;使用opencv內置庫對輪廓執行邊緣平滑操作。并將處理后的去噪圖像輸入商業tps中,供物理師進行評估。
14、與現有技術相比,本發明的有益效果是:
15、(1)將圖像處理加速方法超分辨率與去噪有效結合,提出雙任務聯合優化框架,用于加速蒙特卡羅劑量計算,結合mc方法的高精度與cnn準確與快速預測的優勢,解決了傳統mc方法的耗時問題;
16、(2)在網絡訓練中引入嚴格的物理約束(能量守恒約束),減少了劑量錯誤,從根本上解決了純dl方法缺乏物理過程導致的不可信問題,為神經網絡蒙特卡羅去噪引入臨床流程中具有重要意義。
17、(3)進一步地,使用由空間和通道集成注意模塊、卷積層、像素洗牌層、雙線性,殘差機制組成的物理約束的超分辨率去噪網絡。在確保去噪性能的前提下減少大量的計算開銷,以減少硬件負擔,能夠短時間內快速重計算患者的劑量分布,為適應性放療計劃提供即時反饋,適合部署在臨床實時計算環境中。
18、(4)本發明不僅適用于bnct治療計劃中劑量計算,同時其基本原理—即利用mc模擬與超分辨率去噪網絡相結合的統計降噪方法—可擴展至其他mc輻射輸運模擬領域,如光子治療計劃、質子重離子治療計劃、ct劑量評估、輻射屏蔽設計、以及核反應堆物理計算等。該方法遵循統一的統計與去噪原理,具有廣泛的跨領域應用潛力。
- 還沒有人留言評論。精彩留言會獲得點贊!