一種抗腫瘤納米纖維藥膜的制備方法與流程
本發明屬于生物醫用材料領域,具體涉及一種抗腫瘤納米纖維藥膜的制備方法。
背景技術:
腫瘤是目前世界上發病率和死亡率最高的疾病,據我國普查資料顯示,每年因腫瘤死亡的患者高達160萬例,累計病例640萬例,我國每年新發腫瘤病例350萬例,這意味著平均每分鐘就有6人被診斷為腫瘤。發病率最高為胃癌,依次為肺癌、腸癌、乳癌和肝癌。因此,我國每年都在加大力度研發抗癌藥物,其中5-氟尿嘧啶(5-fluorouracil)是經典的腫瘤化療藥物,其作用機理為:5-氟尿嘧啶在腫瘤細胞內轉化為5-氟尿嘧啶脫氧核苷酸(5f-dump),可與還原型四氫葉酸及胸腺嘧啶核苷酸合成酶(ts)以共價結合形成三元復合物,使ts酸失活,進而抑制dna的合成,從而達到抑制腫瘤細胞增殖的效果。該藥主要為s期特異性藥物,但其在體內轉化為5-氟尿嘧啶核苷(5-fur)后,也能摻入rna中干擾蛋白合成,故對其他各期細胞也有作用。同時,5-氟尿嘧啶作為臨床上常用的代謝類抗癌藥物,其血漿半衰期僅為10~20min,治療劑量和中毒劑量接近,為達到治療效果,大劑量持續給藥將增加其毒副作用,而且用藥期間,血藥濃度迅速遞減,難以維持在理想的治療水平。
基于此,如何提高5-氟尿嘧啶的有效利用率,增強其對腫瘤的化療效果,同時降低其毒副作用,減少對正常細胞的損傷,延長藥物在體內的代謝周期,成為科研人員急需攻克的難題。
姜黃素(curcumin)是從姜科、天南星科中的一些植物的根莖中提取的一種化學成分,其中,姜黃約含3%~6%,是植物界很稀少的具有二酮的色素,為二酮類化合物。近年的研究不僅證明了姜黃的傳統作用,而且揭示出了一些新的藥理作用,如抗炎、抗氧化、保護心肌、抑制血管重構及抗動脈粥樣硬化、抗人類免疫缺陷病毒、保護肝臟和腎臟、抗纖維化以及防癌抗癌等作用,可能與其抑制核因子κ-b和激活蛋白-1等轉錄因子的激活及表達有關,而且無明顯的毒副作用。姜黃素的分子結構中的酚醛基側鏈和中央的亞甲基碳基團都可以脫掉一個氫原子,形成穩定的無毒害的自由基,它能選擇性地誘導癌細胞凋亡而對正常細胞作用很小。且研究報道姜黃素能抑制結直腸腫瘤細胞的增殖和轉移,并且存在多種可能與5-氟尿嘧啶發揮協調抗腫瘤的作用。
絲素蛋白是一種天然高分子纖維蛋白質,具有獨特的氨基酸組成,含有18種氨基酸,其中的11種為人體必需氨基酸,而且甘氨酸、丙氨酸、絲氨酸、酪氨酸四種主要氨基酸含量之和占其氨基酸總量的85%左右。絲素蛋白具備良好的生物相容性、生物可降解性及優良的機械性能,同時,絲素蛋白具有無規卷曲、silki、silkii、silkiii4種高級結構,通過調節絲素蛋白結構可以相互轉化,得到不同性能的絲素材料。因此,絲素蛋白是作為藥物緩釋載體的理想材料。
目前,腫瘤的治療手段包括手術、放化療及生物治療等。其中,化療作為腫瘤手術前后的有效療法,主要利用口服、靜脈或皮下注射等方式給藥,抗腫瘤藥物經血液循環分布全身,在體內達到一定的血藥濃度后產生治療作用。通常,小分子抗腫瘤藥物的體內半衰期短、給藥量大、選擇性差,對正常細胞產生很大的毒副作用。大多數抗腫瘤藥物在長期使用過程中,會促使細胞產生耐藥能力,降低藥物的治療效果。另外,小分子抗腫瘤藥物多為疏水性,例如紫杉醇類抗癌藥物的水中溶解度為1-5ug/ml。給藥過程中,為了促進小分子抗腫瘤藥物的溶解,往往添加表面活性劑或助溶劑,其中助溶劑(二甲基亞砜)容易引起神經毒性,危害患者的身體健康。因此,選擇合適的載體材料,構建藥物輸送系統,實現藥物的靶向輸送,降低其對正常組織的毒副作用,提高藥物的生物利用率,是十分必要的。
技術實現要素:
本發明目的是提供一種抗腫瘤納米纖維藥膜的制備方法,采用絲素蛋白搭載5-氟尿嘧啶和姜黃素兩種抗腫瘤藥物,一方面,根據化學預防的聯合治療原理,姜黃素協助提高5-氟尿嘧啶的抗腫瘤效果,同時降低后者的毒副作用,發揮共同抑制腫瘤細胞的作用;另一方面,利用緩釋材料(絲素蛋白)本身控制釋放抗腫瘤藥物的效果,解決化療藥物利用口服、靜脈注射等情況下產生的瞬時高劑量濃度、藥物本身的半衰期短,遠端達不到治療的效果等的問題。
本發明的技術方案是:
一種抗腫瘤納米纖維藥膜的制備方法,該方法包括如下步驟:
(1)制備質量分數為23~30%的絲素蛋白溶液;
(2)制取姜黃素、5-氟尿嘧啶及聚乙二醇(peg)混合溶液;
(3)將步驟(1)、(2)分別制得的溶液按照質量比為1~3:50的比例進行混合,制得靜電紡絲溶液,所述靜電紡絲溶液在室溫下靜置24h脫泡后倒入塑料注射針管,并安裝在高速滾筒靜電紡絲機中制得靜電噴射紡絲膜,即為抗腫瘤納米纖維藥膜。
進一步的,步驟(1)中所述制備質量分數為23~30%的絲素蛋白溶液包括如下步驟:
a)脫膠:將純水置于脫膠鍋中加熱,待所述純水即將沸騰時加入無水na2co3,使其充分溶解,待所述純水沸騰后加入蠶絲,每隔10~20min攪拌一次,煮30~50min,取出后用純水反復搓洗,置于通風廚中過夜干燥,制得脫膠蠶絲;
b)溶解:稱取70~90g溴化鋰并溶解,冷卻后定容至100~120ml,制得溴化鋰溶液,稱取多份所述脫膠蠶絲,分裝于多個燒杯中,每個燒杯中加入所述溴化鋰溶液,使所述脫膠蠶絲充分浸入,用錫箔紙封口,置于60~80℃烘箱中,每隔1小時搖晃一次,4~5小時后取出混合溶液;
c)透析:剪取多段透析袋,浸泡在純水中5~10min,將取出的多份所述混合溶液分別裝入到多個透析袋中,每個透析袋均放入含有4~5l純水的燒杯中透析,透析過程中每隔6h換水,36小時后制得絲素蛋白溶液;
d)濃縮:稱取peg溶解在去離子水中,制得濃度為15~20%的peg濃縮液,將所述絲素蛋白溶液倒入透析袋內,封口,放在所述peg濃縮液中濃縮36h,最后制得質量分數為23~30%的絲素蛋白溶液。
進一步的,步驟a)中所述搓洗次數至少為3次。
進一步的,步驟b)中所述脫膠蠶絲的份數至少為5份。
進一步的,步驟d)中所述聚乙二醇替換為氯仿、無水乙醇或甲醇中的任意一種。
進一步的,步驟(2)中所述制取姜黃素、5-氟尿嘧啶及peg混合溶液包括:設定姜黃素、5-氟尿嘧啶的質量相對于質量分數為23~30%的絲素蛋白溶液分別為0.3~0.4%、0.4~0.8%,將所述姜黃素、5-氟尿嘧啶溶解在peg溶液中,然后在室溫條件下在磁力攪拌器中密閉攪拌6h,制得姜黃素、5-氟尿嘧啶及peg混合溶液。
進一步的,步驟(3)中所述靜電噴射紡絲膜制成后,還需將所述靜電噴射紡絲膜在溫度為60~80℃、壓力為10mpa的條件下進行真空干燥抽濾時間24h,去除殘留有機溶劑,制得抗腫瘤納米纖維藥膜。
進一步的,將所述抗腫瘤納米纖維藥膜置于玻璃干燥器內,同時向所述玻璃干燥器內加入100ml的乙醇溶液,使用循環水式真空泵進行抽真空,維持真空度在0.01mpa以下,進行乙醇蒸汽處理。
本發明所述抗腫瘤納米纖維藥膜的具體優點如下:
(1)通過靜電紡絲技術實現抗腫瘤藥物與釋放載體的有效結合,形成藥物控制釋放體系,實現藥物的控制釋放,延長藥物在體內的半衰期;
(2)以絲素蛋白溶液為主要組份材料,因此制得的靜電噴射薄膜可以在體內自行降解,且降解產物為二氧化碳和水,經人體代謝可以排出體外;
(3)實現了藥物的靶向輸送,將藥物輸送至腫瘤部位,達到靶向治療的效果,降低其對正常組織的毒副作用;
(4)通過化學鍵結合,提高了低水溶性抗腫瘤藥物的溶解性,同時采用化學聯合治療,提高了給藥效率;
(5)有效地實現了紡織技術與生物醫藥的創新結合,為推廣和提升生物醫用紡織的發展,提供了新思路。
附圖說明
為了更清楚地說明本發明實施例的技術方案,下面將對實施例描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅是本發明的一些實施例,對于本領域普通技術人員來講,在不付出創造性勞動性的前提下,還可以根據這些附圖獲得其它的附圖。其中,
圖1為本發明中所述的一種抗腫瘤納米纖維藥膜的制備方法所制備的不同配方的抗腫瘤納米纖維藥膜的電鏡圖;
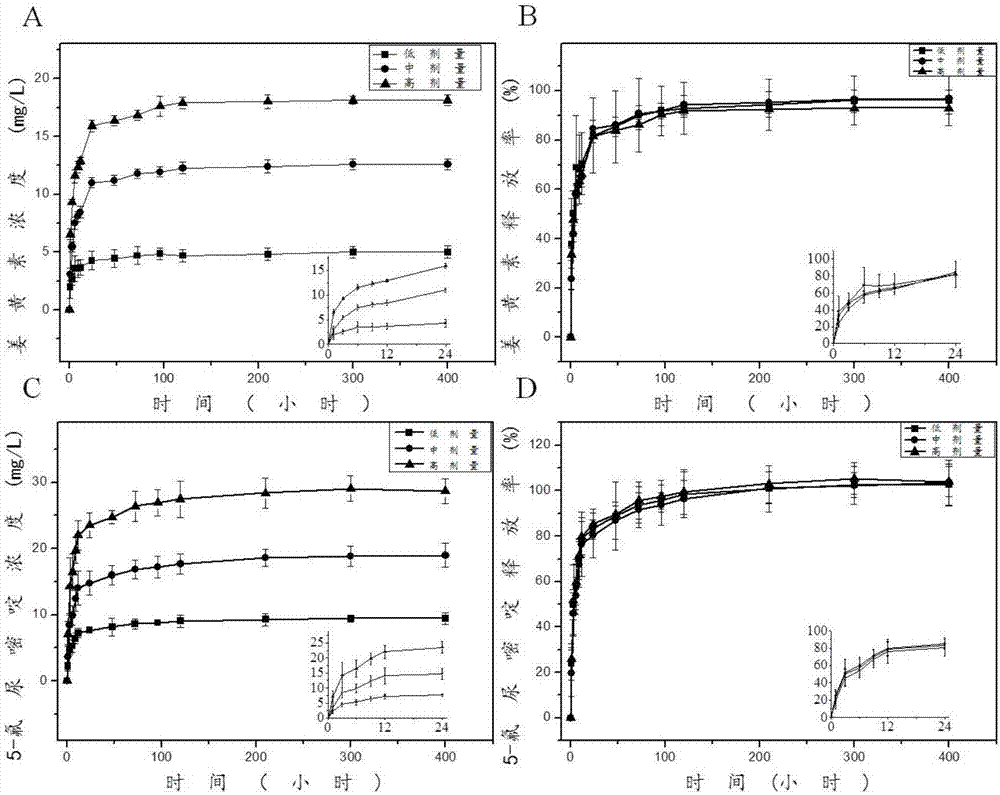
圖2為本發明中所述的一種抗腫瘤納米纖維藥膜的制備方法所制備的不同配方的抗腫瘤納米纖維藥膜的緩釋曲線圖。
具體實施方式
本發明提供一種抗腫瘤納米纖維藥膜的制備方法,包括以下步驟:
(1)制備質量分數為23~30%的絲素蛋白溶液;
(2)制取姜黃素、5-氟尿嘧啶及peg混合溶液;
(3)將步驟(1)、(2)分別制得的溶液按照質量比為1~3:50的比例進行混合,制得靜電紡絲溶液,所述靜電紡絲溶液在室溫下靜置24h脫泡后倒入塑料注射針管,并安裝在高速滾筒靜電紡絲機中制得靜電噴射紡絲膜,即為抗腫瘤納米纖維藥膜。
為使本發明的上述目的、特征和優點能夠更加明顯易懂,下面結合具體實施方式對本發明作進一步詳細的說明。
一種抗腫瘤納米纖維藥膜的制備方法,包括:
步驟一:制備質量分數為23%的絲素蛋白溶液;
在一個實施例中,該步驟可以具體如下執行:制備質量分數為23~30%(絲素蛋白/混合溶液,w/w)的絲素蛋白溶液:
首先,脫膠:量取12l純水于脫膠鍋中加熱,稱取20~30g無水na2co3,待水即將沸騰時加入所述無水na2co3,使其充分溶解,稱取25~35g蠶絲,待水沸騰后加入所述蠶絲,每隔10min攪拌一次,煮30~40min,取出后用純水反復搓洗3次,置于通風櫥中過夜干燥,制得脫膠蠶絲;
然后,溶解:稱取70~90g溴化鋰(99.9%)溶解,冷卻后定容至100~120ml(9.3m),制得溴化鋰溶液,稱取5份所述脫膠蠶絲,每份5g分裝于50ml燒杯中,每個燒杯中加入20ml所述溴化鋰溶液,使所述脫膠蠶絲充分浸入,用錫箔紙封口,置于60~80℃烘箱中,每隔1小時搖晃一次,4小時后取出混合溶液;
接著,透析:剪取5段透析袋,浸泡在純水中約5-10min,將取出的5份所述混合溶液分別裝入到5個透析袋中,每個透析袋均放入含有4~5l純水的燒杯中透析,36~40小時,透析過程中換水6次,制得絲素蛋白溶液;
最后,濃縮:稱取300~400g聚乙二醇(polyethyleneglycol,peg)(20000),溶解在去離子水中,制得質量分數為15~20%的聚乙二醇濃縮液,將所述絲素蛋白溶液倒入透析袋內,封口,放在所述聚乙二醇濃縮液中濃縮36h,最后制得質量分數為23~30%的絲素蛋白溶液。
步驟二:制取姜黃素、5-氟尿嘧啶及peg混合溶液;
在一個實施例中,該步驟可以具體如下執行:在支架植入治療過程中,為了使藥膜中藥物的釋放濃度達到有效濃度以上,所以設定姜黃素、5-氟尿嘧啶的質量相對于絲素蛋白溶液(質量分數15~25%)分別為0.3~0.5%、0.4~0.8%,將所需的姜黃素、5-氟尿嘧啶溶解在聚乙二醇(400)溶液中,室溫下,將溶液在磁力攪拌器上密閉攪拌6h,超聲(功率120~150w)30~40min,加速雙藥在peg溶液中的溶解,形成均勻穩定的姜黃素、5-氟尿嘧啶及peg混合溶液。
步驟三:將步驟(1)、(2)分別制得的溶液按照質量比為1~3:50的比例進行混合,制得靜電紡絲溶液,所述靜電紡絲溶液在室溫下靜置24h脫泡后倒入塑料注射針管,并安裝在高速滾筒靜電紡絲機中制得靜電噴射紡絲膜,即為抗腫瘤納米纖維藥膜。
在一個實施例中,該步驟可以具體如下執行:將步驟(1)、(2)分別制得的溶液)按照固定比例(w/w=1~3:50)進行混合,制得靜電紡絲溶液,在室溫下靜置24h脫泡后用于后續紡絲,將配制好的靜電紡絲溶液倒入10~60ml塑料注射針管,針頭直徑為0.1~0.5mm,安裝在高速滾筒靜電紡絲機中。紡絲過程中工作參數設定為:紡絲電壓15~25kv,極距150~250mm,注速0.1~0.5ml/h,紡絲結束后得到靜電噴射紡絲膜,放置于通風櫥12h,即得抗腫瘤納米纖維藥膜。
上述步驟所得的抗腫瘤納米纖維藥膜,其性能請參閱圖1、圖2和表1,請參閱圖1,圖1為本發明中所述的一種抗腫瘤納米纖維藥膜的制備方法所制備的不同配方的抗腫瘤納米纖維藥膜的電鏡圖。如圖1所示,圖1中(a),(b),(c)及(d)分別為本發明制備的純絲素藥膜纖維、低劑量藥膜纖維、中劑量藥膜纖維及高劑量藥膜纖維的掃描電鏡顯微鏡(sem)的測試結果。從圖中可以看出,各組纖維直徑依次為756±25nm、524±46nm、631±57nm及1239±136nm。其中,前3組纖維直徑粗細均勻,無明顯粘連現象。隨著溶解藥物的濃度增加至高劑量,peg含量增加,導致紡絲液粘度增大,并且其電導率降低,纖維在紡絲過程中牽伸作用減弱,出現珠狀物、纖維粘結及纖維粗細不勻等現象。
請參閱圖2,圖2為本發明中所述的一種抗腫瘤納米纖維藥膜的制備方法所制備的不同配方的抗腫瘤納米纖維藥膜的緩釋曲線圖。其表示不同配方納米藥膜的藥物釋放動力學(hplc)的測試結果,在圖2中(a)、(b)、(c)和(d)為姜黃素、5-氟尿嘧啶在本發明制備的高、中及低劑量藥膜中的緩釋情況。其中,藥物緩釋條件為:37~40℃,ph=7.4~7.9,對比得出,隨著藥物含量的增加,緩釋速度增大,緩釋量增多。同時,在緩釋至200h左右時,藥物緩釋量達到80%,其在400h左右緩釋結束。整體過程,沒有出現明顯的“突釋”現象,藥物可以持續、穩定的釋放。
表1為本發明實施例1中所述的抗腫瘤納米纖維藥膜的機械性能的測試結果(平均斷裂強度和平均斷裂伸長率)。由表1得出,藥物及peg的添加,有助于增強纖維膜的機械性能。原因為纖維直徑的增加(如sem圖);添加物有可能使絲素的無規卷曲silki結構趨向穩定的silkii結構,從而使單根纖維的機械性能增加。結果表明,可以調控藥膜的機械性能,從而為下一步的臨床治療創造條件。
表1紡絲膜的平均斷裂強度和平均斷裂伸長率
為使本發明的上述目的、特征和優點能夠更加明顯易懂,下面結合附圖和實施例進一步說明本發明的技術方案。但是本發明不限于所列出的實施例,還應包括在本發明所要求的權利范圍內其他任何公知的改變。
首先,此處所稱的“一個實施例”或“實施例”是指可包含于本發明至少一個實現方式中的特定特征、結構或特性。在本說明書中不同地方出現的“在一個實施例中”并非均指同一個實施例,也不是單獨的或選擇性的與其他實施例互相排斥的實施例。
其次,本發明利用結構示意圖等進行詳細描述,在詳述本發明實施例時,為便于說明,示意圖會不依一般比例作局部放大,而且所述示意圖只是實例,其在此不應限制本發明保護的范圍。此外,在實際制作中應包含長度、寬度及深度的三維空間。
實施例一
本實施案例按如下步驟展示一種抗腫瘤納米纖維藥膜的制備方法:
姜黃素、5-氟尿嘧啶溶于peg/絲素蛋白(w/w=3:50)混合溶劑中,分別配置成質量分數為2~3%、4~5%、6~7%的靜電紡絲溶液。配制好的靜電紡絲溶液倒入10~60ml塑料注射針管,針頭直徑為0.1~0.5mm,安裝在高速滾筒靜電紡絲機。紡絲過程中工作參數設定為:紡絲電壓15~30kv,極距150~250mm,注速0.1~0.3ml/h,紡絲結束后得到靜電噴射紡絲膜。將紡絲膜進行真空干燥抽濾(溫度60~80℃、壓力10~15mpa、時間24~30h),去除殘留有機溶劑。
成型的納米纖維藥膜置于玻璃干燥器內,同時向干燥器內加入100~200ml的乙醇溶液,使用循環水式真空泵進行抽真空,維持真空度在0.01mpa以下,進行乙醇蒸汽處理。促使藥膜的二級結構發生轉變,增加形成β折疊結晶結構,使之不溶于水,便于后期藥物的控制釋放。
實施例二
本實施案例按如下步驟展示一種抗腫瘤納米纖維藥膜的制備方法:
姜黃素、5-氟尿嘧啶溶于氯仿(無水乙醇、甲醇)/絲素蛋白(w/w=3:50)混合溶劑中,分別配置成質量分數為2~3%、4~5%、6~7%的靜電紡絲溶液。配制好的靜電紡絲溶液倒入儲液池,通過金屬電機連接高壓電源,利用導氣管不斷吹入高速氣流,帶動紡絲液進入高壓電場完成纖維的牽伸,從而達到納米級纖維的效果。氣泡紡絲過程中工作參數設定為:紡絲電壓15~30kv,極距250~300mm,氣流速度0.2~0.6l/min,紡絲結束后得到靜電噴射紡絲膜。將紡絲膜進行真空干燥抽濾(溫度60~80℃、壓力10~15mpa、時間24~30h),去除殘留有機溶劑。對紡絲膜進行水蒸氣處理6~9h,降低其在水中的溶解度。
成型的納米纖維藥膜置于玻璃干燥器內,同時向干燥器內加入100~200ml的乙醇溶液,使用循環水式真空泵進行抽真空,維持真空度在0.01mpa以下,進行乙醇蒸汽處理。促使藥膜的二級結構發生轉變,增加形成β折疊結晶結構,使之不溶于水,便于后期藥物的控制釋放。
實施例三
本實施案例按如下步驟展示一種抗腫瘤納米纖維藥膜的制備方法:
姜黃素、5-氟尿嘧啶分別單獨溶于聚乙二醇/絲素蛋白(w/w=1~3:50)混合溶劑中,分別配置成藥物質量分數為4%的靜電紡絲溶液。使用磁力攪拌器密閉攪拌10~20min,轉速為600~800r/min,超聲分散1~2h,保證藥物完全溶解,得到均勻穩定溶液,室溫靜置24h進行脫泡處理后進行紡絲,本實施例采用雙通道恒流注射泵,兩針管分別推注含姜黃素、5-氟尿嘧啶的紡絲液。工作參數設定為:紡絲電壓25±0.5kv,極距220±5mm,注速0.2±0.05ml/h,時間9~12h。本實施例為雙針頭噴射紡絲纖維,利用牽伸過程中的易卷曲、易交叉的特性,完成纖維的均勻分布,形成表面光滑、尺寸均勻的紡絲噴射薄膜。
將紡絲膜進行真空干燥抽濾(溫度60~80℃、壓力10~15mpa、時間24~30h),去除殘留有機溶劑。對紡絲膜進行水蒸氣處理6~9h,降低其在水中的溶解度。成型的納米纖維藥膜置于玻璃干燥器內,同時向干燥器內加入100~200ml的乙醇溶液,使用循環水式真空泵進行抽真空,維持真空度在0.01mpa以下,進行乙醇蒸汽處理。促使藥膜的二級結構發生轉變,增加形成β折疊結晶結構,使之不溶于水,便于后期藥物的控制釋放。
通過水蒸氣/甲醇處理可以促使納米纖維藥膜的水中溶解度降低,并且纖維膜的力學性能增強,有利于促進藥物的控制釋放,可以滿足復合膜及植入人體內所需的力學強度要求,后期適合挖掘其在組織工程領域的潛力。
綜上所述,本發明公開了一種抗腫瘤納米纖維藥膜的制備方法,其制得的抗腫瘤納米纖維藥膜主要治療腸道、喉部及鼻腔等腫瘤,上述部位均可以借助外部作用,植入抗腫瘤藥物輸送系統。例如:喉部腫瘤,采用自膨式支架外部裹覆抗腫瘤納米緩釋藥膜,借助光學儀器將覆膜支架準確植入至喉腔,使之貼合病灶部位,利用通透性和滯留效應將藥物輸送至腫瘤部位,達到靶向治療的效果,降低其對正常組織的毒副作用。
應說明的是,以上實施例僅用以說明本發明的技術方案而非限制,盡管參照較佳實施例對本發明進行了詳細說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的精神和范圍,其均應涵蓋在本發明的權利要求范圍當中。
- 還沒有人留言評論。精彩留言會獲得點贊!