一種制備溫敏性交替層狀藥物釋放復合材料的方法與流程
本發明涉及一種溫敏性交替層狀藥物釋放復合材料的制備方法,更具體的說是涉及一種結構形態可定構、性能可設計、可生物降解、安全無毒、力學性能優良、可連續化生產、藥物釋放行為靈活可控的溫敏性交替層狀藥物釋放復合材料的方法,屬于功能復合材料技術領域。
背景技術:
環境響應型藥物緩釋材料是指能夠對外部環境刺激產生響應以實現所載藥物可控釋放的材料。與傳統給藥體系相比,它們可隨物理因素的刺激(電場、磁場、溫度、光照和壓力)或化學因素的刺激(ph值、離子強度、化學試劑的添加等)發生形態或化學結構的變化,進而實現藥物的智能釋放,大大提高藥效和降低毒副作用[1]。
溫度是環境響應型藥物緩釋材料中研究最多的一種刺激信號,這是因為溫度變化控制起來相對比較容易,在體內外均容易實現[2]。傳統溫度響應型藥物釋放材料一般是將藥物負載于溫敏性聚合物基體或膠束中,其優點是能快速針對溫度變化做出響應而釋放藥物,但由于聚合物在響應溫度相變或水合程度變化使其滲透性發生突變,藥物釋放易發生突釋使釋藥量難以有效調控,急需進行結構優化設計實現藥物智能可控釋放。
將溫度響應型藥物釋放材料設計成溫度響應層和藥物負載層疊合的層狀結構,溫度響應層在響應溫度可發生形態結構突變打開釋藥通道,起到智能開關作用,使藥物負載層中的藥物通過層間擴散釋放出來,實現其可控釋放[3]。sirousazar等人[4]模擬了一種由載藥芯層、可相變中間層以及聚合物保護層構成的三層溫度響應型載藥材料,并研究其溫度響應釋藥行為,擬合結果顯示當環境溫度達到可相變中間層的相變溫度時,中間層發生相變形成藥物釋放通道,可實現藥物的可控響應釋放。該模擬結果也得到了其他學者的實驗驗證。russell等人[5]將負載熒光染料的介孔二氧化硅薄膜表面接枝溫敏性聚合物(異丙基丙烯酰胺和丙烯酰胺共聚物)作為溫度開關控制二氧化硅介孔的開合。溫度低于lcst時,聚合物垂直于薄膜表面使孔洞閉合,阻礙藥物釋放;高于lcst時,聚合物在薄膜表面塌陷,薄膜孔洞打開實現孔內藥物的可控釋放。有學者采用層層自組裝的方式制備溫敏性層狀藥物釋放材料,可制備更高層數的載藥材料,利用不同層數堆疊進一步設計藥物擴散通道,調控藥物釋放行為。lyon等人[6]以paa修飾的pnipam凝膠與pah構筑微凝膠多層膜,將小分子藥物鹽酸阿霉素(dx)負載到微凝膠膜中,研究了溫度對dx釋放動力學的影響。結果表明當溫度升高時,dx的釋放速率加快,實現了利用溫度對dx釋放的調控。quinn等人[7]使用具有溫度響應性質的pnipaam和paa組裝了具有溫度響應性的氫鍵多層膜,羅丹明b可以被可逆的裝載和釋放,而其裝載和釋放速率隨溫度變化,溫度越高裝載和釋放羅丹明b的速率越快,實現其可控釋放。
以上方法雖可獲得具有層狀有序結構的溫度響應載藥材料,實現藥物的溫敏性可控釋放,但受限于化學接枝法較為苛刻的反應條件,以及層層自組裝法對組裝驅動力的限制(一般為氫鍵或靜電等弱分子間相互作用力),可供選擇的載體材料和藥物種類較少,難以滿足不同釋藥需求;所獲得層狀溫度響應載藥材料的單層結構和層間復配等難以有效調控,無法針對不同溫度響應釋藥需求進行結構和釋放行為的設計;常用的溫敏性材料pnipam本身生物相容較差,合成過程中殘余丙烯酰胺單體具有神經毒性,對人體有一定毒副作用;所用制備方法繁瑣,一般會用到有機溶劑,難以實現連續性規模化生產,難以滿足溫敏性載藥材料批量化生產需要。發展溫敏性交替層狀藥物釋放復合材料的制備新技術,實現層結構的有效調控和藥物的多重溫敏性釋放行為,揭示其藥物釋放規律,對促進藥物釋放材料的發展和實際應用具有重要意義。
參考文獻
[1]ruichanlv,piaopingyang,feihe,shiligai,guixinyang,yunludai,zhiyaohou,junlin.animaging-guidedplatformforsynergisticphotodynamic/photothermal/chemo-therapywithph/temperature-responsivedrugrelease.biomaterials,2015,63:115-127.
[2]zhiqianglin,weigao,hongxianghu,kunma,binghe,wenbingdai,xueqingwang,jianchengwang,xuanzhang,qiangzhang.novelthermo-sensitivehydrogelsystemwithpaclitaxelnanocrystals:highdrug-loading,sustaineddrugreleaseandextendedlocalretentionguaranteeingbetterefficacyandlowertoxicity.journalofcontrolledrelease,2014,174:161-170.
[3]kaizhang,xiaoyuwu.temperatureandph-responsivepolymericcompositemembranesforcontrolleddeliveryofproteinsandpeptides.biomaterials,2004,25(22):5281-5291.
[4]sirousazarm,shaabaniy.modelingofdrugreleasefromanoveltemperature-responsivephase-transientdrugdeliverysystemincylindricalcoordinates.journalofmacromolecularscience,partb,2015,54(4):450-468.
[5]melissam.russell,lorraineraboin,taniam.guardado-alvarez,jeffreyi.zink.trappingandreleaseofcargomoleculesfromamicro-stampedmesoporousthinfilmcontrolledbypoly(nipaam-co-aam).journalofsol-gelscienceandtechnology,2014,70(2):278-285.
[6]michaelj.serpe,kristena.yarmey,christinem.nolan,l.andrewlyon.doxorubicinuptakeandreleasefrommicrogelthinfilms.biomacromolecules,2005,6(1):408-413.
[7]johnf.quinn,frankcaruso.faciletailoringoffilmmorphologyandreleasepropertiesusinglayer-by-layerassemblyofthermoresponsivematerials.langmuir,2004,20(1):20-22。
技術實現要素:
針對傳統溶液法制備溫敏性層狀藥物釋放材料制備條件苛刻、所選擇單體生物相容性差、材料的單層結構和層間復配等難以調控的缺點,本發明的目的旨在提出一種結構形態可定構、性能可設計、可生物降解、安全無毒、力學性能優良、可連續化生產、藥物釋放行為靈活可控的溫敏性交替層狀藥物釋放復合材料的方法。該方法能通過材料結構設計和擠出加工過程中的形態調控等構筑不同的溫度響應釋放通道,進而靈活控制溫敏性交替層狀藥物釋放復合材料的溫度響應行為和釋藥行為;通過單層結構設計和層間靈活復配,設計不同藥物釋放行為,滿足不同釋藥需要;并可通過結構設計和擠出工藝的控制有效調控材料降解和力學行為,保證藥物靈活可控釋放的同時提高載體的力學性能。該方法同時具有加工及使用過程中安全無毒、制備簡單、可連續化生產、質量穩定、適宜大規模工業化生產的優點。
本發明的基本原理是,通過選擇在低溫易發生相變的疏水性生物降解小分子材料作為溫度響應功能相與生物降解高分子復合形成高分子基溫度響應層,水溶性不同的生物降解高分子作為高分子基藥物負載層,通過熔融共擠出的方式使高分子基藥物負載層物料和高分子基溫度響應層物料交替有序排布形成溫敏性交替層狀藥物釋放復合材料,并通過交替層結構設計,靈活調控高分子基藥物負載層形態結構,優化藥物分散狀態;利用層倍增器在多次層狀疊合時的剪切、拉伸作用調控高分子基溫度響應層的高分子基體和溫度響應功能相的形態結構,設計不同的溫度開關響應釋放通道。本發明從這點出發,在加工方法上致力于實現高分子基藥物負載層和高分子基溫度響應層的良好交替復配,并通過對材料單層結構和整體層結構的形態調控來控制藥物釋放周期和溫度開關響應釋放通道,由此調控藥物在溫敏性交替層狀藥物釋放復合材料中的釋放行為。具體來講,本發明是通過熔融共擠出制備高分子基藥物負載層和高分子基溫度響應層交替有序排布的溫敏性交替層狀藥物釋放復合材料,并在擠出過程中分層疊加力場的剪切拉伸作用下調節藥物負載層分散相和藥物的分散及分布形態結構;選取單一低熔點分散相或不同熔點分散相的復配設計高分子基溫度響應層溫度響應功能相的響應溫度,通過擠出過程的剪切拉伸作用調節溫度響應功能相形態結構和響應釋藥通道;并通過調節高分子基藥物負載層和高分子基溫度響應層的單層結構、層數和相對厚度改變藥物釋放通道并調控藥物釋放周期,最終得到的溫敏性交替層狀藥物釋放復合材料的藥物釋放行為靈活可調,力學性能也得到同步提高。
本發明基于上述原理,實現上述發明目的所采用的技術方案是:由以下高分子基藥物負載層物料和高分子基溫度響應層物料分別經擠出機熔融塑化擠出、并在匯流器中疊合在一起形成2層的初始結構后,再經過與所述匯流器連接的若干層倍增器的多次層狀疊合作用,形成的具有高分子基藥物負載層和高分子基溫度響應層交替排布的多層結構擠出物:
(1)所述的高分子基藥物負載層中的高分子為可熔融加工、熔點在60℃~250℃之間、水不溶性的生物降解高分子材料(藥物負載層的高分子基體)和在水中溶解度大于0.1g/ml的生物降解高分子材料(藥物負載層的高分子分散相)按重量百分比為50~99.99%:50~0.01%進行混合的共混物;
(2)所述的高分子基溫度響應層中的高分子為可熔融加工、熔點在60℃~250℃之間、水不溶性的生物降解高分子材料(溫度響應層的高分子基體)和熔點在30~60℃之間、親水接觸角大于90o的疏水性生物降解小分子材料(溫度響應層的溫度響應功能相)按重量百分比為50~99.99%:50~0.01%進行混合的共混物;其中所選擇溫度響應層的生物降解高分子基體的熔點比該層疏水性生物降解小分子分散相至少高15℃。
在上述經過與匯流器連接的若干層倍增器的多次層狀疊合作用的過程中,制備方法采用在中國專利cn101439576a所公開的由擠出機(a、b)、分配器(c)、層倍增器(d)和出口模(e)構成的微層共擠裝置,其特點是先分別制備高分子基藥物負載層物料和高分子基溫度響應層物料,然后將高分子基藥物負載層物料和高分子基溫度響應層物料分別投入微層共擠出裝置的兩臺擠出機(a、b)中,熔融塑化后,使兩股熔體在分配器(c)中疊合,經n個層倍增器(d)的切割和疊加后,從出口模(e)流出,再經過三輥壓延機的壓制和牽引機的牽引,得到2(n+1)層由高分子基藥物負載層和高分子基溫度響應層連續交替分布的溫敏性交替層狀藥物釋放復合材料。
這樣就可以通過多層共擠出的方法實現高分子基藥物負載層和高分子基溫度響應層的交替疊加,并通過構建復合材料的形態結構,實現溫敏性交替層狀藥物釋放復合材料的結構優化,交替疊加結構中最外層的高分子基藥物負載層可使材料具備合理的初始釋藥量,隨后高分子基溫度響應層可提供溫度響應的釋藥通道使材料具備溫度響應釋藥性能,且層結構的構筑可使藥物釋放性能和力學性能同時得到提高。這種新型溫敏性交替層狀藥物釋放復合材料的制備方法一方面能靈活調控藥物釋放復合材料的形態結構和釋藥行為,滿足不同的釋藥需求,另一方面可避免溶劑的使用,從根本上解決了溶劑難以處理、污染環境等問題。
上述所得的溫敏性交替層狀藥物釋放復合材料實際為片材型藥物釋放復合材料,可再根據釋藥和應用需求裁剪成不同形狀和尺寸的藥物釋放復合材料,從而滿足不同的釋藥需求。
上述所述的高分子基藥物負載層中的高分子為水溶性不同的生物降解高分子材料的共混物,其中水不溶性的高分子材料為基體(即高分子基藥物負載層的高分子基體),選自聚己內酯、聚丁二酸丁二醇酯、聚乳酸、乙基纖維素、醋酸纖維素、聚羥基丁酸酯、聚碳酸亞丙酯中的一種;在水中溶解度大于0.1g/ml的高分子材料為分散相(即高分子基藥物負載層的高分子分散相),選自聚氧化乙烯、聚乙二醇、熱塑性淀粉、熱塑性聚乙烯醇、聚乙烯基吡咯烷酮、羥乙基纖維素和羧甲基纖維素中的一種。并可在擠出過程分層疊加力場的剪切拉伸作用下調節藥物負載層分散相和藥物的分散及分布形態結構,使藥物具有不同的初始釋藥性能。
上述所述的高分子基藥物負載層中的藥物含量為該層高分子總重量的0.01~40%,選自雙氯芬酸鈉、布洛芬、酒石酸美托洛爾、頭孢氨芐、尼莫地平、茶堿、水飛薊素、硝硫氰胺、硝苯地平中的一種。
上述先制備高分子基藥物負載層物料的方式是將該層中高分子和藥物在高混機中進行混合。
上述先制備高分子基藥物負載層物料的方式也可以是將該層中高分子和藥物在擠出機中進行熔融混合。
上述先制備高分子基藥物負載層物料的方式也可以是將該層中高分子和藥物先在高混機中進行混合,再在擠出機中進行熔融混合。
上述所述的的高分子基溫度響應層中的高分子基體選自聚己內酯、聚丁二酸丁二醇酯、聚乳酸、乙基纖維素、醋酸纖維素、聚羥基丁酸酯、聚碳酸亞丙酯中的一種,高分子基溫度響應層的溫度響應功能相選自甘油三月桂酸酯、甘油三棕櫚酸酯、甘油三肉豆蔻酸酯、甘油三硬脂酸酯、月桂酸和十四醇中的一種或幾種。選取單一低熔點分散相或不同熔點分散相的復配可設計溫度響應層溫度響應功能相的響應溫度,利用層倍增器在多次層狀疊合時的剪切、拉伸作用調控溫度響應層的高分子基體和溫度響應功能相的形態結構,設計不同的溫度開關響應釋放通道,獲得所需溫度響應釋藥行為。
上述所述的高分子基溫度響應層所選擇的生物降解高分子基體的熔點比疏水性生物降解小分子溫度響應功能相至少高15℃,旨在利用不同功能體的熔點不同,當溫度接近或高于溫度響應功能相熔點時其部分熔融發生相形態的變化,形成藥物擴散釋放通道加速水分子的滲透和藥物的擴散溶出,實現藥物的溫度響應釋放。因而熔點較低的小分子作為溫度響應功能相,可生物降解高分子基體作為力學支撐相,以期在不使力學性能降低的情況下實現載體材料對溫度的響應性釋藥行為。
上述先制備高分子基溫度響應層物料的方式是將該層中高分子共混物在高混機中進行混合。
上述先制備高分子基溫度響應層物料的方式也可以是將該層中高分子共混物在擠出機中進行熔融混合。
上述先制備高分子基溫度響應層物料的方式也可以是將該層中高分子共混物先在高混機中進行混合,再在擠出機中進行熔融混合。
上述所述擠出物是由兩臺擠出機(a、b)、匯流器(c)、若干層倍增器(d)、出口模(e)和冷卻牽引裝置(f)組成的多層擠出系統通過熔融擠出制備得到,其藥物釋放性能可通過總厚度、內部的總層數、高分子基藥物負載層和高分子基溫度響應層的厚度比進行調控,其中:擠出物的總厚度為0.01-10mm;擠出物內部的總層數數目為2-32768;所述高分子基藥物負載層和高分子基阻隔層的厚度比為1:99-99:1。
上述所述擠出物初始結構的層數可以通過所述匯流器(c)中的切換器對流道數進行調控:所述的多層結構擠出物的2層初始結構是由一層高分子基溫度響應層和一層高分子基藥物負載層疊合組成,當使用n個層倍增器進行層狀疊合作用后,擠出物的層數為2(n+1)層,其中,n為0-14。此時得到的溫敏性交替層狀藥物釋放復合材料具備合理的初始釋藥量和溫度響應藥物釋放行為。
本發明與現有技術的溶液法制備溫敏性交替層狀藥物釋放復合材料的方法相比,概括起來具有以下突出的優點:
1、本發明所提出的溫敏性交替層狀藥物釋放復合材料的溫度響應功能相是熔點較低的疏水性生物降解小分子,具有生物相容性良好、易于熱熔加工的優點,其疏水性可在溫度較低時使水分子不易滲透入樣品內部使藥物溶出,有效地減弱了藥物的突釋;而當溫度接近或高于溫度響應功能相熔點時其部分熔融發生相形態的變化,形成藥物擴散釋放通道加速水分子的滲透和藥物的擴散溶出,實現藥物的溫度響應釋放。
2、本發明所提出的制備溫敏性交替層狀藥物釋放復合材料的方法,可在擠出過程分層疊加力場的剪切拉伸作用靈活調節高分子基藥物負載層和高分子基溫度響應層的形態結構,將不同功能層進行良好有效復配,從而可靈活設計藥物的初始釋放量和溫度響應釋放行為,滿足所需釋藥需求。
3、本發明所提出的溫敏性交替層狀藥物釋放復合材料為高分子基藥物負載層和高分子基溫度響應層交替排布的層狀結構,選用不同數量的層倍增器,并通過調控擠出機轉速比可設計層結構形態及高分子基藥物負載層和高分子基溫度響應層的不同厚度比,進而定構所需的釋放通道,調控藥物的溫度響應釋放周期,制備性能可控的材料,實現高分子結構、形態和溫度響應藥物釋放性能的智能化調控。
4、本發明所提出的溫敏性交替層狀藥物釋放復合材料的生物降解高分子基體和溫度響應功能相均是生物相容性良好的可降解材料,對人體無毒副作用,所制備的溫敏性交替層狀藥物釋放復合材料安全無毒,環境友好,性質穩定,而且可以顯著提高溫敏性交替層狀藥物釋放復合材料的力學性能,可有效避免用藥期間載體材料崩解變形而使藥物突釋,造成血藥濃度偏高。
5、本發明能精確計算和控制藥物負載量,克服由于藥物負載量計量不準而導致的藥物釋放量難以精確控制的難題。同時藥物加入量靈活可調,其占聚合物重量的0.01~40%之間,避免一般制備藥物緩釋體系時藥物加入量局限性大的缺點。
6、本發明公開的熔融共擠出制備溫敏性交替層狀藥物釋放復合材料的方法,制備過程一次成型,工藝簡單,操作控制方便;不需添加其他對人體有毒害的試劑或助劑,生物相容性良好,適用于大多數對熱不敏感藥物的溫度響應釋放。
7、本發明所提出的制備方法是一種連續生產過程,有利于生產效率的提高;工藝簡單,不同批次之間的產品質量指標穩定,可大規模工業化生產,應用范圍廣,具有廣闊的工業化和市場前景;實現了聚合物產品高性能化和功能化同一,提高了聚合物產品的附加價值,拓寬了聚合物產品的應用范圍,在聚合物復合材料理論研究和應用開發等方面具有重要意義。
附圖說明
下面結合附圖進一步說明本發明。
圖1為本發明所涉及的微層共擠裝置的結構示意圖:a,b為擠出機;c為分配器;d為層倍增器;e為冷卻牽引裝置。
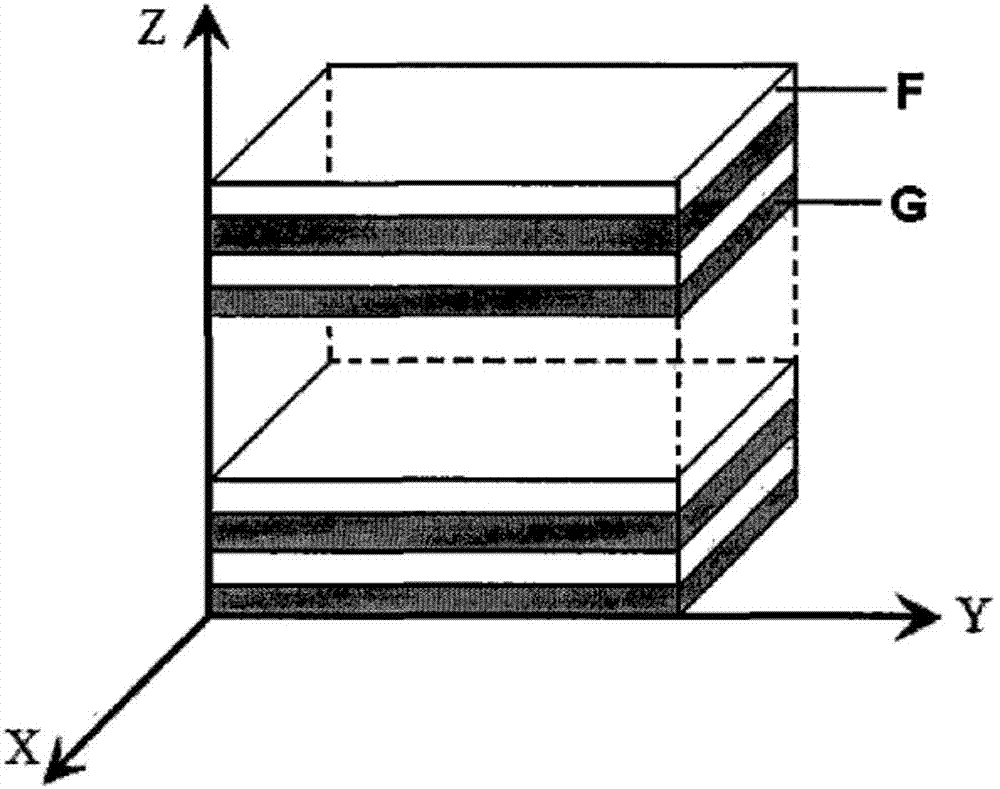
圖2為本發明制備的多層溫敏性交替層狀藥物釋放復合材料的結構放大示意圖。在圖中,f:高分子基藥物負載層,g:高分子基溫度響應層。
具體實施方法:
以下通過實施例對本發明進行進一步的具體描述。在以下各實施例中,各組分的用量均為質量用量。有必要在此指出,下面實施例只是對本發明的進一步說明,不能理解為對本發明保護范圍的限制,該領域的技術人員可以根據上述本發明內容對本發明進行一些非本質的改進和調整。
實施例1
一種聚己內酯(藥物負載層基體)-聚乙二醇(藥物負載層分散相)-雙氯芬酸鈉(藥物)/聚己內酯(溫度響應層基體)-甘油三月桂酸酯(溫度響應層溫度響應功能相)溫敏性交替層狀藥物釋放復合材料的原料包括以下組分及重量份含量:
高分子基藥物負載層組分配比重量份數
聚己內酯(為藥物負載層基體)90
聚乙二醇(為藥物負載層分散相)10
雙氯芬酸鈉(為藥物)5
高分子基溫度響應層組分配比重量份數
聚己內酯(為溫度響應層基體)90
甘油三月桂酸酯(為溫度響應層溫度響應功能相)10
說明:藥物負載層為高分子基藥物負載層的簡稱,溫度響應層為高分子基溫度響應層的簡稱。雙氯芬酸鈉(為藥物)的重量為藥物負載層基體和分散相總重量的5%。
第一步,首先按上述組分備料;
第二步,將上述物料置于40℃真空烘箱干燥12小時;
第三步,將第二步得到的干燥藥物負載層物料聚己內酯、聚乙二醇和雙氯芬酸鈉及溫度響應層物料聚己內酯和甘油三月桂酸酯分別置于高混機中預混合5分鐘,其轉速為100轉/分鐘,得到聚己內酯、聚乙二醇和雙氯芬酸鈉的預混物(藥物負載層預混物)及聚己內酯和甘油三月桂酸酯的預混物(溫度響應層預混物),將藥物負載層預混物和溫度響應層預混物在真空烘箱中40℃干燥3小時。
第四步,將第三步得到的藥物負載層預混物和溫度響應層預混物分別投入在中國專利cn101439576a中公開的由擠出機a、b、匯流器c、層倍增器d構成的微層共擠裝置的桿擠出機a和擠出機b中(見圖1),調節擠出機a和擠出機b的轉速比為1:1,預混物經過擠出機的加料口、輸送段、熔融段、均化段進行熔融塑化,然后通過匯流器c而使兩股熔體疊合成初始結構,經過4個層倍增器的多次層狀疊合后通過冷卻牽引裝置成型,即可得到總層數為32層,其中藥物負載層(共16層)、溫度響應層(共16層)交替排列的寬80mm、厚1mm的復合材料(見圖2),其中藥物負載層和溫度響應層的層厚比為1:1。其中擠出機a、b的加料口、輸送段、熔融段、均化段、口模、匯流器、層倍增器的溫度分別為60℃、70℃、80℃、80℃、80℃、80℃、80℃。
采用上述藥物負載層配比按照上述步驟及參數干燥、高混機混合后投入上述微層共擠裝置中的單臺擠出機進行擠出,但不經過匯流器和層倍增器,通過與微層共擠裝置中相同的擠出口模進行冷卻成型,得到寬80mm、厚1mm的對比樣。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為60℃、70℃、80℃、80℃、80℃。
在上述制備方法中,如果未引入溫度響應層與藥物負載層交替疊加,僅在相同工藝下制備相同尺寸的藥物負載層作為對比樣材料在37℃的磷酸鹽緩沖液(pbs緩沖液)中浸泡24小時即釋放17.5%的藥物,顯示出明顯的突釋現象,在44℃的pbs緩沖液中浸泡24小時釋放20.2%的藥物,溫度變化無法使藥物釋放行為發生顯著改變,即對比樣材料不具備溫度響應藥物釋放行為。本實施例采用了疏水性小分子甘油三月桂酸酯作為溫度響應功能相,掃描電子顯微鏡測試(sem)結果顯示甘油三月桂酸酯在溫度響應層的基體聚己內酯中呈海島結構均勻分散,所得到溫敏性交替層狀藥物釋放復合材料在37℃的pbs緩沖液中浸泡24小時僅釋放0.8%的藥物,在人體溫度的釋藥行為進一步減緩,表明溫度響應層中僅僅加入10份甘油三月桂酯就能有效抑制藥物在人體溫度的突釋,得到的溫敏性交替層狀藥物釋放復合材料具有一定藥物初始釋藥量且該量可通過調控藥物負載層的形態結構進行調整,同時溫度響應層的溫度響應性能可通過對該層的形態結構設計進行調控;而當溫度升高到44℃時(甘油三月桂酯的熔點為45℃),聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料中的甘油三月桂酸酯部分熔融發生由固相向液相的轉變,使溫度響應層結構變得較為疏松,其在溫度響應層的基體聚己內酯中的分散形成水分子更易滲透的通道,使藥物負載層內部的藥物更易溶出,故而溫敏性交替層狀藥物釋放復合材料在44℃的pbs中浸泡24小時藥物的釋放量為10%,將溫敏性交替層狀藥物釋放復合材料依次在37℃和44℃時浸泡24小時,發現其在37℃藥物釋放量為0.9%,而在44℃藥物釋放量為9.8%,經過多次溫度變化周期(37℃和44℃交替浸泡,每個溫度各浸泡24小時)其釋放行為不變,即在37℃幾乎無藥物釋放(藥物釋放量為1%左右),而在44℃藥物釋放明顯(藥物釋放量為9-10%),顯示出明顯的溫度響應釋放行為。
同時對比樣材料在37℃和44℃的拉伸屈服強度分別為10.9mpa和9.2mpa,聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料在37℃和44℃的拉伸屈服強度分別為12.5mpa和10.6mpa,與對比樣材料相比,聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料的拉伸屈服強度有所提升,說明加入甘油三月桂酸酯后溫度響應層在37℃和44℃時能保持較好的力學強度,這是由于作為連續相的聚己內酯基體具有良好力學性能。因此本實施例所制備的溫敏性交替層狀藥物釋放復合材料能夠控制藥物的溫度響應釋放,并兼備優良的力學性能。
實施例2
一種聚己內酯(藥物負載層基體)-聚乙二醇(藥物負載層分散相)-雙氯芬酸鈉(藥物)/聚己內酯(溫度響應層基體)-甘油三月桂酸酯(溫度響應層溫度響應功能相)溫敏性交替層狀藥物釋放復合材料的原料包括以下組分及重量份含量:
藥物負載層組分配比重量份數
聚己內酯(為藥物負載層基體)80
聚乙二醇(為藥物負載層分散相)20
雙氯芬酸鈉(為藥物)10
溫度響應層組分配比重量份數
聚己內酯(為溫度響應層基體)85
甘油三月桂酸酯(為溫度響應層溫度響應功能相)15
說明:藥物負載層為高分子基藥物負載層的簡稱,溫度響應層為高分子基溫度響應層的簡稱。雙氯芬酸鈉(為藥物)的重量為藥物負載層基體和分散相總重量的10%。
第一步,首先按上述組分備料;
第二步,將上述物料置于40℃真空烘箱干燥12小時;
第三步,將第二步得到的干燥藥物負載層物料聚己內酯、聚乙二醇和雙氯芬酸鈉及溫度響應層物料聚己內酯和甘油三月桂酸酯分別置于高混機中預混合5分鐘,其轉速為100轉/分鐘,得到聚己內酯、聚乙二醇和雙氯芬酸鈉的預混物(藥物負載層預混物)及聚己內酯和甘油三月桂酸酯的預混物(溫度響應層預混物),將藥物負載層預混物和溫度響應層預混物在真空烘箱中40℃干燥3小時。
第四步,將第三步得到的藥物負載層預混物和溫度響應層預混物分別投入在中國專利cn101439576a中公開的由擠出機a、b、匯流器c、層倍增器d構成的微層共擠裝置的桿擠出機a和擠出機b中(見圖1),調節擠出機a和擠出機b的轉速比為1:1,預混物經過擠出機的加料口、輸送段、熔融段、均化段進行熔融塑化,然后通過匯流器c而使兩股熔體疊合成初始結構,經過4個層倍增器的多次層狀疊合后通過冷卻牽引裝置成型,即可得到總層數為32層,其中藥物負載層(共16層)、溫度響應層(共16層)交替排列的寬80mm、厚1mm的復合材料(見圖2),其中藥物負載層和溫度響應層的層厚比為1:1。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模、匯流器、層倍增器的溫度分別為60℃、70℃、80℃、80℃、80℃、80℃、80℃。
采用上述藥物負載層配比按照上述步驟及參數干燥、高混機混合后投入上述微層共擠裝置中的單臺擠出機進行擠出,但不經過匯流器和層倍增器,通過與微層共擠裝置中相同的擠出口模進行冷卻成型,得到寬80mm、厚1mm的對比樣。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模的加工溫度分別為60℃、70℃、80℃、80℃、80℃。
在上述制備方法中,如果未引入溫度響應層與藥物負載層交替疊加,僅在相同工藝下制備相同尺寸的藥物負載層作為對比樣材料在37℃的磷酸鹽緩沖液(pbs緩沖液)中浸泡24小時即釋放18%的藥物,顯示出明顯的突釋現象,在44℃的pbs緩沖液中浸泡24小時釋放21.4%的藥物,溫度變化無法使藥物釋放行為發生顯著改變,即對比樣材料不具備溫度響應藥物釋放行為。本實施例采用了疏水性小分子甘油三月桂酸酯作為溫度響應功能相,掃描電子顯微鏡測試(sem)結果顯示甘油三月桂酸酯在溫度響應層的基體聚己內酯中呈海島結構均勻分散,所得到溫敏性交替層狀藥物釋放復合材料在37℃的pbs緩沖液中浸泡24小時僅釋放0.7%的藥物,在人體溫度的釋藥行為進一步減緩,表明溫度響應層中僅僅加入15份甘油三月桂酯就能有效抑制藥物在人體溫度的突釋,得到的溫敏性交替層狀藥物釋放復合材料具有一定藥物初始釋藥量且該量可通過調控藥物負載層的形態結構進行調整,同時溫度響應層的溫度響應性能可通過對該層的形態結構設計進行調控;而當溫度升高到44℃時(甘油三月桂酯的熔點為45℃),聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料中的甘油三月桂酸酯部分熔融發生由固相向液相的轉變,使溫度響應層結構變得較為疏松,其在溫度響應層的基體聚己內酯中的分散形成水分子更易滲透的通道,使藥物負載層內部的藥物更易溶出,故而溫敏性交替層狀藥物釋放復合材料在44℃的pbs中浸泡24小時藥物的釋放量為12%,將溫敏性交替層狀藥物釋放復合材料依次在37℃和44℃時浸泡24小時,發現其在37℃藥物釋放量為0.8%,而在44℃藥物釋放量為12.7%,經過多次溫度變化周期(37℃和44℃交替浸泡,每個溫度各浸泡24小時)其釋放行為不變,即在37℃幾乎無藥物釋放(藥物釋放量為1%左右),而在44℃藥物釋放明顯(藥物釋放量為12-13%),顯示出明顯的溫度響應釋放行為。
同時對比樣材料在37℃和44℃的拉伸屈服強度分別為10mpa和8.6mpa,聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料在37℃和44℃的拉伸屈服強度分別為11.5mpa和9.6mpa,與對比樣材料相比,聚己內酯-聚乙二醇-雙氯芬酸鈉/聚己內酯-甘油三月桂酸酯復合材料的拉伸屈服強度有所提升,說明加入甘油三月桂酸酯后溫度響應層在37℃和44℃時能保持較好的力學強度,這是由于作為連續相的聚己內酯基體具有良好力學性能。因此本實施例所制備的溫敏性交替層狀藥物釋放復合材料能夠控制藥物的溫度響應釋放,并兼備優良的力學性能。
實施例3
一種聚丁二酸丁二醇酯(藥物負載層基體)-聚乙二醇(藥物負載層分散相)-酒石酸美托洛爾(藥物)/聚丁二酸丁二醇酯(溫度響應層基體)-甘油三硬脂酸酯(溫度響應層溫度響應功能相)溫敏性交替層狀藥物釋放復合材料的原料包括以下組分及重量份含量:
藥物負載層組分配比重量份數
聚丁二酸丁二醇酯(為藥物負載層基體)80
聚乙二醇(為藥物負載層分散相)20
酒石酸美托洛爾(為藥物)10
溫度響應層組分配比重量份數
聚丁二酸丁二醇酯(為溫度響應層基體)85
甘油三硬脂酸酯(為溫度響應層溫度響應功能相)15
說明:藥物負載層為高分子基藥物負載層的簡稱,溫度響應層為高分子基溫度響應層的簡稱。酒石酸美托洛爾(為藥物)的重量為藥物負載層基體和分散相總重量的10%。
第一步,首先按上述組分備料;
第二步,將聚丁二酸丁二醇酯和酒石酸美托洛爾置于60℃真空烘箱干燥12小時,將甘油三硬脂酸酯和聚乙二醇置于40℃真空烘箱干燥12小時;
第三步,將第二步得到的干燥藥物負載層物料聚丁二酸丁二醇酯、聚乙二醇和酒石酸美托洛爾及溫度響應層物料聚丁二酸丁二醇酯和甘油三硬脂酸酯分別置于高混機中預混合5分鐘,其轉速為120轉/分鐘,得到聚丁二酸丁二醇酯、聚乙二醇和酒石酸美托洛爾的預混物(藥物負載層預混物)及聚丁二酸丁二醇酯和甘油三硬脂酸酯的預混物(溫度響應層預混物),將藥物負載層預混物和溫度響應層預混物在真空烘箱中40℃干燥3小時。
第四步,將第三步得到的藥物負載層預混物和溫度響應層預混物分別投入在中國專利cn101439576a中公開的由擠出機a、b、匯流器c、層倍增器d構成的微層共擠裝置的桿擠出機a和擠出機b中(見圖1),調節擠出機a和擠出機b的轉速比為1:1,預混物經過擠出機的加料口、輸送段、熔融段、均化段進行熔融塑化,然后通過匯流器c而使兩股熔體疊合成初始結構,經過5個層倍增器的多次層狀疊合后通過冷卻牽引裝置成型,即可得到總層數為64層,其中藥物負載層(共32層)、溫度響應層(共32層)交替排列的寬40mm、厚1.8mm的復合材料(見圖2),其中藥物負載層和溫度響應層的層厚比為1:1。其中擠出機a、b的加料口、輸送段、熔融段、均化段、口模、匯流器、層倍增器的溫度分別為80℃、100℃、120℃、130℃、130℃、130℃、130℃。
采用上述藥物負載層配比按照上述步驟及參數干燥、高混機混合后投入上述微層共擠裝置中的單臺擠出機進行擠出,但不經過匯流器和層倍增器,通過與微層共擠裝置中相同的擠出口模進行冷卻成型,得到寬40mm、厚1.8mm的對比樣。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為80℃、100℃、120℃、130℃、130℃。
在上述制備方法中,如果未引入溫度響應層與藥物負載層交替疊加,僅在相同工藝下制備相同尺寸的藥物負載層作為對比樣材料在37℃的磷酸鹽緩沖液(pbs緩沖液)中浸泡24小時即釋放19.2%的藥物,顯示出明顯的突釋現象,在48℃的pbs緩沖液中浸泡24小時釋放23.2%的藥物,溫度變化無法使藥物釋放行為發生顯著改變,即對比樣材料不具備溫度響應藥物釋放行為。本實施例采用了疏水性小分子甘油三硬脂酸酯作為溫度響應功能相,掃描電子顯微鏡測試(sem)結果顯示甘油三硬脂酸酯在溫度響應層的基體聚丁二酸丁二醇酯中呈海島結構均勻分散,所得到溫敏性交替層狀藥物釋放復合材料在37℃的pbs緩沖液中浸泡24小時僅釋放0.9%的藥物,在人體溫度的釋藥行為進一步減緩,表明溫度響應層中僅僅加入15份甘油三硬脂酸酯就能有效抑制藥物在人體溫度的突釋,得到的溫敏性交替層狀藥物釋放復合材料具有一定藥物初始釋藥量且該量可通過調控藥物負載層的形態結構進行調整,同時溫度響應層的溫度響應性能可通過對該層的形態結構設計進行調控;而當溫度升高到48℃時(甘油三硬脂酸酯的熔點為50℃),聚丁二酸丁二醇酯-聚乙二醇-酒石酸美托洛爾/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料中的甘油三硬脂酸酯部分熔融發生由固相向液相的轉變,使溫度響應層結構變得較為疏松,其在溫度響應層的基體聚丁二酸丁二醇酯中的分散形成水分子更易滲透的通道,使藥物負載層內部的藥物更易溶出,故而溫敏性交替層狀藥物釋放復合材料在48℃的pbs中浸泡24小時藥物的釋放量為13.4%,將溫敏性交替層狀藥物釋放復合材料依次在37℃和48℃時浸泡24小時,發現其在37℃藥物釋放量為1.1%,而在48℃藥物釋放量為12.7%,經過多次溫度變化周期(37℃和48℃交替浸泡,每個溫度各浸泡24小時)其釋放行為不變,即在37℃幾乎無藥物釋放(藥物釋放量為1%左右),而在48℃藥物釋放明顯(藥物釋放量為12-13%),顯示出明顯的溫度響應釋放行為。
同時對比樣材料在37℃和48℃的拉伸屈服強度分別為12mpa和9.2mpa,聚丁二酸丁二醇酯-聚乙二醇-酒石酸美托洛爾/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料在37℃和48℃的拉伸屈服強度分別為14.3mpa和11.5mpa,與對比樣材料相比,聚丁二酸丁二醇酯-聚乙二醇-酒石酸美托洛爾/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料的拉伸屈服強度有所提升,說明加入甘油三硬脂酸酯后溫度響應層在37℃和48時能保持較好的力學強度,這是由于作為連續相的聚丁二酸丁二醇酯基體具有良好力學性能。因此本實施例所制備的溫敏性交替層狀藥物釋放復合材料能夠控制藥物的溫度響應釋放,并兼備優良的力學性能。
實施例4
一種聚乳酸(藥物負載層基體)-聚氧化乙烯(藥物負載層分散相)-尼莫地平(藥物)/聚丁二酸丁二醇酯(溫度響應層基體)-甘油三硬脂酸酯(溫度響應層溫度響應功能相)溫敏性交替層狀藥物釋放復合材料的原料包括以下組分及重量份含量:
藥物負載層組分配比重量份數
聚乳酸(為藥物負載層基體)80
聚氧化乙烯(為藥物負載層分散相)20
尼莫地平(為藥物)10
溫度響應層組分配比重量份數
聚丁二酸丁二醇酯(為溫度響應層基體)90
甘油三硬脂酸酯(為溫度響應層溫度響應功能相)10
說明:藥物負載層為高分子基藥物負載層的簡稱,溫度響應層為高分子基溫度響應層的簡稱。尼莫地平(為藥物)的重量為藥物負載層基體和分散相總重量的10%。
第一步,首先按上述組分備料;
第二步,將聚乳酸、聚丁二酸丁二醇酯、聚氧化乙烯和尼莫地平置于60℃真空烘箱干燥12小時,將甘油三硬脂酸酯置于40℃真空烘箱干燥12小時;
第三步,將第二步得到的干燥藥物負載層物料聚乳酸、聚氧化乙烯和尼莫地平及溫度響應層物料聚丁二酸丁二醇酯和甘油三硬脂酸酯分別置于高混機中預混合5分鐘,其轉速為130轉/分鐘,得到聚乳酸、聚氧化乙烯和尼莫地平的預混物(藥物負載層預混物)及聚丁二酸丁二醇酯和甘油三硬脂酸酯的預混物(溫度響應層預混物),將藥物負載層預混物和溫度響應層預混物在真空烘箱中40℃干燥3小時。
第四步,將第三步得到的藥物負載層預混物和溫度響應層預混物分別投入在中國專利cn101439576a中公開的由擠出機a、b、匯流器c、層倍增器d構成的微層共擠裝置的桿擠出機a和擠出機b中(見圖1),調節擠出機a和擠出機b的轉速比為1:1,預混物經過擠出機的加料口、輸送段、熔融段、均化段進行熔融塑化,然后通過匯流器c而使兩股熔體疊合成初始結構,經過6個層倍增器的多次層狀疊合后通過冷卻牽引裝置成型,即可得到總層數為128層,其中藥物負載層(共64層)、溫度響應層(共64層)交替排列的寬40mm、厚1.8mm的復合材料(見圖2),其中藥物負載層和溫度響應層的層厚比為1:1。其中藥物負載層擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為130℃、150℃、180℃、180℃、180℃;溫度響應層擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為80℃、100℃、120℃、130℃、130℃;匯流器、層倍增器的溫度分別為180℃、180℃。
采用上述藥物負載層配比按照上述步驟及參數干燥、高混機混合后投入上述微層共擠裝置中的單臺擠出機進行擠出,但不經過匯流器和層倍增器,通過與微層共擠裝置中相同的擠出口模進行冷卻成型,得到寬40mm、厚1.8mm的對比樣。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為130℃、150℃、180℃、180℃、180℃。
在上述制備方法中,如果未引入溫度響應層與藥物負載層交替疊加,僅在相同工藝下制備相同尺寸的藥物負載層作為對比樣材料在37℃的磷酸鹽緩沖液(pbs緩沖液)中浸泡24小時即釋放14%的藥物,顯示出明顯的突釋現象,在48℃的pbs緩沖液中浸泡24小時釋放19.8%的藥物,溫度變化無法使藥物釋放行為發生顯著改變,即對比樣材料不具備溫度響應藥物釋放行為。本實施例采用了疏水性小分子甘油三硬脂酸酯作為溫度響應功能相,掃描電子顯微鏡測試(sem)結果顯示甘油三硬脂酸酯在溫度響應層的基體聚丁二酸丁二醇酯中呈海島結構均勻分散,所得到溫敏性交替層狀藥物釋放復合材料在37℃的pbs緩沖液中浸泡24小時僅釋放0.9%的藥物,在人體溫度的釋藥行為進一步減緩,表明溫度響應層中僅僅加入10份甘油三硬脂酸酯就能有效抑制藥物在人體溫度的突釋,得到的溫敏性交替層狀藥物釋放復合材料具有一定藥物初始釋藥量且該量可通過調控藥物負載層的形態結構進行調整,同時溫度響應層的溫度響應性能可通過對該層的形態結構設計進行調控;而當溫度升高到48℃時(甘油三硬脂酸酯的熔點為50℃),聚乳酸-聚氧化乙烯-尼莫地平/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料中的甘油三硬脂酸酯部分熔融發生由固相向液相的轉變,使溫度響應層結構變得較為疏松,其在溫度響應層的基體聚丁二酸丁二醇酯中的分散形成水分子更易滲透的通道,使藥物負載層內部的藥物更易溶出,故而溫敏性交替層狀藥物釋放復合材料在48℃的pbs中浸泡24小時藥物的釋放量為10.2%,將溫敏性交替層狀藥物釋放復合材料依次在37℃和48℃時浸泡24小時,發現其在37℃藥物釋放量為0.8%,而在48℃藥物釋放量為10%,經過多次溫度變化周期(37℃和48℃交替浸泡,每個溫度各浸泡24小時)其釋放行為不變,即在37℃幾乎無藥物釋放(藥物釋放量為1%左右),而在48℃藥物釋放明顯(藥物釋放量為9-10%),顯示出明顯的溫度響應釋放行為。
同時對比樣材料在37℃和48℃的拉伸屈服強度分別為18.7mpa和12.2mpa,聚乳酸-聚氧化乙烯-尼莫地平/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料在37℃和48℃的拉伸屈服強度分別為20.5mpa和13.6mpa,與對比樣材料相比,聚乳酸-聚氧化乙烯-尼莫地平/聚丁二酸丁二醇酯-甘油三硬脂酸酯復合材料的拉伸屈服強度有所提升,說明加入甘油三硬脂酸酯后溫度響應層在37℃和48℃時能保持較好的力學強度,這是由于作為連續相的聚丁二酸丁二醇酯基體具有良好力學性能。因此本實施例所制備的溫敏性交替層狀藥物釋放復合材料能夠控制藥物的溫度響應釋放,并兼備優良的力學性能。
實施例5
一種乙基纖維素(藥物負載層基體)-聚氧化乙烯(藥物負載層分散相)-頭孢氨芐(藥物)/乙基纖維素(溫度響應層基體)-月桂酸(溫度響應層溫度響應功能相)溫敏性交替層狀藥物釋放復合材料的原料包括以下組分及重量份含量:
藥物負載層組分配比重量份數
乙基纖維素(為藥物負載層基體)80
聚氧化乙烯(為藥物負載層分散相)20
頭孢氨芐(為藥物)5
溫度響應層組分配比重量份數
乙基纖維素(為溫度響應層基體)90
月桂酸(為溫度響應層溫度響應功能相)10
說明:藥物負載層為高分子基藥物負載層的簡稱,溫度響應層為高分子基溫度響應層的簡稱。頭孢氨芐(為藥物)的重量為藥物負載層基體和分散相總重量的5%。
第一步,首先按上述組分備料;
第二步,將乙基纖維素、聚氧化乙烯和頭孢氨芐置于60℃真空烘箱干燥12小時,將月桂酸置于35℃真空烘箱干燥12小時;
第三步,將第二步得到的干燥藥物負載層物料乙基纖維素、聚氧化乙烯和頭孢氨芐及溫度響應層物料乙基纖維素和月桂酸分別置于高混機中預混合5分鐘,其轉速為100轉/分鐘,得到乙基纖維素、聚氧化乙烯和頭孢氨芐的預混物(藥物負載層預混物)及乙基纖維素和月桂酸的預混物(溫度響應層預混物),將藥物負載層預混物和溫度響應層預混物在真空烘箱中35℃干燥3小時。
第四步,將第三步得到的藥物負載層預混物和溫度響應層預混物分別投入在中國專利cn101439576a中公開的由擠出機a、b、匯流器c、層倍增器d構成的微層共擠裝置的桿擠出機a和擠出機b中(見圖1),調節擠出機a和擠出機b的轉速比為1:1,預混物經過擠出機的加料口、輸送段、熔融段、均化段進行熔融塑化,然后通過匯流器c而使兩股熔體疊合成初始結構,經過6個層倍增器的多次層狀疊合后通過冷卻牽引裝置成型,即可得到總層數為128層,其中藥物負載層(共64層)、溫度響應層(共64層)交替排列的寬40mm、厚1.8mm的復合材料(見圖2),其中藥物負載層和溫度響應層的層厚比為1:1。其中擠出機a、b的加料口、輸送段、熔融段、均化段、口模、匯流器、層倍增器的溫度分別為120℃、150℃、170℃、180℃、180℃、180℃、180℃。
采用上述藥物負載層配比按照上述步驟及參數干燥、高混機混合后投入上述微層共擠裝置中的單臺擠出機進行擠出,但不經過匯流器和層倍增器,通過與微層共擠裝置中相同的擠出口模進行冷卻成型,得到寬40mm、厚1.8mm的對比樣。其中單個擠出機的加料口、輸送段、熔融段、均化段、口模的溫度分別為120℃、150℃、170℃、180℃、180℃。
在上述制備方法中,如果未引入溫度響應層與藥物負載層交替疊加,僅在相同工藝下制備相同尺寸的藥物負載層作為對比樣材料在37℃的磷酸鹽緩沖液(pbs緩沖液)中浸泡24小時即釋放17.8%的藥物,顯示出明顯的突釋現象,在42℃的pbs緩沖液中浸泡24小時釋放22.1%的藥物,溫度變化無法使藥物釋放行為發生顯著改變,即對比樣材料不具備溫度響應藥物釋放行為。本實施例采用了疏水性小分子月桂酸作為溫度響應功能相,掃描電子顯微鏡測試(sem)結果顯示月桂酸在溫度響應層的基體乙基纖維素中呈海島結構均勻分散,所得到溫敏性交替層狀藥物釋放復合材料在37℃的pbs緩沖液中浸泡24小時僅釋放0.7%的藥物,在人體溫度的釋藥行為進一步減緩,表明溫度響應層中僅僅加入10份月桂酸就能有效抑制藥物在人體溫度的突釋,得到的溫敏性交替層狀藥物釋放復合材料具有一定藥物初始釋藥量且該量可通過調控藥物負載層的形態結構進行調整,同時溫度響應層的溫度響應性能可通過對該層的形態結構設計進行調控;而當溫度升高到42℃時(月桂酸的熔點為44℃),乙基纖維素-聚氧化乙烯-頭孢氨芐/乙基纖維素-月桂酸復合材料中的月桂酸部分熔融發生由固相向液相的轉變,使溫度響應層結構變得較為疏松,其在溫度響應層的基體乙基纖維素中的分散形成水分子更易滲透的通道,使藥物負載層內部的藥物更易溶出,故而溫敏性交替層狀藥物釋放復合材料在42℃的pbs中浸泡24小時藥物的釋放量為16%,將溫敏性交替層狀藥物釋放復合材料依次在37℃和42℃時浸泡24小時,發現其在37℃藥物釋放量為0.9%,而在42℃藥物釋放量為15.3%,經過多次溫度變化周期(37℃和42℃交替浸泡,每個溫度各浸泡24小時)其釋放行為不變,即在37℃幾乎無藥物釋放(藥物釋放量為1%左右),而在42℃藥物釋放明顯(藥物釋放量為15-16%),顯示出明顯的溫度響應釋放行為。
同時對比樣材料在37℃和42℃的拉伸屈服強度分別為17mpa和11.2mpa,乙基纖維素-聚氧化乙烯-頭孢氨芐/乙基纖維素-月桂酸復合材料在37℃和42℃的拉伸屈服強度分別為19.2mpa和13.8mpa,與對比樣材料相比,乙基纖維素-聚氧化乙烯-頭孢氨芐/乙基纖維素-月桂酸復合材料的拉伸屈服強度有所提升,說明加入月桂酸后溫度響應層在37℃和42℃時能保持較好的力學強度,這是由于作為連續相的乙基纖維素基體具有良好力學性能。因此本實施例所制備的溫敏性交替層狀藥物釋放復合材料能夠控制藥物的溫度響應釋放,并兼備優良的力學性能。
- 還沒有人留言評論。精彩留言會獲得點贊!