DNA四面體納米遞送材料及其制備方法與應用
本發明屬于核酸納米材料領域,涉及dna四面體納米遞送材料及其制備方法與應用。
背景技術:
1、dna為人體內的天然組分,短鏈dna無免疫原性和潛在毒性,且易于被生物降解,同時根據dna堿基互補配對原則,dna納米材料可實現很好的可編程性,可在納米尺度精確控制藥物的負載量和空間排布,同時具有實現靶向性治療的潛力。因此,自組裝dna納米材料在疾病治療中有著巨大的應用前景。
2、隨著生物納米技術的迅速發展,核酸納米材料因其獨特的結構特性和優良的生物相容性,被廣泛應用于靶向藥物傳遞、基因治療和生物成像等領域。目前,dna納米材料的制備主要依賴于鎂離子(mg2+)介導的自組裝方法。該方法通過中和dna分子的負電荷,促進堿基互補配對,從而形成納米結構。dna四面體作為一種經典的dna納米結構,已在藥物遞送、腫瘤治療和生物檢測中展現出廣闊的應用前景。
3、cn116920108a發明公開了一種dna四面體藥物,其dna四面體藥物可通過梯度退火程序合成,制備方法簡單,dna四面體材料在生理條件下血清穩定性較強,此外,其dna四面體細胞攝取效率相對較高。相對簡單的合成過程和dna四面體納米材料在體內的穩定性使其具有良好的應用前景。盡管現有鎂離子介導的自組裝方法取得了一定進展,但仍存在以下顯著缺陷:
4、生物相容性差:高濃度鎂離子對細胞具有一定的毒性作用,可能干擾細胞內酶的活性并引發應激反應,不利于生物醫學應用。
5、結構穩定性差:鎂離子介導的dna納米材料在血清環境中易降解,導致材料穩定性和功能持久性不足。
6、細胞攝取效率低:dna納米材料帶有較強的負電荷,限制了其被細胞有效攝取,通常需要借助轉染試劑或載體來提高內吞效率。
7、制備條件苛刻:鎂離子介導的自組裝對離子濃度和反應條件敏感,導致材料批次間穩定性和一致性較差,制備工藝復雜。
8、dna在生物體內難以持續保持穩定(內質網清除系統,肝腎代謝)足夠時間以保證藥物發揮作用。如何構建復合功能化dna納米材料,在充分發揮dna可設計編程等優異特質的同時,使之適用于生物醫學應用,是dna納米材料應用轉化的關鍵。
9、當前全球范圍內急性肺損傷(ali)和急性呼吸窘迫綜合征(ards)的發病率和死亡率仍居高不下,尚缺乏有效的治療手段。臨床上亟需一種生物相容性好、靶向性強、治療效果顯著的納米制劑來改善疾病預后。此外,隨著基因治療和精準醫療的快速發展,市場對于高效、安全的核酸藥物遞送系統需求日益增長,尤其是針對炎癥性疾病的靶向治療產品。
技術實現思路
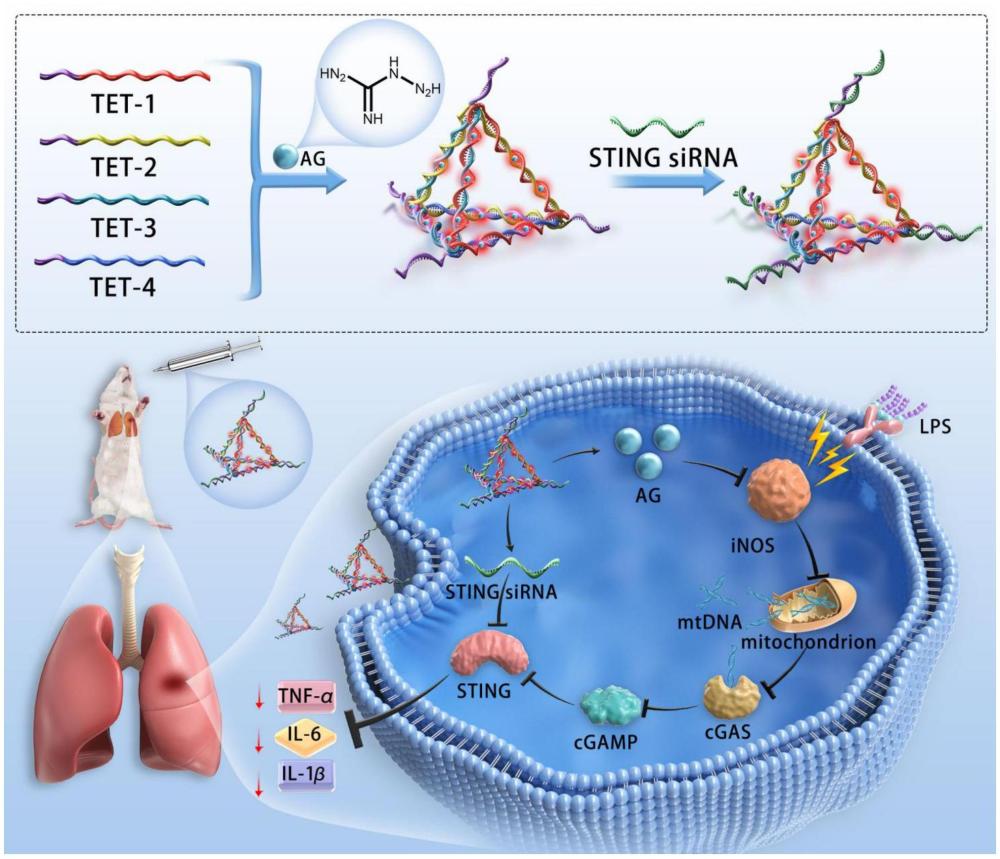
1、有鑒于此,本發明的目的在于提供一種dna四面體納米遞送材料,由四條dna單鏈分子在氨基胍介導下自組裝而成,每條dna單鏈有三分之一的序列與其它3條單鏈的堿基互補配對形成四面體的一個單面,而4個單面最后形成一個完整的dna四面體。四面體的4個頂點是4個功能位點,通過堿基互補配對攜帶sirna,此dna四面體結構可靶向遞送4個sirna的dna納米粒子,并由氨基胍代替鎂離子作為介導核酸納米材料的自組裝。本發明的目的之二在于提供了dna四面體納米遞送材料的制備方法,在氨基胍水溶液的介導下,dna四面體可以實現梯度或恒溫退火自組裝。本發明的目的之三在于利用dna四面體納米遞送材料在制備藥物制劑中的應用,特別應用于治療急性肺損傷(ali)或急性呼吸窘迫綜合征(ards)的納米制劑中的應用。
2、為達到上述目的,本發明提供如下技術方案:
3、本發明提供一種dna四面體納米遞送材料,所述dna四面體由四條dna單鏈tet-1、tet-2、tet-3、tet-4堿基互補配對形成,所述四條dna單鏈的5’端與單鏈sirna互補配對,所述四條dna單鏈與sirna在氨基胍水溶液中自組裝形成所述dna四面體納米遞送材料,
4、所述tet-1的核苷酸序列如seq?id?no:1所示、tet-2的核苷酸序列如seq?id?no:2所示、tet-3的核苷酸序列如seq?id?no:3所示、tet-4的核苷酸序列如seq?id?no:4所示,所述sirna為sting?sirna,核苷酸序列如seq?id?no:5所示;
5、所述sirna、tet-1、tet-2、tet-3、tet-4的摩爾比為4:1:1:1:1;
6、進一步,dna四面體納米遞送材料的制備方法,其步驟如下:
7、s1:制備tet-1、tet-2、tet-3、tet-4水溶液;
8、s2:取tet-1、tet-2、tet-3、tet-4水溶液按照1:1:1:1摩爾濃度比例在氨基胍水溶液中分別互補配對,dna四面體在梯度退火或/和恒溫退火程序下合成,得到dna四面體溶液,
9、s3:將sirna溶液添加到步驟s2中的dna四面體溶液中,在37℃條件下共孵育30min,得到所述dna四面體納米材料溶液;
10、所述步驟s2中,所述的梯度退火為95℃放置5min,65℃放置30min,50℃放置30min,37℃放置30min,然后22℃放置30min;
11、所述步驟s2中,所述的恒溫退火程序為37℃或者45℃任一溫度,恒溫下放置30~90min,將dna溶液混合,再在同一恒溫下放置30~90min;
12、所述步驟s2中,所述氨基胍水溶液的ph值為5.0-9.0;
13、所述步驟s2中,所述氨基胍水溶液濃度為50mm;
14、進一步,dna四面體納米遞送材料在制備藥物制劑中的應用;
15、所述dna四面體納米遞送材料在制備用于治療急性肺損傷(ali)或急性呼吸窘迫綜合征(ards)的納米藥物制劑中的應用。
16、本發明的有益效果在于:
17、氨基胍介導的納米材料自組裝具有以下優點:1)可以在恒溫下介導核酸納米材料的自組裝,從而使得合成方法更加簡單。2)其可以在不借助轉染劑的輔助,使得細胞有所攝取,并且細胞攝取率與轉染劑輔助傳統鎂離子介導自組裝核酸納米材料的攝取率相當。3)氨基胍介導自組裝的核酸納米材料可以穩定的存在于生理條件下的體系中,使其應用于臨床的可能性大大提高。4)氨基胍介導自組裝的核酸納米材料可以在穩定存在與血清中更長時間,從而保證在到達靶細胞之前不被降解,更好地發揮效應。5)從而可以更安全以及有效地發揮效能。
18、載有sting-sirna的dna四面體納米遞送材料進入細胞后在dna酶的作用下會降解并同時釋放出氨基胍和sting-sirna。氨基胍通過抑制inos減少損傷線粒體釋放mtdna進而抑制cgas-sting通路,與sting-sirna共同抑制sting的轉錄及表達,減少炎癥因子釋放,有效緩解急性肺損傷時肺部炎癥狀況。
19、本發明的其他優點、目標和特征在某種程度上將在隨后的說明書中進行闡述,并且在某種程度上,基于對下文的考察研究對本領域技術人員而言將是顯而易見的,或者可以從本發明的實踐中得到教導。本發明的目標和其他優點可以通過下面的說明書來實現和獲得。
- 還沒有人留言評論。精彩留言會獲得點贊!