一種藥物組合物及其應用的制作方法
本發明涉及腫瘤藥物研究領域,尤其涉及一種藥物組合物及其應用。
背景技術:
腫瘤是機體在各種致瘤因素作用下,局部組織的細胞在基因水平上失去對其生長的正常調控導致異常增生與分化而形成的新生物。新生物一旦形成,不因病因消除而停止生長,他的生長不受正常機體生理調節,而是破壞正常組織與器官,這一點在惡性腫瘤尤其明顯。與良性腫瘤相比,惡性腫瘤生長速度快,呈浸潤性生長,易發生出血、壞死、潰瘍等,并常有遠處轉移,造成人體消瘦、無力、貧血、食欲不振、發熱以及嚴重的臟器功能受損等,最終造成患者死亡。
腎癌是一種嚴重危害人類健康的惡性疾病遙大多數晚期腎癌對放化療不敏感袁且預后較差,細胞免疫治療對腫瘤的生物治療取得了良好效果并逐漸成為腫瘤治療的重要手段之一。近年細胞因子誘導的殺傷細胞(cytokine induced killer,CIK)的免疫功能得到廣泛研究,CIK細胞作為一種新型的廣譜抗腫瘤免疫細胞,不僅具有強大的廣譜抗腫瘤效應,而且可以調節增強腫瘤患者的免疫功能。
程序性死亡受體1(Programmed Death-1;PD-1),是一種重要的免疫抑制分子,為CD28超家族成員,其最初是從凋亡的小鼠T細胞雜交瘤2B4.11克隆出來。PD-1主要是在激活的T細胞和B細胞中表達,具有抑制細胞激活的功能,這是免疫系統中一種正常的自穩機制,因為過度的T/B細胞激活會引起自身免疫疾病,所以PD-1相當于人體內的一道護欄。
CN 105326893 A公開了一種抗癌組合物及其制劑。該組合物包括DC-CIK細胞和康艾注射液。該發明將DC-CIK細胞與康艾注射液聯合使用時,在藥物用量減少的情況下效果更好,可有效治療癌癥。該抗癌組合物針對性不強,也沒有有力的證據可以證明其對癌癥有顯著的治療效果。
CN 105744955 A公開了包含抗CEACAM1抗體的組合物、包含能夠抑制或阻斷PD-1和其配體之間相互作用的抗體的組合物,以及在治療癌癥中所述組合物組合使用的方法。該發明將PD-1抗體單獨施用或與別的抗體結合,其針對性不強,也沒有有力的證據證明其對癌癥有明顯的治療效果。
技術實現要素:
針對目前存在的問題,本發明提供一種藥物組合物及其應用,所述藥物組合物包括PD-1抗體和非特異性擴增激活T細胞,該藥物組合物對腎癌有明顯的治療效果,按RESIST標準評價均達到PR(部分緩解)或接近CR(完全緩解),有效率達100%,而副作用都十分微小,無3或4級不良反應發生。
為達此目的,本發明采用以下技術方案:
一方面,本發明提供一種藥物組合物,所述組合物包括PD-1抗體和非特異性擴增激活T細胞。
本發明中,非特異性擴增激活T細胞指的是CD8+T、CD4+T經過擴增激活后,獲得的一類具有廣譜殺傷功能的CD8CD4混合T淋巴細胞群,由患者外周血中的T淋巴細胞經多種細胞因子活化擴增而成,具有正向免疫調節作用,如它們能分泌多種細胞因子如IFN-γ、IL-2等,還能抑制免疫抑制細胞如MDSC等,非特異性擴增激活T細胞回輸到患者體內后,它們能進入腫瘤組織中。在腫瘤組織的微環境中,它們發揮免疫調控的作用,通過分泌的IFN-γ等細胞因子誘導腫瘤細胞表達PD-1的配體PD-L1,并抑制腫瘤微環境中的免疫抑制細胞,發揮免疫調控作用。PD-1抗體主要通過阻斷腫瘤組織中T淋巴細胞上的PD-1分子與PD-L1結合,重新活化T淋巴細胞對腫瘤細胞的殺傷。但由于腫瘤微環境中免疫抑制因素如MDSC及Treg等細胞的存在,減低了PD-1抗體對T淋巴細胞的再活化作用。非特異性擴增激活T細胞能抑制腫瘤微環境的免疫抑制細胞,因而能增強PD-1抗體的作用。
根據本發明,所述PD-1抗體為從商業途徑可以購買得到的PD-1抗體都是可行的,不同購買途徑的PD-1抗體不會對本申請的藥物組合物的藥效造成影響,本申請的PD-1抗體購買自Keytruda,PD-1抗體為美國FDA已批復的處方藥,所述PD-1抗體的濃度為1-10mg/kg,例如可以是1mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg或10mg/kg,優選為1-5mg/kg,進一步優選為2mg/kg,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
根據本發明,所述非特異性擴增激活T細胞的數量為(3-12)×109個,例如可以是3×109個、3.1×109個、3.2×109個、3.3×109個、3.5×109個、3.8×109個、4×109個、4.2×109個、4.5×109個、4.8×109個、5×109個、5.3×109個、5.5×109個、5.8×109個、5.83×109個、6×109個、6.5×109個、7×109個、7.5×109個、8×109個、8.5×109個、9×109個、9.5×109個、10×109個、10.5×109個、11×109個、11.5×109個或12×109個,優選為(6-10)×109個,進一步優選為5.83×109個,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,所述非特異性擴增激活T細胞的制備方法包括如下步驟:
(1)抽取患者外周血,離心;
(2)離心后的上層血漿放入4℃冰箱中保存,用生理鹽水稀釋下層血細胞,稀釋后的血細胞加至淋巴細胞細胞分離液上層,離心;
(3)離心后提取單個核細胞,用生理鹽水洗滌,進行細胞計數;
(4)細胞計數后接種在包被過重組人纖粘連蛋白(RetroNectin)、CD3單抗和PBS的培養瓶內,加入完全培養液50-60mL,放入5%CO2培養箱中,37℃進行非特異性擴增激活T細胞的培養;
(5)隔日顯微鏡下觀察,根據細胞狀態和數量補充完全培養基;
(6)10-20d,優選14d后非特異性擴增激活T細胞成熟,用生理鹽水洗滌,重懸后低速離心,棄上清,用含有20%白蛋白的生理鹽水重懸細胞。
本發明中,研究發現在淋巴細胞培養體系中加入RetroNectin,促使細胞由G1期進入S期,可以使細胞獲得上萬倍的細胞增值率。RetroNectin與CD3單抗聯合包被,Retronectin參與細胞的附著、伸展、分化和增殖的同時,也增加了CD3單抗與非特異性擴增激活T細胞的接觸、附著,即增加了CD3單抗的作用,進一步提高了非特異性擴增激活T細胞的擴增培養效率。
優選地,步驟(1)所述離心的條件為500-1000g,4℃離心10-20min,優選為800g、4℃離心15min。
所述離心的轉速為500-1000g,例如可以是500g、550g、600g、650g、700g、750g、800g、850g、900g、950g或1000g,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述離心的時間為10-20min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,步驟(2)所述的生理鹽水和血細胞的體積比為(1-3):1,例如可以是1:1、2:1或3:1,優選為1:1,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,步驟(2)所述離心的條件為500-1000g,16-23℃離心10-20min,優選為800g、20℃離心17min,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述離心的轉速為500-1000g,例如可以是500g、550g、600g、650g、700g、750g、800g、850g、900g、950g或1000g,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述離心的溫度為16-23℃,例如可以是16℃、17℃、18℃、19℃、20℃、21℃、22℃或23℃,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述離心的時間為10-20min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,步驟(3)所述洗滌的次數為1-5遍,例如可以是1遍、2遍、3遍、4遍或5遍,優選為2-3遍,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,步驟(4)所述細胞計數后將細胞進行CD4和CD8磁珠分選,并將獲得的CD4+T細胞和CD8+T細胞進行混合。
優選地,所述CD4+T細胞和CD8+T細胞的細胞數量比為1:1。
本發明中,CD8+T即細胞毒性T細胞(Tc)可通過顆粒酶、細胞毒性細胞因子的釋放及Fas途徑實現對靶細胞的殺傷;CD4+T即輔助性T細胞(Th)可分泌大量細胞因子以維護Tc細胞的免疫應答。這兩種效應細胞相互協調是有效維持獲得性免疫所必需的,所以非特異性擴增激活T細胞相較于單純CD8+T或者CIK在體內發生殺傷的效率更高,持續時間也更久。
優選地,步驟(4)所述的完全培養基為無血清培養基中加入800-1200IU/mL IL-2、800-1200IU/mL IFN-γ、100-200IU/mL慶大霉素、50-150IU/mL IL-1α和1-8%自體血漿,優選為1000IU/mL IL-2、1000IU/mL IFN-γ、160IU/mL慶大霉素、100IU/mL IL-1α和5%自體血漿。
所述IL-2的濃度為800IU/mL、850IU/mL、900IU/mL、950IU/mL、1000IU/mL、1050IU/mL、1100IU/mL、1150IU/mL或1200IU/mL,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述IFN-γ的濃度為800IU/mL、850IU/mL、900IU/mL、950IU/mL、1000IU/mL、1050IU/mL、1100IU/mL、1150IU/mL或1200IU/mL,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述慶大霉素的濃度為100IU/mL、120IU/mL、130IU/mL、140IU/mL、150IU/mL、160IU/mL、180IU/mL、190IU/mL或200IU/mL,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述IL-1α的濃度為50IU/mL、60IU/mL、70IU/mL、80IU/mL、90IU/mL、100IU/mL、110IU/mL、120IU/mL、130IU/mL、140IU/mL或150IU/mL,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述自體血漿的質量分數為1%、2%、3%、4%、5%、6%、7%或8%,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,步驟(6)所述的洗滌后進行離心,離心的條件為100-500g,4℃離心5-16min,優選為300g、4℃離心8min。
所述離心的轉速為100-500g,例如可以是100g、150g、200g、250g、300g、350g、400g、450g、500g、550g或600g,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
所述離心的時間為5-16min,例如可以是5min、6min、7min、8min、9min、10min、11min、12min、13min、14min、15min或16min,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
優選地,所述非特異性擴增激活T細胞的制備方法包括如下步驟:
(1)抽取病人外周血50mL(肝素鈉抗凝),分裝在兩個50mL的離心管內800g、4℃離心15min;
(2)離心后抽取上層血漿于50mL離心管中放于4℃冰箱中保存;
(3)將離心管中的血細胞與生理鹽水1:1稀釋,緩慢加至淋巴細胞細胞分離液上層,800G、20℃離心17min;
(4)離心后提取單個核細胞(即白膜層)置于50mL離心管內,加入生理鹽水洗滌,300G、4℃離心8min,洗2遍;
(5)細胞計數后將細胞進行CD4和CD8磁珠分選,并將獲得的CD4+T細胞和CD8+T細胞按細胞數量比1:1進行混合,細胞接種在包被過RetroNectin60μL/瓶、CD3單抗15μL/瓶、PBS 10mL/瓶的培養瓶內,加入完全培養液50-60mL,所述完全培養基為無血清培養液中加入IL-2為1000IU/mL,IFN-γ為1000IU/mL,慶大霉素為160IU/mL,IL-1α為50-150IU/mL,5%自體血漿,放入5%CO2培養箱中,37℃進行非特異性擴增激活T細胞的培養。
(6)隔日顯微鏡下觀察,根據細胞狀態和數量適量補充完全培養基;
(7)14d左右非特異性擴增激活T細胞成熟,提前進行質控檢測,合格后結合醫囑回收細胞,用生理鹽水洗3遍,重懸后低速離心、棄上清,用適量含有20%白蛋白的生理鹽水重懸細胞
第二方面,本發明提供如第一方面所述的藥物組合物在制備抗腫瘤藥物中的應用。
優選地,所述腫瘤為肺癌、乳腺癌、腎癌或肝癌中的任意一種或至少兩種的組合,優選為腎癌。
優選地,所述抗腫瘤藥物還包括藥學上接受的輔料。
優選地,所述輔料為賦形劑、稀釋劑、載體、調味劑、粘合劑和填充劑中的任意一種或至少兩種的組合。
第三方面,本發明提供一種檢測如第一方面所述的藥物組合物對腎癌細胞抑制作用的方法,包括如下步驟:
通過將如第一方面所述的藥物組合物移植到患有腎癌的模型生物體內,檢測模型生物體內腎癌腫瘤組織塊來判斷藥物組合物對腎癌細胞的抑制作用。
本發明中,所述模型用于非治療目的的檢測藥物組合物對腎癌細胞抑制作用,通過將藥物組合物移植到患有腎癌的免疫缺陷小鼠體內,構建可有效模擬腎癌病人體內病理微環境的人源化小鼠模型,并在該模型中模擬臨床治療模型多次移植藥物組合物,確保藥物組合物的穩定供給,通過腫瘤監控評估藥物組合物對腎癌的治療作用。
優選地,所述藥物組合物轉移的頻率為2-5周一次,例如可以是2周一次、3周一次、4周一次或5周一次,優選為3周一次,以及上述數值之間的具體點值,限于篇幅及出于簡明的考慮,本發明不再窮盡列舉所述范圍包括的具體點值。
根據本發明,所述模型生物體為本領域常規的模型生物,本發明模型生物可以選自兔、鼠、貓、狗或猴中的任意一種模型生物,優選為免疫缺陷小鼠模型。
優選地,所述檢測的方式為量取腎癌腫瘤組織塊大小、稱量腎癌腫瘤組織塊重量、熒光素酶-活體成像技術或流式細胞儀和免疫組化技術中的任意一種或至少兩種的組合。
根據本發明,所述量取肝癌腫瘤組織塊大小、稱量肝癌腫瘤組織塊重量的方式、熒光素酶-活體成像技術或流式細胞儀和免疫組化技術為本領域常規的量取方法,本領域技術人員可以根據實際需要進行選擇,在此不做特殊限定。
第四方面,本發明提供如第三方面所述的方法在評估藥物組合物對腎癌細胞抑制效果中的應用。
與現有技術相比,本發明具有如下有益效果:
(1)本發明藥物組合物包括PD-1抗體和非特異性擴增激活T細胞,兩種組分協同作用,能夠明顯抑制腎癌細胞的生長,并對腎癌細胞具有殺傷作用;
(2)本發明藥物組合物對腎癌有明顯的治療效果,按RESIST標準評價均達到PR(部分緩解)或接近CR(完全緩解),有效率達100%,而副作用都十分微小,無3或4級不良反應發生。
附圖說明
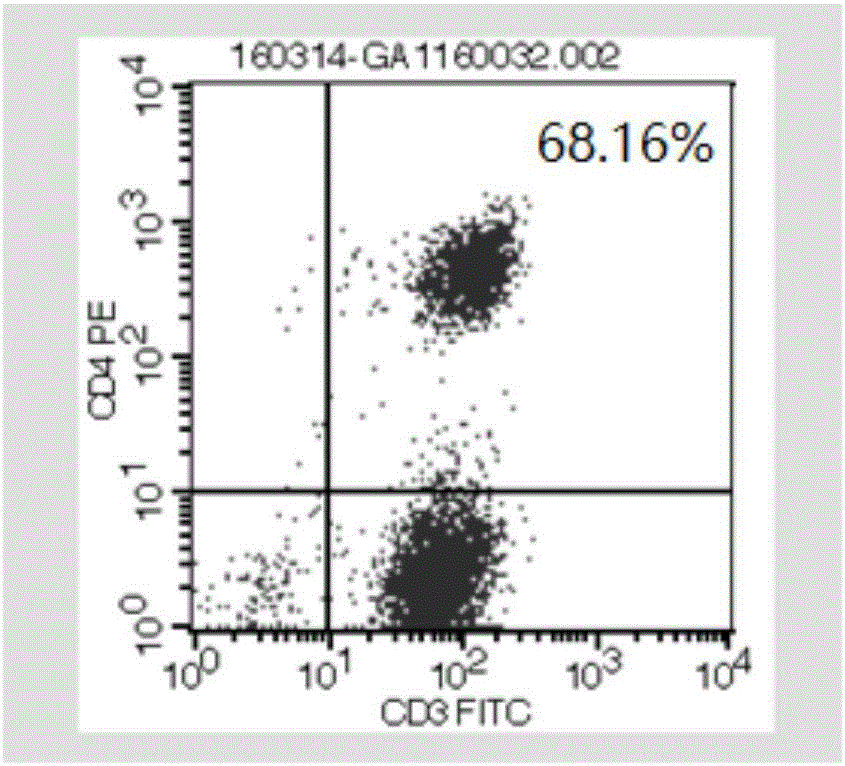
圖1為成熟的非特異性擴增激活T細胞的流式細胞儀檢測結果,其中,圖1(A)為CD3+CD4+細胞的結果,圖1(B)為CD3+CD8+細胞的結果,PE和FITC為流式細胞儀的通道;
圖2為施用本發明藥物組合物后臨床實驗結果,其中,圖2(A)-(B)治療前的腦胸部轉移灶的腫瘤大小結果圖,圖2(C)-(D)治療2月后腦胸部轉移灶的腫瘤大小結果圖,圖2(E)-(F)治療6月后腦胸部轉移灶的腫瘤大小結果圖;
圖3為本發明施用本發明藥物組合物后臨床實驗結果,其中,圖3(A)-(E)治療前的骨、肝、腦、胰腺及右腎多發轉移灶腫瘤大小結果圖,圖3(F)-(J)治療3月后各器官多發轉移灶腫瘤大小結果圖,圖3(K)-(O)治療5月后病灶腫瘤大小結果圖,圖3(P)-(T)治療11月后病灶腫瘤大小結果圖;
圖4施用本發明藥物組合物后臨床實驗結果,其中,圖4(A)-(E)治療前的胸腹部多發轉移灶腫瘤大小結果圖,圖4(F)-(J)治療45天后胸腹部多發轉移灶腫瘤大小結果圖,圖4(K)-(O)治療3月后病灶腫瘤大小結果圖,圖4(P)-(T)治療5月后病灶腫瘤大小結果圖;
圖5施用本發明藥物組合物后臨床實驗結果,其中,圖5(A)、圖5(C)和圖5(E)為治療前的肺部多發轉移灶的腫瘤大小結果圖,圖5(B)、圖5(D)和圖5(F)為治療2.5月后肺部多發轉移灶的腫瘤大小結果圖;
圖6施用本發明藥物組合物后臨床實驗結果,其中,圖6(A)-(D)為治療4周期后肺部轉移灶的腫瘤大小結果圖。
具體實施方式
為更進一步闡述本發明所采取的技術手段及其效果,以下結合附圖并通過具體實施方式來進一步說明本發明的技術方案,但本發明并非局限在實施例范圍內。
實施例中未注明具體技術或條件者,按照本領域內的文獻所描述的技術或條件,或者按照產品說明書進行。所用試劑或儀器未注明生產廠商者,均為可通過正規渠道商購獲得的常規產品。
實施例1:制備非特異性擴增激活T細胞
所述非特異性擴增激活T細胞的制備方法包括如下步驟:
(1)抽取病人外周血50mL(肝素鈉抗凝),分裝在兩個50mL的離心管內800g、4℃離心15min;
(2)離心后抽取上層血漿于50mL離心管中放于4℃冰箱中保存;
(3)將離心管中的血細胞與生理鹽水1:1稀釋,緩慢加至淋巴細胞細胞分離液上層,800g、20℃離心17min;
(4)離心后提取單個核細胞(即白膜層)置于50mL離心管內,加入生理鹽水洗滌,300g、4℃離心8min,洗2遍;
(5)細胞計數后將細胞進行CD4和CD8磁珠分選,并將獲得的CD4+T細胞和CD8+T細胞按細胞數量比1:1進行混合,細胞接種在包被過(RetroNectin60μL/瓶、CD3單抗15μL/瓶、PBS 10mL/瓶)的培養瓶內,加入完全培養液50-60mL,所述完全培養基為無血清培養液中加入IL-2為1000IU/mL,IFN-γ為1000IU/mL,慶大霉素為160IU/mL,IL-1α為50-150IU/mL,5%自體血漿,放入5%CO2培養箱中,37℃進行非特異性擴增激活T細胞的培養;
(6)隔日顯微鏡下觀察,根據細胞狀態和數量適量補充完全培養基;
(7)14d后非特異性擴增激活T細胞成熟,提前進行質控檢測,合格后結合醫囑回收細胞,用生理鹽水洗3遍(重懸后低速離心、棄上清),用適量含有20%白蛋白的生理鹽水重懸細胞。
將細胞進行流式細胞儀鑒定,結果如圖1(A)-1(B)所示,CD3+CD4+含量為34.66%,CD3+CD8+含量為68.16%,符合細胞發放標準。
實施例2:藥物組合物對小鼠模型腎癌細胞的抑制作用
(1)小鼠腎癌模型的建立采用皮下抑制模型,便于觀察腫瘤生長情況。取正常6周齡裸鼠25只,每只老鼠體重約為20g,在每只裸鼠右側鼠鼠鼷處皮下注射0.2mL腎癌細胞懸液,10d于接種出長出2~3mm瘤時,小鼠黑色素瘤模型制作成功。
(2)分組及處理
造模后小鼠隨機分成5組,每組5只,分別包括PBS對照組(腹腔注射滅菌PBS 1mL),PD-1單抗處理組(腹腔注射2mg/kg),非特異性擴增激活T細胞處理組(雙歧桿菌5.83×109個),藥物組合物處理組,與接種瘤細胞后次日開始給藥,每三周給藥一次,連續給藥4個周期。
(3)對小鼠腎癌細胞抑制作用的研究
停藥次日并稱重處死小鼠,解剖剝離腫瘤塊,稱瘤重,按平均瘤重計算抑瘤率。抑瘤率=[(對照組腫瘤體積-實驗組腫瘤體積)/對照組腫瘤體積]×100%。
(4)實驗結果
結果顯示,處理組與PBS對照組相比,前者明顯抑制了小鼠腎癌細胞的生長,PD-1單抗處理組、非特異性擴增激活T細胞處理組和藥物組合物處理組的抑瘤率分別為27%、70%、100%。其中,藥物組合物處理組和其他兩組相比,有顯著差異(P<0.05)。說明,藥物組合物處理組使用抑制腎癌細胞效果要高于其他各組
實施例3:臨床實驗
男,50歲。2012.12診為左腎透明細胞癌并肺骨轉移,行左腎癌手術切除后,應用雙磷酸鹽維持治療,2013.5因腦轉移γ-刀放療。2013.9-2014.10,因肺部腫瘤進展口服索坦治療,期間及2013.11因腦部出現新病灶行γ-刀放療及全腦放療。2014.11-2015.5:因腦肺轉移進展改用依維莫司治療,期間2014.4行γ-刀立體定向放射外科治療。
2015.6-2016.1:因腦胸部腫瘤再次進展,應用PD-1抗體(keytruda)2mg/kg,三周一次,共8次。非特異性擴增激活T細胞5.83×109/次,共11次。結果如圖2所示,圖2(A)-(B)顯示治療前腎癌腫瘤的最大直徑之和為6.7cm,圖2(C)-(D)顯示治療2月后腦胸部轉移灶的腫瘤明顯縮小,圖2(E)-(F)顯示治療6月后腦胸部轉移灶的腫瘤的最大直徑之和為1.4cm,腫瘤縮小79.1%,明顯治療2月后腦胸部轉移灶逐漸縮小,療效持續6.5個月,療效評價達PR(部分緩解)。
2016.2-2016.6.8:腦轉移灶再次進展,對癥支持治療,2016年6月8日去世
不良反應:回輸PD-1抗體后最高體溫37.8℃,持續36小時(沒有用退熱藥物)。輕度乏力(可能與治療無關)。
實施例4:臨床實驗
男,66歲。2012.6診斷為左腎透明細胞癌并多發骨轉移,行左腎癌切除術。
2012.7-2015.7:口服索拉菲尼治療。2013.7行第三腰椎放療(30Gy/10f),2015.4因左肱骨病理性骨折行左肱骨內鋼板內固定術。
2015.7-2015.10:因骨轉移進展口服舒尼替尼治療。在此期間腫瘤進一步轉移到肝、腦、胰腺及右側腎上腺,口服舒尼替尼期間出現Ⅲ度血小板減少及貧血,Ⅱ度陰囊皮膚潰瘍。
2015.7-2016.8:因腫瘤進展無法控制,應用PD-1抗體(keytruda)2mg/kg,三周一次,共10次,聯合非特異性擴增激活T細胞5.83×109/次,共10次,結果如圖3所示,圖3(A)-(E)顯示治療前病灶腫瘤的最大直徑之和為6.1cm,有胸水,圖3(F)-(J)顯示治療3月后病灶腫瘤的最大直徑之和明顯縮小,圖3(K)-(O)顯示治療5月后病灶腫瘤的最大直徑之和幾乎不可見,圖3(P)-(T)顯示治療11月后病灶腫瘤消失,胸水消失,療效持續大于10個月,療效評價為CR(完全緩解)。
不良反應:前2次PD-1抗體回輸后最高體溫38.2℃,1度甲狀腺功能減低。
實施例5:臨床實驗
男,79歲。2016.6診斷為左腎透明細胞癌,行左腎癌根治術。
2015.10-2016.3:因胸腹部多發轉移,口服阿昔替尼治療,效果差,腫瘤持續進展,出現皮疹及腹瀉3級不良反應。
2015.6-至今:應用PD-1抗體2mg/kg,三周一次,共聯合非特異性擴增激活T細胞5.83×109/次6次。為緩解第三腰椎疼痛在免疫治療前進行了局部放療,結果如圖4所示,圖4(A)-(E)顯示治療前病灶腫瘤的最大直徑之和為6.3cm,圖4(F)-(J)顯示治療45天后病灶腫瘤的最大直徑之和為0.6cm,圖4(K)-(O)顯示治療3月后病灶腫瘤的最大直徑之和明顯縮小,圖4(P)-(T)顯示治療5月后病灶腫瘤的最大直徑之和為0.6cm,腫瘤縮小91.5%,治療持續大于7個月,療效評價為PR(部分緩解)。
不良反應:每次PD-1抗體及回輸后皮膚出現數片蕁麻疹,不用藥物自行消退。
實施例6:臨床實驗
男,65歲,右腎癌3期術后3月出現肺轉移,應用索拉菲尼治療2年半后耐藥出現疾病進展,應用PD-1抗體2mg/kg,三周一次,共聯合非特異性擴增激活T細胞5.83×109/次6次,結果如圖5(A)-(F)所示,治療前轉移肺的腫瘤最大直徑之和為2.3cm,治療1月后轉移肺的腫瘤的最大直徑之和縮小為1.9cm,腫瘤縮小23.5%,治療1月后復查肺部轉移灶開始縮小,治療2月半后復查腫瘤幾乎消失,療效評價為CR(完全緩解)。
不良反應:副作用為PD1回輸后低熱、乏力,3天后緩解,自述副作用遠較索拉菲尼小。
實施例7:臨床實驗
男,58歲。2014年11月行右腎癌根治術,術后11月出現肺轉移。
2015年11月至2016年7月:應用PD-1抗體2mg/kg,三周一次,共聯合非特異性擴增激活T細胞5.83×109/次6次,結果如圖6(A)-圖6(D)所示,治療前轉移肺的腫瘤最大直徑之和為1.2cm,治療11月后轉移肺的腫瘤細胞基本消失,療效持續大于11個月,療效評價為CR(完全緩解)。
不良反應:無明顯不良反應。
綜上所述,本發明藥物組合物通過PD-1抗體和非特異性擴增激活T細胞協同作用,對腎癌有明顯的治療效果,按RESIST標準評價均達到PR(部分緩解)或接近CR(完全緩解),有效率達100%,而副作用都十分微小,無3或4級不良反應發生。
申請人聲明,本發明通過上述實施例來說明本發明的詳細方法,但本發明并不局限于上述詳細方法,即不意味著本發明必須依賴上述詳細方法才能實施。所屬技術領域的技術人員應該明了,對本發明的任何改進,對本發明產品各原料的等效替換及輔助成分的添加、具體方式的選擇等,均落在本發明的保護范圍和公開范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!