一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法
本發(fā)明屬于生物醫(yī)藥技術(shù)領(lǐng)域,具體涉及一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒及其制備和應(yīng)用。
背景技術(shù):
癌癥是當(dāng)今威脅人類(lèi)健康的主要原因之一,而且至今難以治愈。90%以上的癌癥病人死于腫瘤轉(zhuǎn)移。腫瘤轉(zhuǎn)移被認(rèn)為是因腫瘤細(xì)胞由原位瘤脫落,經(jīng)過(guò)血液循環(huán)到達(dá)新的位點(diǎn)而形成新的轉(zhuǎn)移病灶。因此,研發(fā)針對(duì)腫瘤轉(zhuǎn)移的靶向納米載體能夠有效抑制腫瘤轉(zhuǎn)移,從而減少癌癥死亡人數(shù)。
血液中的循環(huán)腫瘤細(xì)胞(Circulating Tumor Cells,CTCs)表面具有許多特異性蛋白,如EpCAM、CD44、HER2等,而這些蛋白在正常細(xì)胞中不表達(dá)或者表達(dá)量很低。因此,通過(guò)特異性識(shí)別這些細(xì)胞,利用納米載體靶向給藥抑制其活性,可使CTCs失去轉(zhuǎn)移能力。另一方面,由于CTCs表面的各種特異性抗原的表達(dá)量會(huì)受病人體內(nèi)環(huán)境影響而產(chǎn)生變化,因此,納米粒表面的靶向基團(tuán)若能特異性靶向兩個(gè)或多個(gè)受體將大大提高納米載體的靶向識(shí)別能力。但目前大多數(shù)靶向給藥的納米載體都是利用單一抗體或適配體,如(Liu J, Wei T, Zhao J, Huang Y, et al. Multifunctional aptamer-based nanoparticles for targeted drug delivery to circumvent cancer resistance. J. Biomaterials. 2016. 91: 44-56.),其識(shí)別位點(diǎn)單一,特異性并不高。另有采取雙抗體修飾納米粒的研究(Jingjing Xie, Yusheng Lu, Haiyan Dong, et al. Enhanced Specificity in Capturing and Restraining Circulating Tumor Cells with Dual Antibody–Dendrimer Conjugates. Advanced Functional Materials. 2015, 25 (8): 1304-1313.),但由于抗體體積較大,納米載體表面修飾的抗體數(shù)量有限,所以特異性識(shí)別能力也有限。
核酸適配體是一種能識(shí)別特異性抗原的DNA或RNA序列,與傳統(tǒng)抗體相比,它具有體積小、穩(wěn)定、生物相容性高、合成簡(jiǎn)便等優(yōu)點(diǎn)。在作為靶向基團(tuán),核酸適配體由于體積較小,產(chǎn)生的位阻會(huì)很少,從而加大了和靶點(diǎn)的結(jié)合能力。
介孔二氧化硅納米粒(MSN)是一種廣泛用于疾病的診斷和治療的納米材料。它獨(dú)特的介孔結(jié)構(gòu)、可變的粒徑、良好的生物相容性和穩(wěn)定的化學(xué)特性,讓MSN成為一種理想的納米載體。
阿霉素(DOX)是一種周期非特異性廣譜抗腫瘤藥物,對(duì)各種周期的腫瘤細(xì)胞都有殺傷作用,其作用機(jī)理是嵌入目標(biāo)細(xì)胞的DNA中,從而抑制DNA的復(fù)制和RNA的合成。
基于以上背景,本發(fā)明設(shè)計(jì)了一種基于MSN的靶向載藥納米粒,其通過(guò)裝載化療藥物DOX后,再在MSN表面修飾一種或多種核酸適配體,使其具有高效地識(shí)別靶細(xì)胞的能力,可用于預(yù)防腫瘤轉(zhuǎn)移,目前尚未有此類(lèi)報(bào)道。
技術(shù)實(shí)現(xiàn)要素:
本發(fā)明針對(duì)現(xiàn)有靶向給藥載體特異性差等不足,提供了一雙適配體修飾的介孔二氧化硅靶向載藥納米粒,其能夠利用兩種適配體的特異性識(shí)別能力,協(xié)同增加介孔二氧化硅納米粒對(duì)靶細(xì)胞的識(shí)別能力,從而達(dá)到準(zhǔn)確給藥的目的。
為實(shí)現(xiàn)上述目的,本發(fā)明采用如下技術(shù)方案:
一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒,其是由介孔二氧化硅納米粒、包載在介孔二氧化硅納米粒孔道內(nèi)部的抗癌藥物及修飾在介孔二氧化硅納米粒表面的能識(shí)別癌細(xì)胞表面特異性蛋白的兩種核酸適配體構(gòu)成。
其中,所述介孔二氧化硅納米粒的粒徑為100-500 nm。
所述抗癌藥物為DOX,其裝載量為20wt%-80wt%。
兩種核酸適配體的連接量均為10-1000 pmol/mg。
所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制備方法,是將介孔二氧化硅納米粒MSN經(jīng)表面修飾后,將能特異性識(shí)別癌細(xì)胞表面EpCAM和CD44的兩種核酸適配體E-AP、C-AP連接到介孔二氧化硅納米粒表面,再用其裝載抗癌藥物DOX,制得所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒;其包括以下步驟:
1)將十六烷基三甲基氯化銨與三乙醇胺、四乙基硅烷混合攪拌,得到羥基修飾的納米粒MSN-OH;
2)利用3-氨丙基三乙氧基硅烷對(duì)所得MSN-OH進(jìn)行修飾,得到氨基修飾的納米粒MSN-NH2;
3)在1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)/N-羥基琥珀酰亞胺(NHS)的作用下,將所得MSN-NH2與靶向EpCAM的核酸適配體E-AP、靶向CD44的核酸適配體C-AP進(jìn)行共價(jià)連接,得到雙適配體修飾的納米粒EC-MSN;
4)在磷酸緩沖液中,將所得EC-MSN與DOX混合進(jìn)行裝載,得到靶向載藥納米粒EC-MSN-D。
所述雙適配體修飾的介孔二氧化硅靶向載藥納米粒在用于制備預(yù)防和治療腫瘤轉(zhuǎn)移藥物上的應(yīng)用。
本發(fā)明靶向載藥納米粒由介孔二氧化硅納米粒、包載在介孔二氧化硅納米粒孔道內(nèi)部的抗癌藥物及修飾在介孔二氧化硅納米粒表面的能特異性識(shí)別癌細(xì)胞表面特異性蛋白的兩種核酸適配體構(gòu)成。其中,以介孔二氧化硅納米粒作為藥物載體,對(duì)廣譜抗腫瘤藥物進(jìn)行裝載,在達(dá)到運(yùn)載藥物目的的同時(shí),對(duì)各周期的腫瘤細(xì)胞均有殺傷作用;以?xún)煞N核酸適配體作為靶向基團(tuán)修飾載藥后的介孔二氧化硅納米粒,使其具有靶向目標(biāo)細(xì)胞的能力,從而實(shí)現(xiàn)靶向給藥,抑制CTCs活性,最終達(dá)到抑制腫瘤細(xì)胞轉(zhuǎn)移的目的。
本發(fā)明的效益在于:
(1)本發(fā)明以介孔二氧化硅納米粒作為藥物載體,通過(guò)控制納米粒的粒徑,能很好控制抗癌藥物的裝載量和釋放量;以多種核酸適配體做為靶向基團(tuán),能夠有效作用于血液中的CTCs,達(dá)到抑制腫瘤轉(zhuǎn)移的效果。
(2)針對(duì)不同的靶細(xì)胞和細(xì)胞表面的特異性抗原,本發(fā)明所用到的核酸適配體的種類(lèi)和數(shù)量可以根據(jù)需求改變,即可用于兩種以上核酸適配體的修飾。因此,本發(fā)明能適用于預(yù)防和治療多種癌癥的轉(zhuǎn)移。
附圖說(shuō)明
圖1為所合成MSN-NH2的TEM圖。
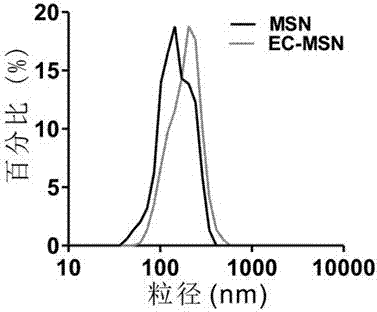
圖2為MSN與適配體連接后的MSN的粒徑分布。
圖3為不同納米粒對(duì)DOX的裝載特性曲線(xiàn)。
圖4為不同納米粒在pH=5.5和pH=7.4條件下的釋放特性曲線(xiàn)。
圖5為SW620細(xì)胞對(duì)MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和游離藥物Free DOX的攝取量化圖。
圖6為HT29細(xì)胞對(duì)MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和游離藥物Free DOX的攝取量化圖。
圖7為不同納米粒對(duì)SW620細(xì)胞粘附HUVECs的抑制作用情況圖(A)及其抑制率(B)。
圖8為不同納米粒處理后裸鼠腫瘤轉(zhuǎn)移肺組織的情況圖(A)及肺組織上轉(zhuǎn)移位點(diǎn)個(gè)數(shù)(B)。
具體實(shí)施方式
為了使本發(fā)明所述的內(nèi)容更加便于理解,下面結(jié)合具體實(shí)施方式對(duì)本發(fā)明所述的技術(shù)方案做進(jìn)一步的說(shuō)明,但是本發(fā)明不僅限于此。
所用核酸適配體E-AP及C-AP的具體序列分別參見(jiàn)文獻(xiàn)Y.L. Song, Z. Zhu, Y. An, W.T. Zhang, H.M. Zhang, D. Liu, et al., Selection of DNA Aptamers against Epithelial Cell Adhesion Molecule for Cancer Cell Imaging and Circulating Tumor Cell Capture, Anal Chem 85 (8) (2013) 4141-4149;K. Sefah, K.M. Bae, J.A. Phillips, D.W. Siemann, Z. Su, S. McClellan, et al., Cell-based selection provides novel molecular probes for cancer stem cells, Int J Cancer 132 (11) (2013) 2578-2588。
實(shí)施例1
取2.0 g十六烷基三甲基氯化銨(CTAC)與0.1 g的三乙醇胺(TEA),溶于20 mL超純水中,95℃油浴中恒溫?cái)嚢? h,之后逐滴加入1.5 mL的四乙基硅烷(TEOS),繼續(xù)在95℃油浴中恒溫?cái)嚢? h;停止加熱,待反應(yīng)液冷卻到室溫后,15000 rpm下離心10 min,移除上清,所得沉淀用無(wú)水乙醇洗滌3次,以除去反應(yīng)殘留,然后將洗滌后的固體物質(zhì)加入到20 mL氯化鈉-甲醇溶液中(每100 mL甲醇中含1 g氯化鈉),室溫?cái)嚢? h以去除CTAC,再將所得的固體物質(zhì)冷凍干燥,得的白色固體MSN-OH。
實(shí)施例2
將100 mg所得MSN-OH與2.5 mL 3-氨丙基三乙氧基硅烷(APTES)溶于20 mL無(wú)水乙醇中,常溫下攪拌12h,然后將樣品液在15000 rpm下離心10 min,移除上清,所得沉淀分別用無(wú)水乙醇與超純水洗滌3次以除去反應(yīng)殘留,再將所得的固體物質(zhì)冷凍干燥后即得到MSN-NH2。所得MSN-NH2的TEM圖如圖1。
實(shí)施例3
將7 nmol羧基修飾的E-AP和(或)C-AP與8 mg的EDC、8 mg的NHS加入到5 mL的超純水中,攪拌15 min后加入10 mg MSN-NH2,再繼續(xù)攪拌12 h;然后將反應(yīng)混合液在15000 rpm下離心10 min,移除上清,干燥,分別得E-MSN、C-MSN與EC-MSN。
所得MSN-NH2與EC-MSN的粒徑分布對(duì)比圖如圖2。
實(shí)施例4
于避光條件下將DOX溶于PBS中,制得濃度為0.5 mg/mL的藥液;然后稱(chēng)取MSN-NH2、E-MSN、C-MSN、EC-MSN各5 mg,分別加入到配制的藥液中,避光攪拌24h,得MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D;此過(guò)程中于不同時(shí)間點(diǎn)取樣品,15000 rpm離心10 min后取上清測(cè)定DOX含量,并繪制DOX裝載的特性曲線(xiàn),如圖3。
實(shí)施例5
稱(chēng)取MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D各5 mg,將其分別分散于5 mL pH=5.5與pH=7.4的緩沖液中,避光攪拌,在不同時(shí)間點(diǎn)取樣品,15000 rpm下離心10 min,測(cè)定上清液中DOX的含量,并繪制DOX釋放的特性曲線(xiàn),如圖4。
由圖4可見(jiàn),在pH=5.5的緩沖液中DOX的釋放更高,可達(dá)到45%。這種釋放特性有利于藥物在細(xì)胞中的釋放,而減少在血液中的釋放,有利于減少副反應(yīng)。
實(shí)施例6
將SW620細(xì)胞與HT29細(xì)胞消化后鋪到24孔板上,待細(xì)胞貼壁后移除培養(yǎng)基,分別與5μg/mL的MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D在37 ℃下孵育2 h,然后用預(yù)冷的PBS洗滌2遍,消化后進(jìn)行流式分析,其結(jié)果如圖5、6所示。
由圖5、6可見(jiàn),EC-MSN-D與靶細(xì)胞SW620及HT29的識(shí)別能力均高于其他納米粒子,且對(duì)SW620細(xì)胞的識(shí)別能力顯著。
實(shí)施例7
將人臍靜脈內(nèi)皮細(xì)胞(HUVECs)鋪到24孔板中,用刺激因子IL-1β刺激細(xì)胞蛋白表達(dá);待HUVECs長(zhǎng)滿(mǎn)后,用胰蛋白酶消化結(jié)腸癌細(xì)胞SW620,用預(yù)冷的PBS洗滌兩遍,再用羅丹明123在避光條件下染色20 min,染色結(jié)束后,再用PBS洗滌兩遍。將細(xì)胞計(jì)數(shù)后,調(diào)整細(xì)胞數(shù)為3×106個(gè),并分別加入濃度為5μg/mL的MSN-D、E-MSN-D、C-MSN-D與EC-MSN-D,然后將24孔板置于37 ℃下孵育1 h;孵育完成后,吸去上清液,并用PBS洗去未粘附的SW620細(xì)胞。用熒光顯微鏡觀察粘附到HUVECs上的SW620細(xì)胞,每個(gè)樣品挑選10個(gè)視野,并計(jì)算其粘附率,結(jié)果如圖7所示。
實(shí)施例8
將實(shí)驗(yàn)用裸鼠隨機(jī)分為6個(gè)小組,每組4只;將SW620細(xì)胞消化后懸浮于生理鹽水中,每只裸鼠通過(guò)尾靜脈注射200 μL含1.5×106個(gè)SW620細(xì)胞的生理鹽水;10 min后,各組裸鼠再分別尾靜脈注射200 μL生理鹽水、MSN-D、E-MSN-D、C-MSN-D、EC-MSN-D和Free DOX。注射后繼續(xù)飼養(yǎng)15天,每3天稱(chēng)一次裸鼠體重;15天后處死所有裸鼠,解剖并取出肺組織,布氏液處理,并計(jì)算轉(zhuǎn)移位點(diǎn)個(gè)數(shù),結(jié)果如圖8所示。
由圖8可見(jiàn),EC-MSN-D對(duì)裸鼠腫瘤轉(zhuǎn)移肺組織的抑制效果最顯著。
以上所述僅為本發(fā)明的較佳實(shí)施例,凡依本發(fā)明申請(qǐng)專(zhuān)利范圍所做的均等變化與修飾,皆應(yīng)屬本發(fā)明的涵蓋范圍。
- 還沒(méi)有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 靶向腦膠質(zhì)瘤的雙重修飾脂質(zhì)體給藥系統(tǒng)的制備和應(yīng)用的制作方法與工藝
- 一種基于強(qiáng)電荷修飾的靶向基團(tuán)作為藥物包覆劑的設(shè)計(jì)方法與流程
- 用于靶向遺傳修飾的方法和組合物,以及這些組合物的使用方法與流程
- DUOX2修飾的DC疫苗及其靶向殺傷胰腺癌起始細(xì)胞的應(yīng)用的制造方法與工藝
- 用于豬APN基因編輯的靶向sgRNA、修飾載體及其制備方法和應(yīng)用與流程
- 腦部引經(jīng)藥修飾的腦靶向納米給藥系統(tǒng)及其制備方法與流程
- 腫瘤抑制基因的雜合修飾和1型神經(jīng)纖維瘤病的豬模型的制造方法與工藝
- 修飾的人類(lèi)U1snRNA分子、編碼修飾的人類(lèi)U1snRNA分子的基因、包括該基因的表達(dá)載體及其在基因治療中的用途的制造方法與工藝
- 用于通過(guò)單步多重靶向進(jìn)行靶向遺傳修飾的方法和組合物與流程
- 導(dǎo)致單性結(jié)實(shí)坐果的經(jīng)修飾的基因的制造方法與工藝
- 以介孔二氧化硅為硬模板制備高比表面二氧化錫催化劑的方法與流程
- 用于調(diào)節(jié)免疫反應(yīng)的介孔二氧化硅組合物的制造方法與工藝
- 介孔二氧化硅/二氧化鈦納米管陣列復(fù)合材料的制備方法與流程
- 一種磁性介孔γ?Fe2O3/γ?Al2O3復(fù)合材料的制備方法與流程
- 一種介孔二氧化硅可降解支架及其制備方法與流程
- 殼核分子印跡二氧化硅/金納米粒子復(fù)合材料的制備的制造方法與工藝
- 一種介孔碳納米管復(fù)合纖維素溫敏吸附材料的制備方法與制造工藝
- 球狀結(jié)晶性二氧化硅粒子及其制造方法與制造工藝
- 通過(guò)共研獲得的具有活性相的介孔與大孔催化劑 、其制備方法及其用于渣油的加氫處理的用途與制造工藝
- 輪胎中官能化樹(shù)脂的二氧化硅處理的制造方法與工藝
- 介孔碳?二氧化硅復(fù)合體負(fù)載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 一種中空核殼式磁性介孔氮化碳及其制備方法與流程
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應(yīng)用與流程
- 一種介孔二氧化硅微球的淀粉復(fù)合止血敷料的制作方法與工藝
- 介孔二氧化硅負(fù)載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復(fù)合材料及其制備方法和應(yīng)用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應(yīng)用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學(xué)發(fā)光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 大孔徑介孔碳/二氧化硅負(fù)載金納米催化劑及其合成方法與流程
- 介孔碳?二氧化硅復(fù)合體負(fù)載納米鈀催化劑及其合成方法與流程
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應(yīng)用與流程
- 一種原位制備納米二氧化硅/端羥基聚二甲基硅氧烷雜化材料的方法與流程
- 一種介孔二氧化硅微球的淀粉復(fù)合止血敷料的制作方法與工藝
- 介孔二氧化硅負(fù)載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復(fù)合材料及其制備方法和應(yīng)用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應(yīng)用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學(xué)發(fā)光納米材料及其制備方法與流程
- 一種基于介孔二氧化硅的鈷碳納米晶材料及其制備方法
- 一種藥物/介孔二氧化硅復(fù)合涂層包覆的醫(yī)用鈦合金復(fù)合材料及其制備方法
- 單分散中空介孔二氧化硅納米微球的制備方法
- 偶聯(lián)葉酸靶向的四氧化三鐵/介孔二氧化硅/硫化銅納米復(fù)合粒子及其制備方法和應(yīng)用
- 中空球缺形介孔二氧化硅/氯過(guò)氧化物酶納米反應(yīng)器的制備及應(yīng)用
- 一種高產(chǎn)量介孔二氧化硅納米顆粒及葉酸靶向修飾的方法
- 一種洋蔥狀介孔二氧化硅納米材料的合成方法
- 低毒介孔二氧化硅基因納米載體的制備方法及其應(yīng)用
- 一種指示油頁(yè)巖灰制備介孔二氧化硅反應(yīng)終點(diǎn)的裝置的制造方法
- 添加有氧化石墨烯-介孔二氧化硅復(fù)合材料的卷煙濾棒的制作方法
- 一種雙適配體修飾的介孔二氧化硅靶向載藥納米粒的制作方法與工藝
- 功能化中空介孔二氧化硅納米微球及其制備方法與在吸附重金屬離子中的應(yīng)用與流程
- 一種介孔二氧化硅微球的淀粉復(fù)合止血敷料的制作方法與工藝
- 介孔二氧化硅負(fù)載的高分散鎳鑭氧化物催化劑的制備方法與流程
- 氨基化介孔二氧化硅?葡萄糖?二氧化錳納米復(fù)合材料及其制備方法和應(yīng)用與流程
- 苯硼酸修飾的介孔二氧化硅/胰島素納米粒的制備及應(yīng)用的制作方法與工藝
- 一種基于介孔納米二氧化硅的電致化學(xué)發(fā)光納米材料及其制備方法與流程
- 一種具有高效凝血功能的介孔二氧化硅顆粒的高效制備方法與流程
- 一種毛刷狀介孔二氧化硅纖維材料及其制備方法與流程
- 一種介孔二氧化硅包覆磁性多壁碳納米管復(fù)合材料及其制備方法與流程