黃體酮緩釋微球及納米粒、其制備方法和黃體酮緩釋注射劑與流程
本發明涉及制藥技術領域,尤其涉及一種黃體酮緩釋微球及其制備方法、黃體酮緩釋納米粒及其制備方法和黃體酮緩釋注射劑。
背景技術:
習慣性流產指的是連續發生≥3次的自然流產,其發病誘因尚不完全明確,給病人心理帶來巨大的傷害。復發性流產發病誘因繁多,并較為復雜,其主要有免疫因素、遺傳以及內分泌紊亂等,因此給臨床治療帶來一定的難度。根據相關實踐研究表明,患有這種疾病的病人身體當中的黃體功能不全的為24%-68%。對于黃體缺陷的發生,研究者多認為是由于絕大多數試管嬰兒周期中使用促性腺激素釋放激素激動劑(gonadotropin-releasinghormoneagonist,gnrha)進行降調節,gnrha引起垂體抑制,使得垂體功能恢復相對推遲,導致妊娠早期黃體功能缺陷。臨床應用試管嬰兒等人工助孕技術30多年以來,黃體期藥物支持治療逐漸被公認為是有利于妊娠結局的一種干預手段。
黃體酮(progesterone,可簡稱prg),又名孕酮,為白色或微黃色結晶粉末,熔點127~131℃,無臭,在空氣中穩定,有右旋光性,不溶于水,溶于乙醇、乙醚、氯仿、丙酮、二氧六環和濃硫酸。黃體酮的化學名稱為:孕甾-4-烯-3,20-二酮,分子式:c21h30o2,分子量:314.47,結構式如下:
黃體酮能夠使增值期內膜轉化成為分泌期內膜,為受精卵植入、著床以及初期胚胎的營養支持提供便利條件。孕酮可以使細胞當中鈉離子濃度明顯升高,使肌纖維興奮性明顯下降,以及使肌纖維明顯松弛,進而使宮縮明顯減少,最終使胚胎在子宮當中繼續進行生長發育;黃體激素對妊娠的積極作用主要體現在誘導子宮內膜向分泌期轉變,增加內膜容受性以利于受精卵著床,以及作用于子宮局部,經一氧化氮等因子促使血管及平滑肌舒張而抑制宮縮。
臨床上黃體酮應用劑型主要有口服膠囊、凝膠栓劑、肌注油溶制劑等,其中,黃體酮口服制劑給藥方便快捷,患者易于接受,但是口服黃體酮會在胃腸道及肝臟迅速破壞,難以起到補充和治療作用。由于黃體酮溶解度極低,且首過效應嚴重,口服生物利用度僅為10%。口服制劑往往通過增加表面活性劑濃度來提高黃體酮溶解度,不能從根本上解決黃體酮首過效應強、生物利用度低的問題;每天的給藥劑量仍需很大才能達到療效,導致副作用較大。因此,臨床上普遍使用油溶液肌注,價格也相對低廉。
但是,現有的黃體酮注射劑為油溶液注射劑,需每天注射,長期注射(約12周)。油溶液注射時極易引起患者不適,如疼痛、局部紅腫、過敏等癥狀,個別病理報道甚至指出肌肉注射黃體酮可誘發急性嗜酸性粒細胞肺炎。且油劑黃體酮半衰期長,通常要數周時間才能恢復。長期高頻次注射也會導致注射部位產生硬結等其他癥狀,不利于注射部位組織健康。患者均為孕婦,每天注射黃體酮極為不便,且黃體酮注射存在油溶劑易引起肌肉板結、疼痛等問題。
技術實現要素:
有鑒于此,本申請提供一種黃體酮緩釋微球及其制備方法、黃體酮緩釋納米粒及其制備方法和黃體酮緩釋注射劑,本發明提供的黃體酮緩釋微球和納米粒可用作肌肉注射劑,載藥量高,體內外持續釋放時間長,且注射刺激性小,患者順應性好。
本發明提供一種黃體酮緩釋微球,其由包括黃體酮和第一聚合物材料的物料制成,所述第一聚合物材料選自聚乳酸-羥基乙酸共聚物、聚乳酸、聚己內酯和聚乙醇酸中的一種或多種;所述第一聚合物材料的分子量為4000~40000道爾頓;所述黃體酮占緩釋微球總質量的30%~40%;
所述黃體酮緩釋微球的粒徑為10~20μm。
本發明提供一種黃體酮緩釋納米粒,其由包括黃體酮和第二聚合物材料的物料制成,所述第二聚合物材料選自聚乳酸-羥基乙酸共聚物、聚乳酸、聚己內酯和聚乙醇酸中的一種或多種;所述第二聚合物材料的分子量為6000~60000道爾頓;所述黃體酮占緩釋納米粒總質量的10%~20%;
所述黃體酮緩釋納米粒的粒徑為100~400nm。
為解決黃體酮臨床應用劑型上的不足,本發明人經大量研究發明了可用于肌肉注射的黃體酮控釋微球及納米粒,藥物包埋于生物可降解、組織相容性良好的聚合物內,體內外均可持續緩釋一周以上,安全性較強,刺激性小,提高患者順應性。
為實現上述目的,本發明提供了如下多種實施方案。
在一實施方案中,本發明的注射黃體酮控釋微球包含黃體酮,以及生物可降解的藥用高分子材料聚乳酸-羥基乙酸共聚物(plga)、聚乳酸(pla)、聚己內酯(pcl)和聚乙醇酸(pga)中的一種或多種,優選為plga,其在環保性和注射應用性等方面的效果最佳。考慮材料的降解周期,本發明首選降解時間短的聚合物材料plga,可使長效注射劑給藥周期為一周一次。為便于區分,將微球中聚合物材料稱為第一聚合物材料。
其中,黃體酮與第一聚合物材料投料重量比可為1:1.5-2;黃體酮占微球總重30-40%。在本發明中,所述第一聚合物材料的分子量為4000~40000道爾頓;具體地,所述聚乳酸-羥基乙酸共聚物的分子量可為10000-40000道爾頓;聚乳酸的分子量可為10000-20000道爾頓;聚己內酯的分子量可為4000-40000道爾頓;聚乙醇酸的分子量可為8000-20000道爾頓。在本發明的一些實施例中,所述聚乳酸-羥基乙酸共聚物的分子量為12000-30000道爾頓。
在本發明中,所述第一聚合物材料的封端方式可為羧基封端、酯封端和羥基封端中的一種或多種;具體地,所述plga為羧基封端、酯封端或羥基封端;所述pcl為羧基封端、酯封端或羥基封端;所述pla為羧基封端、酯封端或羥基封端。
在本發明的優選實施例中,所述聚乳酸-羥基乙酸共聚物中乳酸和羥基乙酸的摩爾比為(50~85):(15~50)。所述plga的乳酸和羥基乙酸的摩爾比優選為50:50、75:25或85:15,更優選為50:50或75:25;分子量為10000-40000道爾頓,一周持續釋放藥物90%以上。
在一實施方案中,本發明的注射黃體酮控釋納米粒包含黃體酮,以及生物可降解的藥用高分子材料plga、pcl、pla、pga等中的一種或多種聚合物材料的混合,優選為plga。在本發明中,黃體酮與第二聚合物材料投料重量比可為1:1.5-2;黃體酮占納米粒總重10-20%。
在本發明中,所述第二聚合物材料的分子量為6000~60000道爾頓;具體地,所述聚乳酸-羥基乙酸共聚物的分子量可為10000-60000道爾頓;聚乳酸的分子量可為20000-30000道爾頓;聚己內酯的分子量可為6000-50000道爾頓;聚乙醇酸的分子量可為10000-30000道爾頓。在本發明的一些實施例中,所述聚乳酸-羥基乙酸共聚物的分子量為10000-40000道爾頓。
在本發明中,所述第二聚合物材料的封端方式可為羧基封端、酯封端和羥基封端中的一種或多種;具體地,所述plga為羧基封端、酯封端或羥基封端;所述pcl為羧基封端、酯封端或羥基封端;所述pla為羧基封端、酯封端或羥基封端。
在本發明的優選實施例中,所述聚乳酸-羥基乙酸共聚物中乳酸和羥基乙酸的摩爾比為(50~85):(15~50)。所述plga的乳酸和羥基乙酸的摩爾比優選為50:50、75:25或85:15;分子量為10000-40000道爾頓,一周持續釋放藥物90%以上。
在上述實施方案中,本發明的注射用黃體酮控釋微球中,所述plga的乳酸和羥基乙酸摩爾比具體可為50:50、75:25。在上述實施方案中,本發明的注射用黃體酮控釋納米粒中,所述plga的乳酸和羥基乙酸摩爾比可為85:15、75:25。
在上述實施方案中,本發明的注射用黃體酮控釋微球的載藥量可為30%-40%,優選為32%-40%;所述納米粒載藥量為10%-20%。在本發明的實施例中,所述的黃體酮緩釋微球的比表面積為440~500m2/kg。
在上述實施方案中,本發明的注射用黃體酮控釋微球的粒徑控制在5-20μm范圍內,優選10μm-20μm,更優選11-15μm;所述納米粒粒徑控制在100nm-400nm,優選200-300nm。
本發明提供一種黃體酮緩釋微球的制備方法,包括以下步驟:
1)將黃體酮和第一聚合物材料溶于有機溶劑中,形成有機相;所述第一聚合物材料選自聚乳酸-羥基乙酸共聚物、聚乳酸、聚己內酯和聚乙醇酸中的一種或多種;所述第一聚合物材料的分子量為4000~40000道爾頓;2)將步驟1)得到的有機相倒入含乳化劑的水溶液中,經高速剪切乳化,得到水包油型乳液;3)將步驟2)得到的水包油型乳液用水稀釋后,進行減壓蒸餾,得到微球混懸液;4)將步驟3)得到的微球混懸液用水洗滌后,經固液分離,得到黃體酮緩釋微球。
為實現上述目的,本發明一些實施例提供的黃體酮微球的制備的技術方案包括如下步驟:
(1)將黃體酮和聚合物材料如plga溶于一定量的有機溶劑中,形成有機相;(2)將步驟(1)中的有機相迅速倒入聚乙烯醇溶液中,經高速剪切乳化,得到o/w乳液;(3)將步驟(2)中的乳液用五倍體積蒸餾水稀釋后,減壓蒸餾除去有機溶劑而固化微球;(4)將步驟(3)所得微球混懸液用去離子水反復洗滌多次,除去多余的聚乙烯醇,離心收集,經冷凍干燥,即得黃體酮-plga微球等黃體酮緩釋微球。
本發明實施例稱取第一聚合物材料和黃體酮,溶解于有機溶劑中形成有機相。其中,所述第一聚合物材料的內容如前所述,在此不再一一贅述。此外,本發明對黃體酮的晶型沒有特殊限制。在本發明中,黃體酮與第一聚合物材料投料重量比可為1:1.5-2。
在本發明中,所述有機溶劑如醇類、烴類、酯類等。本發明優選采用二氯甲烷(dcm)作為有機溶劑,其對黃體酮和plga等的溶解度高,且沸點低,易揮發除去。在本發明的一些實施例中,所述有機溶劑為二氯甲烷和苯甲醇的混合溶液;具體地,dcm和苯甲醇的體積比可為9:1、8:2、7:3。本發明實施例利用苯甲醇在有機相和水相均有一定親和力,調節藥物在微球中的擴散速率,從而改變藥物在微球內的分布而影響釋放情況。
本發明實施例將得到的有機相迅速倒入含乳化劑的水溶液中,高速剪切形成o/w乳液。其中,所述乳化劑優選為聚乙烯醇(pva),即本發明優選以含聚乙烯醇的水溶液作為水相。在本發明的一些實施例中,聚乙烯醇水溶液的質量濃度可為0.5%-2%,優選為1~1.5%,最優選為1%。所述有機相與水相體積比可為1:15~20,優選為1:16.6。
在本發明中,通過高速剪切進行乳化,得到水包油型乳液。所述高速剪切的轉速優選為10000~14000rpm;剪切時間優選為1~2min。
乳化得到o/w乳液后,本發明實施例可用其5倍體積水稀釋,然后減壓蒸餾,揮發有機溶劑、固化微球,得到微球混懸液。其中,所述減壓蒸餾的溫度可為40~50℃;時間可為15min。
本發明實施例將得到的微球混懸液用水洗滌,去除多余的乳化劑pva等,然后離心收集微球,經冷凍干燥等本領域常規的固液分離方式,得到黃體酮緩釋微球。
本發明還提供一種黃體酮緩釋納米粒的制備方法,包括以下步驟:
1)將黃體酮和第二聚合物材料溶于有機溶劑中,形成有機相;所述第二聚合物材料選自聚乳酸-羥基乙酸共聚物、聚乳酸、聚己內酯和聚乙醇酸中的一種或多種;所述第二聚合物材料的分子量為6000~60000道爾頓;2)將步驟1)得到的有機相倒入含乳化劑的水溶液中,經高速剪切乳化,得到水包油型初乳液;將所述水包油型初乳液進行高壓勻質,得到終乳液;3)將步驟2)得到的終乳液用水稀釋后,通過低溫固化,得到微粒混懸液;4)將步驟3)得到的微粒混懸液用水洗滌后,經固液分離,得到黃體酮緩釋納米粒。
為實現上述目的,本發明另一些實施例提供的黃體酮納米粒的制備的技術方案包括如下步驟:
(1)將黃體酮和聚合物材料溶于處方量的乙酸乙酯和苯甲醇中,形成有機相;(2)將步驟(1)中的有機相迅速倒入含有乳化劑的水溶液中經高速剪切乳化,得到o/w初乳,初乳經高壓勻質機進一步降低粒徑,得到終乳;(3)將步驟(2)所得終乳用冷水稀釋,冰浴下攪拌3-4h固化微粒,得到微粒混懸液;(4)將步驟(3)所得微粒混懸液加入冷水,過空心膜組件除去有機溶劑,干燥后得到黃體酮緩釋納米粒。
此外,本發明可將除去有機溶劑的物質分裝在西林瓶中,加入適合的凍干保護劑進行冷凍干燥(凍干),即得黃體酮緩釋凍干粉針。
本發明稱取第二聚合物材料和黃體酮,加入有機溶劑中溶解,作為有機相。其中,所述第二聚合物材料的內容如前所述,在此不再一一贅述。此外,本發明對黃體酮的晶型沒有特殊限制。在本發明中,黃體酮與第二聚合物材料投料重量比可為1:1.5-2。
在上述本發明的納米粒制備方法中,所述有機溶劑如醇類、烴類、酯類等。在本發明的一些實施例中,所述有機溶劑為乙酸乙酯和苯甲醇的混合溶液;具體地,乙酸乙酯和苯甲醇的體積比可為4:1。本發明優選采用乙酸乙酯和苯甲醇混合溶劑,將聚合物材料和黃體酮于30~40℃水浴攪拌,溶解后得到有機相。
在制備納米粒的過程中,本發明實施例將得到的有機相迅速倒入含乳化劑的水溶液中,高速剪切形成o/w初乳液;將所述初乳液進行高壓勻質,得到終乳液。其中,所用的乳化劑優選為泊洛沙姆188;還可采用苯甲醇作為助乳化劑。泊洛沙姆(poloxamer)為聚氧乙烯聚氧丙烯醚嵌段共聚物,商品名為普蘭尼克(pluronic),屬于高分子非離子表面活性劑。泊洛沙姆188也稱f68,是一種水包油乳化劑。在本發明的一些實施例中,泊洛沙姆188在水相中的質量濃度為2%-5%;苯甲醇在水相中的質量濃度為1%-5%。此外,所述含乳化劑的水溶液中還可包含乙酸乙酯等,共同作為水相。具體地,所述油水相體積比可為1:8。
在本發明的一些實施例中,所述高速剪切的轉速可為10000rpm;剪切時間可為5min。在本發明的一些實施例中,所述高壓勻質的壓力可為600bar;勻質次數為5-7次。
得到終乳后,本發明實施例用冷水稀釋,通過冰浴下攪拌的低溫固化方式,固化微粒得到微粒混懸液;再加入冷水過空心膜組件,除去有機溶劑,干燥即得黃體酮緩釋納米粒。所述干燥可采用冷凍干燥,具體的,凍干工藝可包括:-40℃預凍四小時,抽真空,-40℃維持兩個小時,兩個小時升至-20℃維持三個小時,一個小時升至-10℃維持兩個小時,兩個小時升至0℃維持兩個小時,兩個小時升至20℃維持兩個小時。
或者,將除去有機溶劑的物質加入凍干保護劑,經凍干,得到凍干粉針。所述的凍干保護劑可選自乳糖、麥芽糖、葡萄糖、海藻糖、丙三醇、甘露醇、山梨醇、氯化鈉、磷酸鹽、聚乙烯吡咯烷酮(pvp)、羧甲基纖維素鈉(cmc-na)、聚乙二醇和白蛋白中的一種或幾種,優選為甘露醇。
本發明所述的注射用黃體酮控釋微球和黃體酮納米粒的外形圓整,粒度分布均勻,載藥量和包封率高,體內外持續釋放一周以上,累計釋放90%以上,且釋放均一穩定,可較長時間維持有效血藥濃度,給藥一次可維持一周治療之久,注射刺激性小,患者順應性好。
本發明的黃體酮長效制劑技術上分別采用乳化-溶劑揮發法制備黃體酮微球和納米乳化法制備黃體酮納米粒,分別在微米和納米級別實現藥物的控釋。采用生物可降解高分子材料包裹藥物制成注射用微球制劑給藥后,藥物通過在微球內的擴散和聚合物骨架的溶蝕控制釋放,達到長效平穩緩釋的目的。但微球粒徑較大,注射給藥時會產生一定刺激性(刺激性并不明顯),因此開發了黃體酮納米制劑。納米粒相對于微球而言,能夠更快的達到所需血藥濃度,且釋放更平穩。納米粒注射刺激性小,但載藥量相對微球低一些。
實驗表明兩種制劑在體內均可維持有效血藥濃度,達到一周及以上的緩釋效果,因而可以提高患者的依從性,提高療效。
本發明還提供一種黃體酮緩釋注射劑,其包括黃體酮顆粒和注射用溶劑;所述黃體酮顆粒為上文所述的黃體酮緩釋微球或黃體酮緩釋納米粒。
本發明提供的黃體酮緩釋注射劑為微球型或納米粒黃體酮長效制劑,該長效制劑包括黃體酮及生物可降解聚合物plga(乙交酯丙交酯共聚物)、pla(聚乳酸)、pcl(聚己內酯)、pga(聚乙醇酸)等;工藝方面分別采用乳化-溶劑揮發法制備黃體酮微球和納米乳化法制備黃體酮納米粒。
本發明提供的黃體酮緩釋注射劑采用肌肉注射,附有注射用溶劑。在本發明中,注射用溶劑可以使藥物懸浮,從而使給藥均勻、順利。所述注射用溶劑即常規的注射用微球復溶劑,可包括注射用水、ph值調節劑、滲透壓調節劑和穩定劑,如包含羧甲基纖維素鈉(cmc-na)、甘露醇中的一種或其混合物。在本發明的具體實施例中,所述注射用溶劑的成分包括無水檸檬酸、無水磷酸氫二鈉、聚山梨酯20、cmc-na、氯化鈉以及注射用水。
本發明通過粒徑、載藥量、包封率、體外釋放、體內藥動學等對黃體酮長效注射劑進行表征,結果顯示,本發明所制備微球粒徑在5-20μm范圍內,載藥量30%-40%,包封率在90%以上;納米粒粒徑在100-400nm范圍內,載藥量可達到10%-20%,包封率在80%-90%。采用37℃水浴搖床法進行體外釋放度測定,體內外相關性良好,達到了一周以上的緩釋效果。
根據研究人員進行的臨床調查,目前臨床上治療習慣性流產和輔助生殖劑量為肌注20mg/day和60mg/day。而本發明制劑設計劑量為140mg/周,140mg/支(以黃體酮計),一周給藥一次。在給藥劑量和頻率上均少于臨床普通制劑,而本品在后續藥動和藥效學學研究結果顯示,本品生物利用度和治療效果與市售制劑相當;而給藥劑量和頻率的減少可降低副作用的發生率,提高患者依從性。
附圖說明
圖1為本發明實施例黃體酮微球緩釋制劑與現有產品的血藥濃度曲線圖;
圖2為本發明實施例黃體酮納米粒緩釋制劑與現有產品的血藥濃度曲線圖;
圖3為本發明實施例制備的黃體酮微球的顯微鏡圖像(10×10);
圖4為本發明實施例制備的黃體酮微球的掃描電鏡圖(sem);
圖5為實施例1制備出的黃體酮緩釋微球的粒度測定結果;
圖6為實施例12制備出的黃體酮納米粒的粒度測定結果;
圖7為實施例2-4制備出的黃體酮緩釋微球的體外釋放曲線;
圖8為實施例16-18制備出的黃體酮納米粒的體外釋放曲線。
具體實施方式
下面對本發明實施例中的技術方案進行清楚、完整地描述,顯然,所描述的實施例僅僅是本發明一部分實施例,而不是全部的實施例。基于本發明中的實施例,本領域普通技術人員在沒有做出創造性勞動前提下所獲得的所有其他實施例,都屬于本發明保護的范圍。
為了進一步理解本申請,下面結合實施例對本申請提供的黃體酮緩釋微球及其制備方法、納米粒及其制備方法和黃體酮緩釋注射劑進行具體地描述。
以下實施例中,所用的黃體酮為晶型ⅱ、廠家:湖北葛店人福藥業有限責任公司,批號:htt151102。
實施例1黃體酮微球的制備
稱取150mgplga(50/50(乳酸和羥基乙酸的摩爾比例),分子量13000道爾頓,以下實施例表示同實施例1),75mg黃體酮,溶于1.5ml二氯甲烷中形成有機相。將有機相迅速倒入25ml、1%pva(日本可樂麗)溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍體積水稀釋后,40℃減壓蒸餾15min,揮發有機溶劑固化微球。將固化微球用去離子水洗滌多余pva后,離心收集微球,冷凍干燥,即得肌肉注射用黃體酮控釋微球。
其中,冷凍干燥工藝包括:-40℃預凍四小時,抽真空,-40℃維持兩個小時,兩個小時升至-20℃維持三個小時,一個小時升至-10℃維持兩個小時,兩個小時升至0℃維持兩個小時,兩個小時升至20℃維持兩個小時。
實施例1中的處方及相關工藝參見表1:
表1實施例1中的處方及相關工藝參數
實施例2-4不同分子量plga制備微球
稱取150mgplga(50/50),分子量分別為13000、25000、30000道爾頓;75mg黃體酮,溶于1.5ml二氯甲烷中形成有機相。將有機相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍體積水稀釋后,40℃減壓蒸餾15min,揮發有機溶劑固化微球。將固化微球用去離子水洗滌多余pva后,離心收集微球,冷凍干燥,即得肌肉注射用黃體酮控釋微球。實施例2-4中的處方參見表2:
表2實施例2-4中的處方
實施例5-7不同理論載藥量微球制備
稱取150mgplga(50/50;13000),黃體酮稱量分別為75mg、90mg、100mg,溶于1.5ml二氯甲烷中形成有機相。將有機相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍體積水稀釋后,40℃減壓蒸餾15min,揮發有機溶劑固化微球。將固化微球用去離子水洗滌多余pva后,離心收集微球,冷凍干燥,即得肌肉注射用黃體酮控釋微球。實施例5-7制備出的黃體酮微球的理論載藥量參見表3:
表3實施例5-7制備出的黃體酮微球的理論載藥量
實施例8-11不同有機相微球制備
稱取150mgplga(50/50;13000),黃體酮75mg,按處方各比例有機溶劑溶解形成有機相。將有機相迅速倒入25ml、1%pva溶液中,12000rpm高速剪切2min形成o/w乳液。用5倍體積水稀釋后,40℃減壓蒸餾15min,揮發有機溶劑固化微球。將固化微球用去離子水洗滌多余pva后,離心收集微球,冷凍干燥,即得肌肉注射用黃體酮控釋微球。實施例8-11中的處方參見表4:
表4實施例8-11中的處方
黃體酮和plga在二氯甲烷極易溶解,且二氯甲烷沸點低,易揮發除去,故本發明首選二氯甲烷作為有機溶劑。苯甲醇在有機相和水相均有一定親和力,可調節藥物在微球中的擴散速率,從而改變藥物在微球內的分布,從而影響釋放情況。苯甲醇加入量不同,微球突釋量有差異,考慮影響了藥物在微球中的分布。
實施例12黃體酮納米粒的制備
以處方量稱取plga(20000;50/50)和黃體酮,加入乙酸乙酯和苯甲醇混合溶劑中,于35℃水浴攪拌溶解后作為有機相。將f68作為乳化劑溶于水溶液,再加入處方量的苯甲醇以及乙酸乙酯于35℃加熱攪拌均勻后作為水相。在剪切條件下將有機相加入到水相中,得到初乳后,經過高壓均質后,加冷水淬火(溫度控制在<5℃),攪拌固化3-4h,加入冷水經過中空纖維膜組件除去有機溶劑,離心過濾后,得黃體酮納米粒;再加入f68凍干后,得黃體酮凍干粉針。
其中,冷凍干燥工藝包括:-40℃預凍四小時,抽真空,-40℃維持兩個小時,兩個小時升至-20℃維持三個小時,一個小時升至-10℃維持兩個小時,兩個小時升至0℃維持兩個小時,兩個小時升至20℃維持兩個小時。
實施例12中的處方及相關工藝參見表5:
表5實施例12中的處方及相關工藝參數
實施例13-15不同乳化劑濃度制備黃體酮納米粒
以處方量稱取plga(20000;50/50)和黃體酮,加入乙酸乙酯和苯甲醇混合溶劑中,于35℃水浴攪拌溶解后作為有機相。將f68作為乳化劑溶于水溶液,再加入處方量的苯甲醇以及乙酸乙酯于35℃加熱攪拌均勻后作為水相。在剪切條件下將有機相加入到水相中,得到初乳后,經過高壓均質后,加冷水淬火(溫度控制在<5℃),攪拌固化3-4h,加入冷水經過中空纖維膜組件除去有機溶劑,離心過濾后,得黃體酮納米粒;再加入甘露醇凍干后,得黃體酮凍干粉針。實施例13-15中的處方及相關工藝參見表6:
表6實施例13-15中的處方及相關工藝參數
本發明實施例中乳化劑濃度主要影響納米粒的粒徑及粒徑分布,乳化劑濃度越高,粒徑越小,分布越窄,但有極限值。
實施例16-18不同聚合物材料制備黃體酮納米粒
以處方量分別稱取plga、pla、pcl(分子量均為20000,各材料均為羧基端)和黃體酮,加入乙酸乙酯和苯甲醇混合溶劑中,于35℃水浴攪拌溶解后作為有機相。將f68作為乳化劑溶于水溶液,再加入處方量的苯甲醇以及乙酸乙酯于35℃加熱攪拌均勻后作為水相。在剪切條件下將有機相加入到水相中,得到初乳后,經過高壓均質后,加冷水淬火(溫度控制在<5℃),攪拌固化3-4h,加入冷水經過中空纖維膜組件除去有機溶劑,離心過濾后,得黃體酮納米粒;再加入甘露醇凍干后,得黃體酮凍干粉針。實施例16-18中的處方及相關工藝參見表7:
表7實施例16-18中的處方及相關工藝參數
實施例19-21不同工藝參數制備黃體酮納米粒
以處方量分別稱取plga、pla、pcl(分子量均為20000,各材料均為羧基端)和黃體酮,加入乙酸乙酯和苯甲醇混合溶劑中,于35℃水浴攪拌溶解后作為有機相。將f68作為乳化劑溶于水溶液,再加入處方量的苯甲醇以及乙酸乙酯于35℃加熱攪拌均勻后作為水相。在剪切條件下將有機相加入到水相中,得到初乳后,經過高壓均質后,加冷水淬火(溫度控制在<5℃),攪拌固化3-4h,加入冷水經過中空纖維膜組件除去有機溶劑,離心過濾后,得黃體酮納米粒;再加入甘露醇凍干后,得黃體酮凍干粉針。實施例19-21中的處方及相關工藝參見表8:
表8實施例19-21中的處方及相關工藝參數
本發明實施例中工藝參數主要是高壓均質的壓力及均值次數,其影響納米粒的粒徑及粒徑分布;均質壓力越大、次數越多,粒徑越小、分布越窄,但壓力過大或次數過多則會影響穩定性。
實施例22本發明的黃體酮長效制劑的藥物動力學分析
1、根據實施例1方法所制備的2.52mg(以黃體酮計)的黃體酮微球,對sd大鼠(體重大約200g)的后腿股二頭肌進行肌肉注射,并以市售的黃體酮注射液(廠家:浙江仙琚制藥股份有限公司,批號:h33020828)為對照試驗。本發明緩釋制劑中的注射用溶劑即常規的注射用微球復溶劑,成分包括無水檸檬酸、無水磷酸氫二鈉、聚山梨酯20、cmc-na、氯化鈉以及注射用水(本注射用溶劑成分參考市售利培酮(恒德)說明書)。
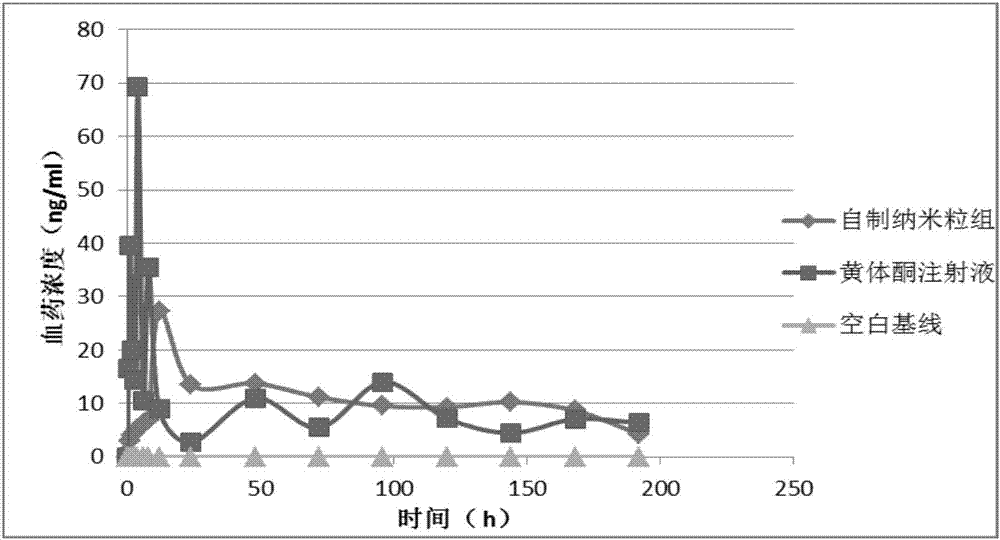
對受試大鼠定期眼后靜脈叢取血,通過建立lc-ms法測定血漿中黃體酮的藥物濃度。給藥0-180h的血藥濃度參見圖1,圖1為本發明實施例黃體酮微球緩釋制劑與現有產品的血藥濃度曲線圖。從圖1藥動力學試驗結果可以看出,本發明長效注射劑大鼠體內突釋量低于黃體酮注射劑,血藥濃度較平穩,未有明顯波動,可達到一周以上的緩釋效果。
2、根據實施例12方法所制備的2.52mg(以黃體酮計)的黃體酮納米粒,對sd大鼠(體重大約200g)的后腿股二頭肌進行肌肉注射,并以市售的黃體酮注射液(1ml:20mg)為對照試驗。本發明緩釋制劑中的注射用溶劑即注射用微球復溶劑,成分包括無水檸檬酸、無水磷酸氫二鈉、聚山梨酯20、cmc-na、氯化鈉以及注射用水。
對受試大鼠定期眼后靜脈叢取血,通過建立lc-ms法測定血漿中黃體酮的藥物濃度。給藥0-180h的血藥濃度參見圖2,圖2為本發明實施例黃體酮納米粒緩釋制劑與現有產品的血藥濃度曲線圖。
通過對上述兩種工藝制備的黃體酮長效制劑進行藥動學比較,納米乳化法制備長效注射劑可迅速達到所需血藥濃度,釋放曲線更加平穩。微球型長效制劑雖較晚達峰,釋放亦平穩,且載藥量高,注射體積小。
實施例23黃體酮長效制劑特性測試
1、外觀檢測。將上述實施例1制備出的黃體酮微球分別于光學顯微鏡和掃描電鏡下觀察,結果參見圖3和圖4,圖3為本發明實施例制備的黃體酮微球的顯微鏡圖像(10×10),圖4為本發明實施例制備的黃體酮微球的掃描電鏡圖(sem)。從以上結果可見,本發明制備出的微球呈規則圓形。
2、粒徑和粒徑分布
將上述實施例1制備出的黃體酮-plga微球用蒸餾水及0.1%cmc-na配成混懸液,應用百特激光粒度儀進行粒度測定。實施例1制備出的黃體酮緩釋微球的粒度測定結果見圖5和表9,圖5為實施例1制備出的黃體酮緩釋微球的粒度測定結果。由以上結果可知,微球d50為11.42μm,span1.623,粒徑分布較均一。
表9實施例1制備出的黃體酮緩釋微球的粒度測定數據
取一定量上述實施例12中的黃體酮納米粒,稀釋至一定濃度,應用nicomp380粒度測定儀進行粒度測定。實施例12制備出的黃體酮納米粒的粒度測定結果見圖6和表10,圖6為實施例12制備出的黃體酮納米粒的粒度測定結果。由以上結果可知,平均徑:175.4nm;pi0.059(pi<0.1),呈均一正態分布。
表10實施例12制備出的黃體酮納米粒的粒度測定數據
3、載藥量和包封率。精密量取上述實施例制備出的黃體酮長效制劑10mg置25ml容量瓶中,加入1ml乙腈振蕩溶解,用乙腈定容置刻度,混勻,用0.45μm微孔濾膜過濾即可。用hplc法測定載藥量和包封率,計算公式如下,結果為:載藥量為36%,包封率為90%。
實施例24釋放行為
關于體外釋放度方法的建立,本發明考慮體內外相關性,采用37度、100rpm/min水浴搖床法測定體外釋放。釋放介質采用0.5%sds溶液以滿足漏槽條件。取樣時,2500rpm離心10min,取上清液進樣分析,棄去9ml介質,更換新鮮介質。
實施例2、3、4的對比測定結果參見圖7,圖7為實施例2-4制備出的黃體酮緩釋微球的體外釋放曲線。
從圖7可以看出,實施例2的微球在開始的24h內黃體酮釋放了21.20%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為92.13%;實施例3的微球在開始的24h內黃體酮釋放了15.96%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為80.65%;實施例4的微球在開始的24h內黃體酮釋放了10.58%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為65.90%。
實施例2、實施例3、實施例4的微球所用plga分子量在10000-30000間,在釋放過程中沒有突釋現象,可連續釋放一周。其他實施例具有如實施例2、實施例3、實施例4相似的釋放特性;分子量越大的plga所制備的微球釋放速度越慢。
實施例16、17、18的對比測定結果參見圖8,圖8為實施例16-18制備出的黃體酮納米粒的體外釋放曲線。
從圖8可以看出,實施例16的納米粒在開始的24h內黃體酮釋放了23.43%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為90.21%;實施例17的納米粒在開始的24h內黃體酮釋放了18.33%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為69.30%;實施例18的納米粒在開始的24h內黃體酮釋放了14.08%,在之后的時間內緩慢釋放,在一周時間內累積釋放量為51.00%。
實施例16、實施例17、實施例18的納米粒所用聚合物材料為plga(75:25;25000)、pla(10000),pcl(10000)。聚合物材料不同,降解特點不同,均可連續釋放一周;材料降解速率為plga>pla>pcl。
綜上所述,本發明的黃體酮長效注射劑可在一周內釋放完,且釋放過程平穩,無明顯突釋現象,保證了臨床上一周給藥一次的治療方案。
- 還沒有人留言評論。精彩留言會獲得點贊!